类叶升麻苷对阿尔采末病小鼠皮层caspase-3基因表达的影响
彭晓明,高 莉,霍仕霞,闫 明
(新疆维吾尔自治区维吾尔医药研究所,新疆维吾尔医方剂学实验室,新疆乌鲁木齐 830049)
阿尔采末病(Alzheimer’s disease,AD)是一种老年性中枢神经系统退行性疾病,临床表现为记忆力减退和认知功能障碍。目前该病在我国65岁以上人群中发病率在3% ~5%[1],并呈逐年上升趋势,因此研究开发有效的AD防治药物成为当今医学领域的热点。类叶升麻苷(acteoside,AS)是传统补益中药——肉苁蓉中的一种苯乙醇苷类活性成分,含量在 0.3%以上。前期研究工作表明[2-4],AS对D-半乳糖或东莨菪碱诱导的小鼠学习记忆以及对H2O2诱导的PC12细胞氧化损伤均具有明显改善作用,因此AS可能在AD治疗中具有潜在应用价值。已有研究表明[5],通过D-半乳糖联合三氯化铝诱导小鼠90 d后,可出现学习记忆能力减退、老年斑及神经细胞凋亡等AD病样特征。caspase-3是神经细胞凋亡调控的关键基因,其与AD发病具有重要联系[6]。本实验利用D-半乳糖和三氯化铝联合诱导小鼠建立AD模型,研究AS对AD小鼠皮层组织中caspase-3基因表达的影响,为初步阐明AS治疗AD的作用机制及其新药研制提供实验依据。
1 材料与方法
1.1 药物与试剂 类叶升麻苷(AS,纯度>98%),由本实验室自制[7];D-半乳糖(批号 1401534546030 21)购自 Sigma公司;AlCl3·6H2O(批号 20110704)为天津光复精细化工研究所产品;vitamin E(VitE,批号YY11518)购自上海源叶生物科技有限公司;AChE试剂盒(批号20130717)、BCA试剂盒(批号20130712)为南京建成生物工程研究所产品;4%多聚甲醛(批号09B27C68)、SABC免疫组化试剂盒(批号SA132100)购自武汉博士德生物工程有限公司;Caspase 3一抗(批号 GR123686-1)、β-actin一抗(批号 GR123987-1)、山羊抗兔 IgG二抗(批号GR119224-5)为Abcam公司产品。
1.2 主要仪器 IVC独立送风隔离笼具(苏州冯氏实验动物设备有限公司,IVC-Ⅱ),跳台仪(济南益延科技发展有限公司,YLS-3TB),分析天平[BS224S,赛多利斯科学仪器(北京)有限公司],全波长酶标仪(美国ThermoFisher公司,Multiskan Go 1510),高速低温离心机(美国 Beckman公司,ALLEGRA64R),光学显微镜(德国 LEICA公司,DM2500),生物组织摊烤片机(天津天利航空机电有限公司,KZPJ-1A),生物组织包埋机(浙江科迪仪器设备有限公司,KD-BMⅡ),组织脱水机(浙江科迪仪器设备有限公司,KEDEE KD-TS3D),石蜡切片机(德国LEICA公司,RM2135)。
1.3 动物模型制备及分组给药 KM小鼠(♀,18±2 g),购自新疆维吾尔自治区实验动物中心。于IVC盒中适应性饲养7 d,经强迫游泳和疲劳转棒测试,剔除体能和智力较差的小鼠。选取120只小鼠,称取体重,随机分成6组,即:正常组,模型组,阳性药(VitE)组,AS低、中、高剂量组,每组20只。分组完成后,正常组小鼠分别腹腔注射和灌胃10 ml·kg-1·d-1的生理盐水,其余各组小鼠腹腔注射60 mg·kg-1·d-1的 D-半乳糖和灌胃 5 mg·kg-1·d-1的AlCl3,连续造模60 d。从 d 61开始,上午小鼠继续造模,下午对小鼠进行灌胃给药,连续给药30 d(造模和给药共 90 d):① 正常组:10 ml·kg-1·d-1的生理盐水;② 模型组:10 ml·kg-1·d-1的生理盐水;③ VitE组:150 mg·kg-1·d-1的维生素E;④ AS低剂量组:30 mg·kg-1·d-1的 AS;⑤ AS中剂量组:60 mg·kg-1·d-1的 AS;⑥ AS高剂量组:120 mg·kg-1·d-1的 AS。
1.4 跳台法测定小鼠学习与记忆能力 小鼠造模d 89,AS给药2 h后开始训练,将小鼠放入跳台箱内适应环境3min,然后立即通以36V,2mA的交流电。此时,小鼠为了逃避遭受电击而跃上安全平台,开始计时并观察5 min内受电击的次数(即错误次数),作为学习成绩。同时记录计时开始至小鼠走下平台遭受电击的时间,作为下台潜伏期,潜伏期超过300 s,则以300 s计算。24 h后测其记忆能力:将训练过的小鼠稳当地放于跳台上,通电并开始计时,记录开始至小鼠走下平台的时间(下台潜伏期),以及5 min内小鼠走下平台遭受电击的次数(即错误次数),作为记忆成绩,进行统计学检验。
1.5 小鼠血清与脑组织中AChE活性的测定 小鼠完成给药和跳台测试后,每组取10只摘眼球取血,分离血清。然后在冰上剥离脑组织并称重,加入9倍的生理盐水,匀浆并以3 500 r·min-1离心10 min,吸上清液备用。利用南京建成生物工程研究所的AChE试剂盒和BCA试剂盒测定小鼠血清与脑组织中AChE活性,具体测定方法为:分别设置并标记测定管、对照管、标准管(3个)和空白管(3个)。在测定管中加入50μl的待测血清或脑组织匀浆,标准管中加入50μl的1 mmol·L-1标准应用液,空白管加入50μl双蒸水,对照管不加。然后在所有管中加入500μl的底物缓冲液和500μl的显色应用液,混匀,37℃反应6 min。反应完成后,依次在所有管中加入30μl的抑制剂、100μl的透明剂、50 μl的稳定剂,同时样品对照管中加入50μl的待测血清或脑组织匀浆。混匀,室温放置15 min,于全波长酶标仪测定412 nm处吸光度值。并通过公式计算小鼠血清与脑匀浆中的AChE活性。血清中AChE活力=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×样品测试前稀释倍数;脑匀浆中AChE活力=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度÷待测样本蛋白浓度。
1.6 HE染色观察小鼠皮层组织结构的变化 每组另取10只小鼠,脱颈椎处死,于冰上剥离脑组织,以预冷的生理盐水洗涤1遍,之后将脑组织固定于4%的多聚甲醛过夜。脑组织经常规脱水、透明、浸蜡、包埋、切片(每张切片厚度约为5μm)后,进行HE染色。具体方法为:①二甲苯Ⅰ5 min→二甲苯Ⅱ10 min→无水乙醇、95%乙醇Ⅰ、95%乙醇Ⅱ、80%乙醇各5 s→水洗(直接入自来水洗一遍)。②苏木精染色5~10 min。③自来水洗,洗去多余的染液(可多洗几遍)。④盐酸乙醇分化(先备好足够的自来水,将切片在盐酸乙醇缸内快速沾一下,立即入自来水中返蓝,换一遍自来水继续返蓝1 min)。⑤伊红染液3~5 min。⑥自来水洗,洗去多余的染液(可多洗几遍)。⑦脱水(梯度酒精80%、95%I、95%乙醇Ⅱ、无水乙醇各5 s)。⑧透明(二甲苯Ⅰ、二甲苯Ⅱ各5 s),取出封片(中性树胶)。⑨镜检,在显微镜下观察切片并拍照。应用Image-pro plus 6.0分析软件分别选取相同倍数下的3个视野,进行神经细胞计数。
1.7 免疫组化观察小鼠皮层组织中caspase-3的表达变化 将石蜡切片按方法“1.6”进行脱蜡和水化,然后进行免疫组化染色,具体方法如下:①去除内源性过氧化物酶:3%H2O2室温10 min,蒸馏水洗,PBS液洗。②预处理(抗原修复):0.01 mol·L-1枸橼酸抗原修复液,微波修复,解冻温度(92~98)℃10 min,室温冷却,蒸馏水洗1遍,PBS液洗1遍。③加caspase-3一抗,37℃温箱孵育60min或4℃冰箱过夜,PBS液洗3遍。④滴加通用型IgG抗体-HRP多聚体(二抗),37℃温箱孵育25 min,PBS液洗3遍。⑤新鲜配制的DAB显色液显色(显微镜下控制显色时间3~10 min),自来水终止显色。⑥苏木精复染5~10 min,蒸馏水洗,盐酸乙醇分化(快速沾一下),温水返蓝1 min、脱水(梯度乙醇80%、95% Ⅰ Ⅱ、无水乙醇各5 s)、透明(二甲苯Ⅰ、Ⅱ各5 s)。⑦封片(中性树胶),显微镜观察并拍照。应用Image-pro plus 6.0分析软件,分别选取相同倍数下的6个视野,进行阳性细胞计数。同时依照细胞阳性着色程度(抗原含量)进行吸光度评分,评分标准为:弱阳性(1分),中等阳性(2分),强阳性(3分)。
1.8 统计学处理 数据均以±s表示,利用SPSS 17.0统计软件处理,用one-way ANOVA进行组间比较分析。
2 结果
2.1 AS对AD小鼠学习与记忆的影响 小鼠跳台实验常被用于评价痴呆小鼠被动回避学习记忆能力。与正常组比较,KM小鼠经D-半乳糖联合三氯化铝诱导90 d后,其下台潜伏期明显缩短(P<0.05),错误次数明显增加(P<0.01)。而经 AS给药30 d后,与模型组相比,AS各剂量组均可明显减少小鼠下台的错误次数(P<0.01),对其下台潜伏期具有一定延长作用,但差异无显著性(P>0.05)。结果表明AS对D-半乳糖联合三氯化铝诱导的小鼠被动回避学习能力具有一定改善作用。从24 h后的小鼠记忆能力测试结果发现,模型组小鼠回避记忆能力明显低于正常组小鼠,其下台潜伏期明显缩短(P<0.05)、错误次数明显增加(P<0.05)。与模型组相比较,除VitE组以外,其余AS给药组均能明显延长下台潜伏期(P<0.05或P<0.01)和减少错误次数(P<0.05或 P<0.01)。此外,AS低、中剂量组较正常组能延长小鼠下台潜伏期(P<0.05)和减少错误次数(P<0.05或 P<0.01),AS高剂量组也能明显减少错误次数(P<0.05),结果表明AS具有良好的改善和增强模型小鼠记忆能力损伤的作用(Tab 1)。
2.2 AS对AD小鼠血清和脑组织中AChE活性的影响 乙酰胆碱(ACh)是中枢神经系统的主要神经递质之一,与学习记忆密切相关,AChE是ACh的水解酶,其活力可间接反映ACh的含量,反映胆碱能神经功能的情况。本实验中小鼠经D-半乳糖和AlCl3诱导造模90 d后,模型小鼠血清和脑组织中AChE活力明显高于正常组(P<0.05),说明造模对小鼠胆碱能神经功能有明显的损伤作用。而经不同浓度AS治疗30 d后,与模型组比较,AS低、中剂量组均能明显抑制 AChE活力(P<0.05或 P<0.01),表明除AS高剂量组以外,其余给药组对小鼠的胆碱能神经功能的损伤均具有改善作用(Tab 2)。
2.3 AS对AD小鼠皮层组织结构的影响 HE染色后,神经细胞胞质呈紫红色,核呈紫蓝色,可以清楚地观察细胞的整体形态。本实验中正常组小鼠皮层脑细胞结构正常,数量较多,胞核清晰,胞质丰富,间质无水肿表现。模型组小鼠皮层神经细胞减少,体积变小,胞核与胞质界限模糊,核固缩呈三角形或不规则形,核仁消失。与模型组比较,VitE组小鼠皮层神经细胞结构较正常,数量较多,虽仍有不同程度的神经细胞变形,但变形神经细胞数量明显减少;AS低、中、高剂量组小鼠皮层神经元细胞结构正常,密度增高,胞核清晰,胞质丰富。表明AS对D-半乳糖联合三氯化铝诱导小鼠皮层组织损伤具有一定的保护作用(Fig 1,2)。
2.4 AS对AD小鼠皮层组织中caspase-3表达的影响 应用免疫组织化学染色法检测各组小鼠皮层caspase-3表达的变化,光镜下可见caspase-3免疫组化染色阳性标记物为深浅不一的棕黄色颗粒,位于神经元胞质内。结果显示模型组小鼠皮层组织可以见到较多的caspase-3免疫反应阳性神经元,其阳性细胞数目以及光密度值评分均较正常组明显增高(P<0.01)。而 AS各给药组小鼠皮层均可见caspase-3免疫反应阳性神经元减少,染色变浅,其阳性细胞数目以及光密度值评分均较模型组明显降低(P<0.05或 P<0.01),而VitE组无明显变化(P>0.05)(Fig 3,Tab 3)。
Tab 1 Effects of acteoside on learning and memory ofm ice induced by a combination of D-galactose and AlCl3±s,n=12)

Tab 1 Effects of acteoside on learning and memory ofm ice induced by a combination of D-galactose and AlCl3±s,n=12)
*P<0.05,**P<0.01 vs control group;#P<0.05,##P<0.01 vs model group.
Group Concentration/mg·kg-1·d-1 Learning Memory Step-down latency/s Error frequency/t Control 127.44±25.35 3.56±0.89 186.72±55.2 Step-down latency/s Error frequency/t 1.00±0.29 Model 86.94±27.69* 6.44±1.20** 135.72±49.58* 1.50±0.25*VitE 150 95.24±33.32 3.41±1.17## 168.65±48.65 1.41±1.58 AS 30 104.78±45.96 3.44±0.57## 252.33±61.526*## 0.56±0.25*##AS 60 98.94±26.37 3.82±1.07## 258.59±70.77*## 0.29±0.22**##AS 120 103.29±89.32 3.94±1.46## 216.35±101.16# 0.65±0.38*#0
3 讨论
AD作为一种原因不明、进行性、与衰老相关的中枢神经系统退行性疾病,是老年痴呆的最常见原因。迄今为止,AD的发病机制仍不明确,由于缺少理想的细胞及动物评价模型,因而导致AD的预防、治疗及新药研制受到限制。文献资料显示[8-9],D-半乳糖会引起脑神经元的一系列退行性变化。D-半乳糖可在醛糖还原酶的作用下生成半乳糖醇和H2O2,同时在反应过程中生成超氧阴离子。通过对啮齿类动物长期注射D-半乳糖可引起过量的氧自由基,在动物体内与细胞中的脂质、蛋白和核酸产生非酶糖基化、氧化应激-自由基损伤作用及诱导醛糖还原酶活性增强等一系列病理改变,进而使其多器官功能衰退而出现亚急性衰老表现。AD患者脑组织中的铝含量也较正常人有所增高[10],含量可达(3.6±2.9)mg·g-1。铝元素具有神经毒性,其通过离子形式可透过肠屏障和血脑屏障,进入大脑取代Ca2+和Mg2+,与氨基酸链上的谷氨酸或精氨酸的羧基结合形成谷氨酸铝盐或精氨酸铝盐的稳定复合物。Yang[11]和 Luo[5]等利用 D-半乳糖和三氯化铝共同作用,成功诱导小鼠产生学习记忆力减退,脑内AChE活性升高,Aβ水平升高等AD病理特征。因此,应用D-半乳糖联合三氯化铝对大脑的综合毒性模型,更贴近人类的AD病症,也更有利于AD药物的药效评价。
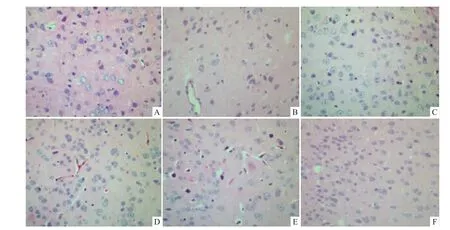
Fig 1 Effect of acteoside on tissue structure changes of cerebral cortex in m ice induced by a combination of D-galactose and AlCl3(400×)A:Control group;B:Model group;C:VitE group;D:AS(30 mg·kg-1·d-1);E:AS(60 mg·kg-1·d-1);F:AS(120 mg·kg-1·d-1)
Tab 2 Effects of acteoside on activity of AChE in serum and brain ofm ice induced by a combination of D-galactose and AlCl3(x¯±s,n=10)
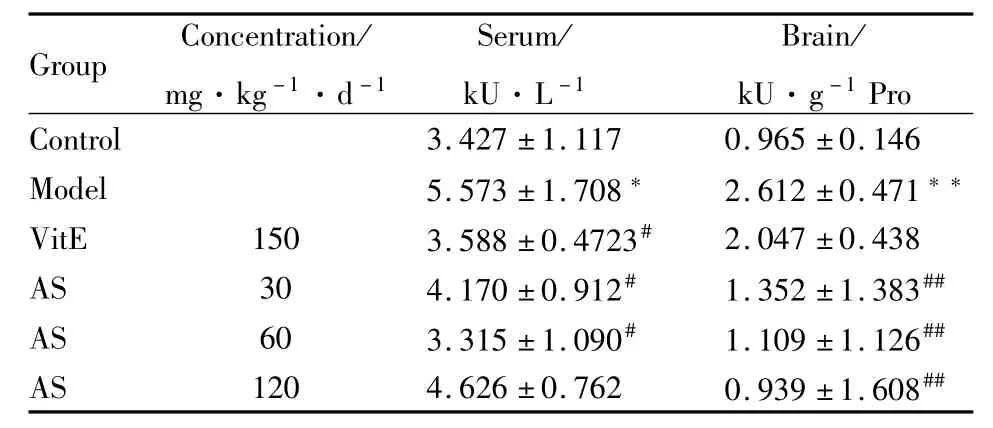
Tab 2 Effects of acteoside on activity of AChE in serum and brain ofm ice induced by a combination of D-galactose and AlCl3(x¯±s,n=10)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model.
Group Concentration/mg·kg-1·d-1 Serum/kU·L-1 Brain/kU·g-1Pro Control 3.427±1.117 0.965±0.146 Model 5.573±1.708* 2.612±0.471**VitE 150 3.588±0.4723# 2.047±0.438 AS 30 4.170±0.912# 1.352±1.383##AS 60 3.315±1.090# 1.109±1.126##AS 120 4.626±0.762 0.939±1.608##

Fig 2 Effect of acteoside on number of neuron changes of cerebral cortex in m ice induced by a combination of D-galactose and AlCl3(¯x±s,n=10)*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model.
Tab 3 Expression of caspase-3 of cerebral cortex in m ice induced by a combination of D-galactose and AlCl3(±s,n=10)
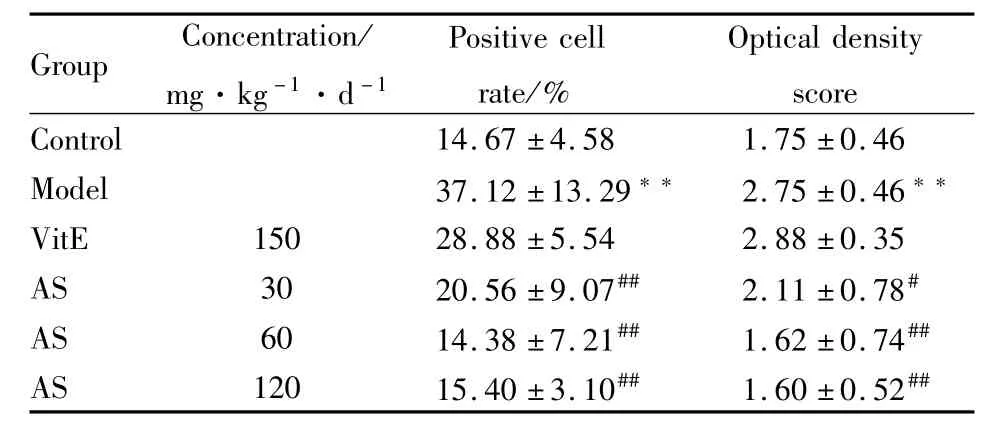
Tab 3 Expression of caspase-3 of cerebral cortex in m ice induced by a combination of D-galactose and AlCl3(±s,n=10)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model.
Group Concentration/mg·kg-1·d-1 Positive cell rate/%Optical density score Control 14.67±4.58 1.75±0.46 Model 37.12±13.29** 2.75±0.46**VitE 150 28.88±5.54 2.88±0.35 AS 30 20.56±9.07## 2.11±0.78#AS 60 14.38±7.21## 1.62±0.74##AS 120 15.40±3.10## 1.60±0.52##

Fig 3 Expression of caspase-3 of cerebral cortex in m ice induced by a combination of D-galactose and AlCl3(40×)A:Control group;B:Model group;C:VitE group;D:AS(30 mg·kg-1·d-1);E:AS(60 mg·kg-1·d-1);F:AS(120 mg·kg-1·d-1)
本实验利用D-半乳糖联合三氯化铝诱导小鼠90 d后,与正常组比较,模型组小鼠的学习、记忆能力明显下降,血清和脑组织中的AChE活性明显升高,证明AD模型建立成功。通过30、60、120 mg·kg-1·d-1的 AS治疗 30 d后,与模型组比较,AS各给药组小鼠在跳台检测中均能延长下台潜伏期和减少错误次数,同时小鼠血清和脑组织中AChE活性亦明显降低,表明AS对D-半乳糖联合三氯化铝诱导的小鼠脑损伤具有明显保护作用,尤其是对小鼠记忆能力的改善作用较明显。此外,在30~120 mg·kg-1·d-1的给药浓度范围内,AS对脑损伤小鼠的保护作用无浓度依赖性。
已有研究表明[6],AD脑内存在神经元丢失现象,而细胞凋亡与AD发病关系密切。caspase-3是半胱氨酸蛋白酶家族caspases成员之一,不仅参与AD患者脑内β淀粉样蛋白的切割,还是细胞凋亡调控的关键环节之一[12]。正常生理状态下,caspase-3以酶原形式(33 ku)存在于细胞质中,一旦受到凋亡信号刺激,活化的caspase-3便能特异性切割DNA,使参与DNA损伤修复过程的PARP以及DNA-PK等失活,促使染色质凝集和核酶激活,而导致细胞凋亡[6]。因此,筛选caspase-3活化抑制剂及神经元凋亡抑制药物可能是AD治疗的一个重要靶向。本研究结果显示,模型组小鼠皮层组织中的神经细胞明显减少,caspase-3基因表达明显上调。而经不同浓度AS治疗后,小鼠皮层组织中神经细胞的形态和数量均较模型组有明显改善,且皮层组织中caspase-3的基因表达明显下调。在给药浓度范围内,AS对小鼠皮层组织神经细胞的形态改善和caspase-3的基因表达调控亦无浓度依赖性。
综上所述,AS能够明显提高由D-半乳糖联合三氯化铝诱导的AD病样小鼠学习和记忆能力,抑制其血清和脑组织中的AChE活性。研究结果提示,AS对D-半乳糖联合三氯化铝诱导的小鼠脑损伤具有明显保护作用,其保护机制可能与AS抑制小鼠皮层组织caspase-3基因表达,进而维持皮层组织神经细胞的正常形态及数量有关。但是,caspase-3基因仅仅只是caspase凋亡基因家族中的一员,而AD又是多因素引起的复杂性疾病,因此在对AD小鼠治疗过程中,AS仅是通过抑制caspase-3基因表达,亦或是其还通过其他作用靶点发挥作用,仍有待于更深入的研究。
参考文献:
[1] 于大林,肖 军.阿尔茨海默病的流行病学调查现况[J].实用医院临床杂志,2011,8(3):152-5.
[1] Yu D L,Xiao J.Epidemiological investigationsof Alzheimer′s disease[J].Pract JClin Med,2011,8(3):152-5.
[2] 高 莉,林 娟,张富春,等.类叶升麻苷对D-半乳糖致衰老小鼠抗氧化作用的研究 [J].中国药理学通报,2013,29(10):1440-3.
[2] Gao L,Lin J,Zhang F C,et al.Antioxidant effects of acteoside on aged mice induced by D-galactose[J].Chin Pharmacol Bull,2013,29(10):1440-3.
[3] 林 娟,高 莉,霍仕霞,等.类叶升麻苷对东莨菪碱致小鼠学习记忆障碍的改善作用[J].中国中药杂志,2012,37(19):2956-9.
[3] Lin J,Gao L,Huo SX,et al.Effectof acteoside on learning and memory impairment induced by scopolamine in mice[J].China J chin Mat Med,2012,37(19):2956-9.
[4] 彭晓明,高 莉,甘 萍,等.类叶升麻苷抗H2O2诱导的PC12细胞氧化损伤的保护作用[J].中药药理与临床,2013,29(3):35-8.
[4] Peng X M,Gao L,Gan P,etal.Study on protective effects of acteoside on oxidative damage of PC12 induced by H2O2[J].Pharmacol Clin Chin Mat Med,2013,29(3):35-8.
[5] Luo Y,Niu F,Sun Z,et al.Altered expression of Abetametabolism associated molecules from d-galactose/AlCl(3) induced mouse brain[J].Mech Ageing Dev,2009,130(4):248-52.
[6] 陈 雪,孙婧霞,蒋常文.Bcl-2、Caspase-3与阿尔茨海默病关系的研究进展[J].临床医学工程,2013,20(9):1177-9.
[6] Chen X,Sun J X,Jiang C W.Research progress on Bcl-2,Caspase-3 and Alzheimer′s disease[J].Clin Med Engineer,2013,20(9):1177-9.
[7] 闫 明,霍仕霞,高 莉,等.一种从列当科植物中制备类叶升麻苷的方法[P].中国专利,201310545177.5.
[7] Yan M,Huo SX,Gao L,etal.Amethod for preparation of acteoside from Orobanchaceae plant[P]. Chinese patent,201310545177.5.
[8] 杨吉平,赖 红,赵海花,等.D-半乳糖联合染铝大鼠海马结构Aβ及相关蛋白的表达[J].神经解剖学杂志,2011,27(6):633-6.
[8] Yang JP,Lai H,Zhao H H,et al.Expression of Aβand related protein in hippocampal formation of rats treated with D-galactose and aluminium trichloride[J].Chin J Neuroanatomy,2011,27(6):633-6.
[9] 陆盈盈,高良才,袁崇刚.D-半乳糖致老年性痴呆模型的评价和海马脑区甘丙肽表达研究[J].中国神经免疫学和神经病学杂志,2007,14(4):191-5.
[9] Lu Y Y,Gao L C,Yuan C G.Evaluation on Alzheimer-like diseasemodel induced by D-galactose and expression of galanin in the hippocampus[J].Chin JNeuroimm Neurol,2007,14(4):191-5.
[10]罗焕敏,肖 飞.D-半乳糖和三氯化铝诱导小鼠产生类阿尔茨海默病变[J].中国药理学与毒理学杂志,2004,18(1):22-6.
[10]Luo H M,Xiao F.Alzheimer-like pathological changes ofmice induced by D-galactose and aluminum trichloride[J].Chin JPharmacol Toxicol,2004,18(1):22-26.
[11]YangW N,Han H,Hu X D,et al.The effects of perindopril on cognitive impairment induced by d-galactose and aluminum trichloride via inhibition of acetylcholinesterase activity and oxidative stress[J].Pharmacol Biochem Behav,2013,31(6):114-5.
[12]高旭红,赖 红,赵海花,等.阿尔茨海默病大鼠海马结构及PC12细胞 caspase-3的表达[J].解剖学杂志,2012,35(1):12-5.
[12]Gao X H,Lai H,Zhao H H,et al.Expression of caspase-3 in hippocampal formation and PC12 cells after amyloidβtreatment[J].Chin JAnatomy,2012,35(1):12-5.