ERO1α及其DNA甲基化在同型半胱氨酸抑制肝细胞增殖中的作用
赵 丽,曹成建,刘现梅,孔繁琪,马文斌,周龙霞,陈久凯,张鸣号,焦 运,杨晓玲,姜怡邓
(宁夏医科大学1.检验学院、2.基础学院、3.总医院,宁夏 银川 750004)
同型半胱氨酸(homocysteine,Hcy)是甲硫氨酸代谢的中间产物,研究表明其可能通过甲硫氨酸循环影响基因的甲基化水平参与疾病的发生[1]。内质网氧化还原酶-1α(endoplasmic reticulum oxidoreductin 1-α,ERO1α)是存在于内质网的一种氧化酶,对维持内质网稳态发挥重要的作用[2],主要负责维持肝细胞生长、支持细胞生存等[3],研究表明,Hcy可通过内质网应激(endoplasmic reticulum stress,ERs)抑制肝细胞增殖[4],但 Hcy是否通过影响ERO1αDNA甲基化及其表达进而抑制肝细胞增殖目前未见报道。因此,本研究拟从DNA甲基化修饰角度探讨ERO1α在Hcy抑制肝细胞增殖中的作用,为防治高同型半胱氨酸血症(hyperhomocy steinemia,HHcy)提供理论依据。
1 材料与方法
1.1 主要仪器及试剂 超净工作台(苏州安泰,中国);CO2培养箱(Heraeus,德国);实时荧光定量PCR仪(上海风岭,中国);普通PCR仪(Bio-Rad,美国);Epoch全波段酶标仪(BioTek,美国);电泳仪(Bio-Rad,美国);凝胶成像仪(Bio-Rad,美国);RPMI1640培养基(Gibco);胎牛血清(Gibco);青、链霉素(碧云天生物技术研究所)胰酶(Solarbio);同型半胱氨酸(Hcy,Sigma);DNA提取试剂盒(TIANGEN);RNA提取试剂盒(TIANGEN);逆转录试剂盒(Fermantas);荧光定量试剂盒(Fermantas);anti-ERO1α(Abcom);HRP标记二抗(北京中杉);全蛋白提取试剂盒,MTT试剂盒(南京凯基生物科技发展有限公司);lipo2000(Invitrogen);DNA甲基化修饰试剂盒(ZYMO);引物(上海生工)。
1.2 方法
1.2.1 细胞分组及处理 HL7220肝细胞株购自长沙市湘雅研究所细胞库。用含10%胎牛血清及1%双抗的RPMI 1640培养液,于37℃、含5%CO2的培养箱中传代培养。用含100μmol·L-1Hcy的培养液刺激细胞,并设置正常对照组(0μmol·L-1Hcy),每组重复3次,孵育48 h后收集细胞,冻存于-80℃,待用。
1.2.2 荧光定量PCR法检测ERO1αmRNA的表达在Pubmed数据库中查询ERO1α获取其编码序列,采用Premier5.0设计相关引物。提取各组细胞的总RNA,按逆转录试剂盒说明书将mRNA反转录为cDNA,逆转录的反应条件为:42℃60 min,70℃5 min。以cDNA为模板进行荧光定量PCR。ERO1α荧光引物(上游 5′-ATCCTTTGGCTTCTGGTCAAG-3′;下游 5′-GTTGTGTCCCCATTTCTTTTCT-3′),PCR反应条件为:95℃ 10 min;95℃15 s,58℃ 30 s,72℃30 s,40个循环。
1.2.3 Western blot检测 ERO1α蛋白的表达 采用全蛋白提取试剂盒提取两组细胞全蛋白,取20μl进行SDS-PAGE凝胶电泳,120 mA恒流转膜1 h,5%的脱脂奶粉封闭2 h,与anti-ERO1α4℃孵育过夜,HRP标记二抗孵育2 h,于凝胶成像分析仪上成像分析,以 β-actin为内参,计算 ERO1α与 β-actin内参灰度值的比值,进行分析。
1.2.4 ERO1α重组质粒的构建及转染 提取肝细胞基因组DNA,扩增ERO1αDNA片段。上游引物:5′-CCGCTCGAGATGGGCCGCGGCTGGGGATTCTTGT-3′,下游引物:5′-AATTCTGCAGATGAATATTCTGTAACAAGTTCCTGAAGTTTTC-3′。设计 XhoI和 Pst I为酶切位点。将提纯的ERO1αDNA片段与EGFPN1质粒分别用XhoI和Pst I进行双酶切。用T4连接酶将ERO1αDNA片段定向克隆到EGFP-N1质粒的XhoI和Pst I酶切位点。构建的重组质粒命名为EGFP-N1-ERO1α。将重组质粒转入大肠杆菌DH5α感受态细胞中。挑取在含有氨苄青霉素的LB平板生长的单菌落,小量培养后,用特异性ERO1α引物对菌液进行PCR筛选,电泳验证产物长度。同时将培养菌株送上海生工公司进行测序。肝细胞密度达80%时,用lipo2000将重组质粒转染入肝细胞,以无血清培养基孵育6h。除去培养基,以含10%胎牛血清的培养基孵育48 h。
1.2.5 MTT检测肝细胞增殖活力 将肝细胞吹打成单细胞悬液,在96孔板中加入细胞悬液100μl/孔(约1×104),37℃、5%CO2环境培养24 h。除去培养液,分别加入普通培养液及含100μmol·L-1Hcy的培养液,每组8孔,孵育48 h后,除去培养液,每孔加50μl 1×MTT,37℃孵育4 h,除去上清,每孔加150μl DMSO,摇匀后用酶标仪测定550 nm波长处各孔的吸光度。
1.2.6 巢式降落式甲基化特异性 PCR(ntMSPCR)检测ERO1α启动子区DNA甲基化按DNA提取试剂盒说明书提取各组细胞全基因组DNA,亚硫酸盐修饰法对全基因组DNA进行甲基化修饰。nt-MSP法检测ERO1α启动子区DNA甲基化程度的改变。针对 ERO1α启动子区,在线(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi)设计一对外引物及两对内引物(外引物:上游5′-CCAATCCTAATCTTTTAA CATTCAAA-3′,下 游 5′-TAGTTTGGGTAATATGGTGAAATTT-3′;甲基化引物:上游5′-ACTAACCTACAATAATAC GATCGCA-3′,下游 5′-AGTTTGGGTAATATGG TGAAA TTTC-3′;非甲基化引物:上游 5′-ACTAACCTA CAATAAT ACAATCACA-3′,下游5′-AGTTTGGGTAATATGGTGAAATTTC-3′)。外引物扩增的反应条件为:95℃ 5 min;95℃30 s,62℃ 30 s,72℃ 30 s,20个循环,每个循环降0.5℃至49℃,72℃7min。以外引物的PCR产物为模板,进行内外引物的扩增。反应条件同外引物。取5μl PCR产物于2%的琼脂糖凝胶上电泳,用凝胶成像分析仪成像并分析甲基化条带及非甲基化条带的光密度,按如下公式进行计算:甲基化/%=甲基化OD值/(甲基化OD值+非甲基化OD值)×100%。
1.3 数据处理与分析 采用SPSS11.5软件进行统计处理,结果以¯x±s表示。两样本间比较采用t检验,多样本间比较采用单因素方差分析。
2 结果
2.1 Hcy抑制肝细胞增殖 100μmol·L-1Hcy刺激肝细胞48 h后,以MTT法检测正常对照组及Hcy干预组肝细胞增殖活力的改变,结果显示:与正常对照组相比,Hcy组肝细胞增殖活力明显降低,差异有统计学意义(P<0.01),见 Fig 1。
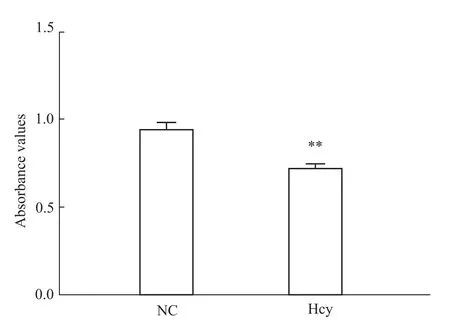
Fig 1 Hcy inhibits proliferative activity of hepatocytesCellswere treated with 100μmol·L-1 Hcy for48h.**P<0.01 vs NC group
2.2 Hcy抑制 ERO1α的表达 100μmol·L-1Hcy刺激肝细胞48 h后,分别以荧光定量PCR及Western blot检测正常对照组及Hcy干预组ERO1α mRNA及蛋白的表达水平。结果显示,Hcy干预后,ERO1αmRNA和蛋白表达水平均明显降低(P<0.01),见 Fig 2。
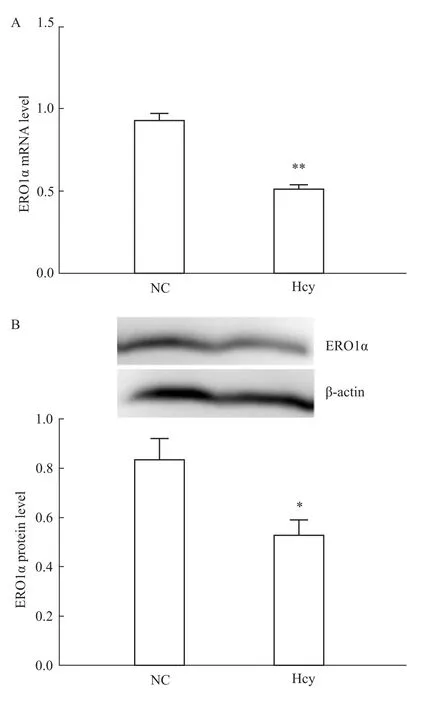
Fig 2 Hcy inhibits expression of ERO1αA:Change of ERO1αmRNA expression of the NC and Hcy groups;B:Change of ERO1αprotein expression of the NC and Hcy groups.Cells were treated with 100μmol·L-1 Hcy for48 h.*P<0.05,**P<0.01 vs NC group
2.3 ERO1α参与Hcy抑制肝细胞增殖 测序结果证明ERO1α重组质粒构建成功,见Fig 3A。转染肝细胞后,荧光显微镜下观察可见绿色荧光蛋白表达明显,见 Fig 3B。qRT-PCR及 Western blot验证ERO1αmRMA及蛋白表达增加,见Fig 3C,D。MTT法检测ERO1α过表达后肝细胞增殖活力的改变,与对照组相比,ERO1α重组组肝细胞增殖活力明显升高,差异有显著性(P<0.01),见 Fig 3E。
2.4 Hcy导致 ERO1αDNA甲基化改变 100 μmol·L-1Hcy刺激肝细胞后,分析ERO1αDNA甲基化水平的改变。结果显示:与正常对照组相比,ERO1αDNA甲基化程度增加,差异有显著性(P<0.05),见 Fig 4。
3 讨论
肝损伤病人依赖于肝脏的再生恢复正常代谢,而肝细胞增殖是肝脏再生的基础。HHcy被认为是肝纤维化、非酒精性脂肪肝等的独立危险因子[5-6]。研究表明Hcy可扰乱肝细胞正常的细胞周期进而抑制其增殖[4]。本研究结果显示Hcy刺激后肝细胞增殖活力减弱,与文献报道一致。
ERs是Hcy诱导细胞发生功能障碍的机制之一,ERO1α又名内质网氧化还原样蛋白(endoplasmic reticulum oxidoreduclin-like protein1α),是一种黄素蛋白,主要存在于内质网,其编码基因位于人类第14号染色体上,研究表明,其主要作用为参与新生肽链正确折叠成有生物活性的蛋白质[2]、维持细胞增殖等,其表达异常可引起内质网应激。ERO1α依赖的内质网应激可引起Ca2+释放,进而触发细胞凋亡途径。而ERO1α是否参与了Hcy导致的肝细胞增殖抑制未见报道。本研究结果表明:Hcy在抑制肝细胞增殖的同时,也导致了ERO1αmRNA及蛋白表达水平的明显下降。多次重复试验均得到一致的结果,提示ERO1α可能参与了Hcy抑制肝细胞增殖的过程。为了进一步验证此结果,构建了ERO1α重组质粒并转染肝细胞使其过表达,发现ERO1α过表达后Hcy对肝细胞增殖的抑制作用明显降低,表明ERO1α在Hcy抑制肝细胞增殖过程中发挥了关键作用。
Hcy是一种含硫氨基酸,是甲硫氨酸代谢的中间产物,参与了甲硫氨酸循环的关键环节[7]。Hcy浓度异常可导致甲硫氨酸循环紊乱,使甲基供体生成量改变引起多个基因甲基化状态的改变。DNA甲基化是指CpG位点的胞嘧啶被甲基修饰,从而在基因结构不发生改变的基础上调节基因的转录,DNA甲基化是发现较早的表观遗传学修饰方式之一,大量研究表明,DNA甲基化能引起染色质结构、DNA稳定性、DNA与转录因子结合情况的改变[8-9],从而控制基因表达。前期研究也发现 Hcy可使多种基因的甲基化状态发生改变,进而影响其表达。一般来讲,DNA甲基化改变包括低甲基化和高甲基化,低甲基化可促进基因的表达,而高甲基化则抑制基因表达[10]。ERO1α启动子区富含CpG位点,因此设想,DNA甲基化这一表观遗传学机制可能参与了Hcy调控ERO1α的表达进而抑制肝细胞增殖,因此我们进一步检测了Hcy干预后ERO1α启动子区甲基化程度的改变。研究结果表明:Hcy提高了ERO1α启动子区DNA甲基化程度,而DNA高甲基化是基因转录抑制的重要标志,与ERO1α mRNA及蛋白表达水平降低相一致。
综上所述,Hcy可能增加 ERO1α启动子区DNA甲基化程度,使ERO1α表达水平降低,进而导致肝细胞增殖抑制。此发现可能是Hcy导致肝功能障碍的重要机制,为进一步了解Hcy与肝脏疾病的关系提供了新的实验依据。

Fig 3 ERO1αinvolved in Hcy-induced proliferation inhibition of hepatocytesA:Result of sequencing of ERO1αrecombinant plasmid;B:Fluorescence images of hepatocyteswith recombinant plasmids;C:Change of ERO1α mRNA expression after transfected with recombinant plasmids;D:Change of ERO1αprotein expression after transfected with recombinant plasmids;E:Change of proliferative activity after transfected with recombinant plasmids.*P<0.05,**P<0.01 vs NC group
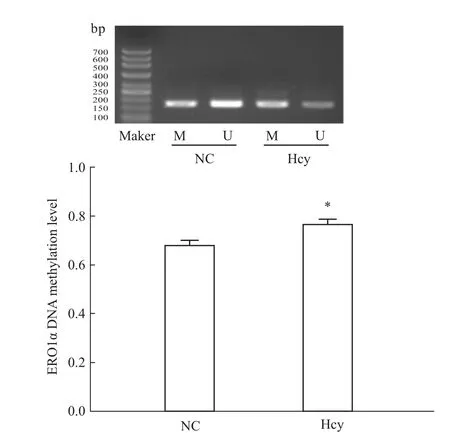
Fig 4 Hcy causes the change of ERO1αDNA methylation levelM:Methylated production;U:Unmethylated production.Cells were treated with 100μmol·L-1 Hcy for 48 h.*P<0.05 vs NC group.
参考文献:
[1] Jiang Y,Zhang H,Sun T,etal.The comprehensive effects of hyperlipidemia and hyperhomocysteinemia on pathogenesis of atherosclerosis and DNA hypomethylation in ApoE-/-mice[J].Acta Biochim Biophys Sin,2012,44(10):866-75.
[2] Masui S,Vavassori S,Fagioli C,et al.Molecular bases of cyclic and specific disulfide interchange between human ERO1 protein and protein-disulfide isomerase(PDI)[J].J Biol Chem,2011,286(18):16261-71.
[3] Rutkevich L A,Williams D B.Vitamin K epoxide reductase contributes to protein disulfide formation and redox homeostasiswithin the endoplasmic reticulum[J].Mol Biol Cell,2012,23(11):2017-27.
[4] Yu X,Lv JJ,Zhu Y Z,et al.Homocysteine inhibits hepatocyte proliferation via endoplasmic reticulum stress[J].Plos One,2013,8(1):e54265.
[5] Liu W H,Zhao Y S,Gao SY,etal.Hepatocyte proliferation during liver regeneration is impaired in mice with methionine diet-induced hyperhomocysteinemia[J].Am J Pathol,2010,177(5):2357-65.
[6] Aissa A F,Tryndyak V,de Conti A,et al.Effect ofmethioninedeficient and methionine-supplemented diets on the hepatic onecarbon and lipid metabolism in mice[J].Mol Nutrit Food Res,2014,58(7):1502-12.
[7] 杨安宁,王 磊,周龙霞,等.ABCA1、ACAT1 DNA甲基化在Hcy致THP-1单核细胞源性泡沫细胞胆固醇流出中作用研究[J].中国药理学通报,2014,30(3):340-4.
[7] Yang A N,Wang L,Zhou L X,etal.Effectsof Hcy on cholesterol effux of THP-1 monocyte-derived foam cells and mechanism of ABCA1 and ACAT1 DNA methylation regulation[J].Chin Pharmacol Bull,2014,30(3):340-4.
[8] Wang R,Xu J.Genomic DNA methylation and histone methylation[J].Yi Chuan,2014,36(3):191-9.
[9] Pacaud R,Sery Q,Oliver L,et al.DNMT3L interacts with transcription factors to target DNMT3L/DNMT3B to specific DNA sequences:Role of the DNMT3L/DNMT3B/p65-NFκB complex in the(de-)methylation of TRAF1[J].Biochimie,2014,18,[Epub ahead of print].
[10]杨 程,田 珏,蔡 欣,等.动脉粥样硬化患者基质金属蛋白酶组织抑制剂1基因DNA高甲基化的研究[J].实用医学杂志,2013,29(21):3530-2.
[10]Yang C,Tian J,Cai X,etal.A research ofmatrixmetalloproteinases inhibitor 1 DNA hypermethylation in atherosclerosis[J].J Pract Med,2013,29(21):3530-2.