白藜芦醇通过减缓内质网应激及增加 eNOS的表达改善高热量高胆固醇饮食引起的内皮损伤
程静静,陈 莉,李朝飞,陈冠军,鲍莹莹,鲁云霞
(安徽医科大学1.生物化学教研室、2.化学教研室,安徽合肥 230032;3.安徽医科大学附属第一医院内分泌科,安徽合肥 230022)
内质网是细胞内膜型/分泌型蛋白质合成的细胞器,在调节蛋白质正确折叠、钙稳态和细胞凋亡等方面具有重要作用,是维持血管内皮细胞功能的重要细胞器,葡萄糖、病毒感染、化学药物如衣霉素等多种刺激因素诱导的内质网内未折叠/错误折叠蛋白质反应(unfolded protein response,UPR)和钙稳态失衡等状态被称为内质网应激(ERS)[1]。过度的ERS是一系列疾病,包括动脉粥样硬化、糖尿病、神经退行性疾病和肾功能障碍等的诱因之一。
随着肥胖人群在全球范围内的增多,与动脉粥样硬化相关的代谢综合征也日益增多,血脂异常是动脉粥样硬化的起始步骤,其早期病变是内皮细胞的损伤[2]。白藜芦醇(resveratrol,RES)属于一种非黄酮类多酚化合物,存在于多种植物中,具有抗自由基、抗脂质过氧化作用,对动脉粥样硬化等心脑血管疾病的防治起重要的作用[3-4],但尚无其在血管内皮细胞中影响ERS的相关报道。已知氧化应激和ERS之间相互联系,一方面氧化应激干扰ER中的蛋白质折叠,另一方面UPR可引起氧化应激,因此推测RES的抗氧化作用可能减少UPR和ERS[5]。本实验旨在研究RES对高脂饮食小鼠胸主动脉血管内皮及细胞的影响是否与ERS有关。由于RES是天然无毒化合物,作用较缓慢,因此参照文献选取单一的较高剂量 RES(400 mg·kg-1·d-1)[6],体外实验先用不同浓度的RES预孵育,再用一定浓度的棕榈酸诱导,以观察其保护作用是否具有剂量效应。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞株 C57BL/6小鼠24只,8周龄,清洁级,♂,体质量20~25 g,由安徽医科大学实验动物中心提供,适应性饲养1周。小鼠胸主动脉内皮细胞(mouse aortic endothelial cells,MAEC),由合肥工业大学生物与食品工程学院刘健博士馈赠。
1.1.2 药物和试剂 动物实验用白藜芦醇购自南京泽朗医药科学技术有限公司;细胞实验用白藜芦醇(R5010)、棕榈酸(palmitic acid,PA)购自美国Sigma公司,四季青胎牛血清购自浙江天杭生物科技有限公司;RNAStore样品保存液(DP408)购自天根生化科技(北京)有限公司;RT试剂盒购自Fermentus Life Sciences;DMEM培养基购自美国Invitrogen公司;鼠抗3-磷酸甘油醛脱氢酶(GAPDH)单克隆抗体购自康为世纪生物技术有限公司;兔抗GRP78多克隆抗体购自美国 Abcam公司;鼠抗CHOP单克隆抗体购自美国CST公司;兔抗eNOS多克隆抗体购自美国Santa Cruz公司;羊抗兔辣根过氧化物酶标记抗体和DAB均购自武汉博士德生物技术有限公司;FITC羊抗小鼠二抗购自北京中杉金桥生物技术有限公司;增强化学发光底物检测试剂盒(ECL发光剂)购自碧云天生物技术研究所;DAPI购自Biosharp生物科技有限公司;RIPA裂解液购自南京凯基生物科技发展有限公司。所有引物均用Primer5.0软件设计,由上海生工生物技术工程有限公司合成(Tab 1)。

Tab 1 Primer sequences used for RT-PCR analysis of related gene expression in m ice
1.1.3 动物分组及用药 将C57 BL/6小鼠随机分为标准饮食组(SCD)、高热量高胆固醇饮食组(HCD,20%猪油、20%蔗糖、10%蛋黄粉、1%胆固醇)和高热量高胆固醇饮食+白藜芦醇组(HCD+RES)。除SCD组外,其余2组均为HCD喂养,HCD+RES组在HCD的同时灌胃白藜芦醇(400 mg·kg-1·d-1)治疗12周。所有操作均遵守安徽医科大学实验动物伦理委员会的要求。
1.2 方法
1.2.1 胸主动脉的病理学检测和免疫组织化学分析 小鼠处死后迅速取出胸主动脉,用4%(V/V)的多聚甲醛溶液固定72 h,石蜡包埋,4μm切片,HE染色和间苯二酚品红染色,400倍光镜下观察组织的病理学改变,对比拍照。将血管以4μm连续切片,常规脱蜡至水,微波抗原修复,3%H2O2消除内源性过氧化物酶活性,PBS洗后用山羊血清封闭,eNOS羊抗兔(1∶100)4℃过夜,二抗工作液室温孵育10 min,辣根酶标记链卵白素标记,DAB显色,苏木素复染,中性树胶封片。
1.2.2 胸主动脉的 RT-PCR分析 抽提血管总RNA,逆转录合成cDNA,常规PCR分析,反应条件为:预变性 94℃3 min,变性 94℃30 s、退火 55℃30 s、延伸72℃ 30 s,32个循环后 72℃延伸 5 min,3%琼脂糖凝胶电泳,以目的条带的灰度与内参GAPDH的灰度之比表示目的基因的表达水平。
1.2.3 MAEC细胞培养 将MAEC细胞解冻复苏后,种植在含10%胎牛血清、105IU·L-1青霉素、105IU·L-1链霉素的 DMEM培养基中,37℃、5%CO2、95%湿度的条件下培养,2~3 d换液1次。待细胞生长至单层融合状态后,用0.25%胰蛋白酶消化传代。
1.2.4 MTT实验 取对数生长期细胞,接种于96孔培养板,低浓度 RES(10μmol·L-1)、中浓度 RES(50μmol·L-1)、高浓度 RES(100μmol·L-1)预处理6 h后加入0.5 mmol·L-1PA孵育,每组平行6个复孔,重复 3次,培养时间分别为 6、12、18、24 h,在达各培养时间点前4 h时,每孔加5 g·L-1MTT 20μl继续培养4 h,去除培养基,每孔加150μl DMSO,酶标仪测定OD570。
1.2.5 Western blot 不同浓度 RES预处理后加PA共同孵育24 h,RIPA裂解液抽提细胞总蛋白,BCA法测蛋白浓度,12%SDS-PAGE凝胶电泳,转移到PVDF膜上,封闭后分别用抗GAPDH(1∶800)、GRP78(1∶600)的一抗4℃孵育过夜,HRP标记的二抗室温孵育1 h,加入 ECL发光剂反应5~10 min,暗室显影成像,实验重复3次。
1.2.6 细胞免疫荧光 制备细胞爬片,不同浓度RES预处理后加PA共同孵育24 h,4%多聚甲醛固定,0.5%Triton X-100破膜,5%BSA封闭后加鼠抗CHOP单克隆抗体(1∶200)4℃孵育过夜,FITC山羊抗小鼠二抗室温孵育1 h,DAPI染色10 min后抗荧光淬灭封片剂封片,荧光显微镜下观察。
1.2.7 细胞免疫组化分析 制备细胞爬片,不同浓度RES预处理后加PA共同孵育24 h,4%多聚甲醛固定,其余步骤包括eNOS的浓度均同上述组织的免疫化学分析。
1.3 统计学处理 采用SPSS 16.0软件进行统计分析,所有实验数据以±s表示,多组间比较采用单因素方差分析(ANOVA),两组间比较用SNK-q检验。
2 结果
2.1 白藜芦醇对高脂饮食小鼠胸主动脉内皮细胞病理学的影响 HE及间苯二酚染色结果显示:SCD组小鼠动脉结构清晰,内皮细胞连续光滑完整,弹力纤维排列呈波浪状,未见断裂,无病理学改变;HCD组动脉管壁增厚,弹力纤维排列紊乱,局部有断裂现象;HCD+RES组相对于HCD组管壁变薄,弹力纤维基本无断裂(Fig 1)。
2.2 白藜芦醇对胸主动脉ERS中3个上游通路分子基因表达的影响 RT-PCR结果显示:与SCD组相比,HCD组小鼠胸主动脉的ERS中3个信号通路IRE1α、ATF6以及PERK的基因水平表达均明显升高(P<0.05);与 HCD组相比,HCD+RES组PERK、IRE1α基因水平明显降低(P<0.05),ATF6基因的表达差异无显著性(P>0.05)。
2.3 白藜芦醇对胸主动脉ERS中2个下游分子GRP78和CHOP基因表达的影响 RT-PCR结果表明:与SCD组相比,HCD组小鼠胸主动脉的ERS中GRP78和CHOP基因的表达均明显增加(P<0.05);与HCD组相比,HCD+RES组CHOP基因的表达明显降低(P<0.05),GRP78虽然略有升高,但差异无统计学意义(P>0.05),见 Fig 3。
2.4 白藜芦醇对胸主动脉eNOS蛋白水平表达的影响 免疫组化结果显示:eNOS蛋白在内皮细胞的胞质中表达;与SCD组相比,HCD组eNOS的表达降低;与HCD组相比,HCD+RES组的eNOS表达有所增加(Fig 4)。
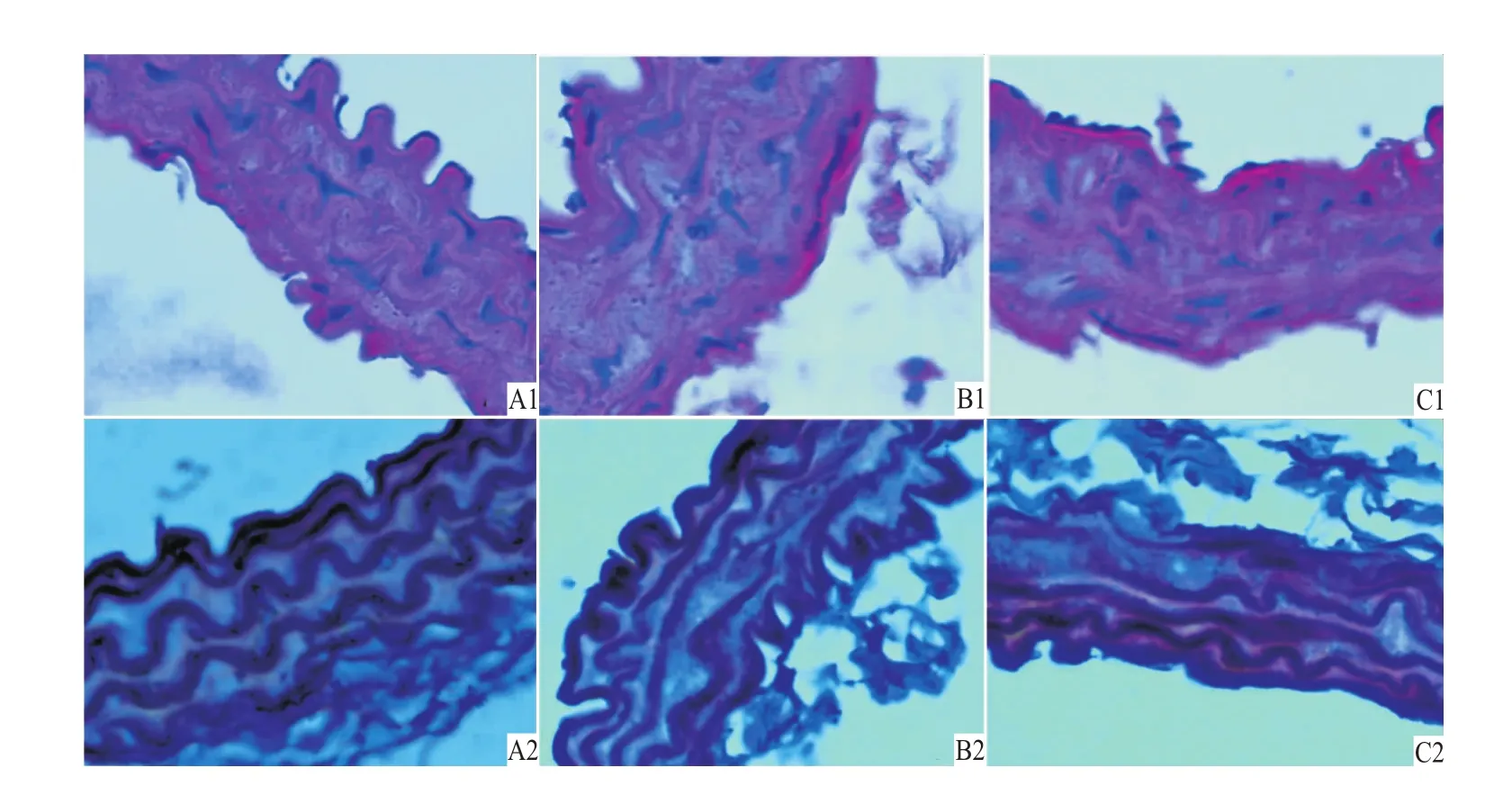
Fig 1 Photom icrographs ofmouse thoracic aorta w ith HE and resorcinol-fuchsin staining(×400)A.SCD group;B.HCD group;C.HCD+RES group.1:HE staining;2:resorcinol-fuchsin staining.
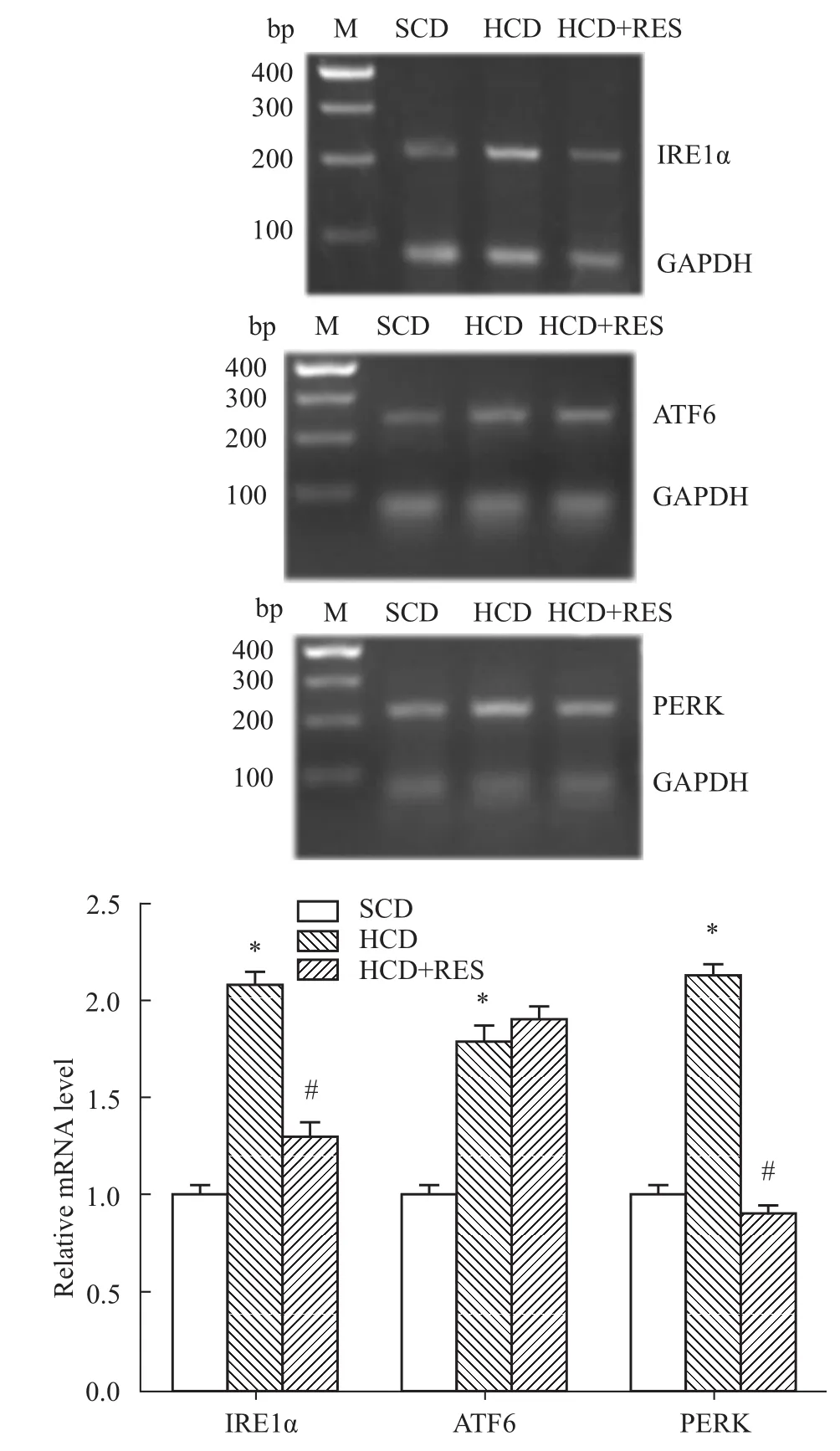
Fig 2 Comparison ofmRNA expression of IRE1α,ATF6 and PERK in thoracic aorta of 3 groups*P<0.05 vs SCD group;#P<0.05 vs HCD group
2.5 白藜芦醇对棕榈酸诱导MAEC增殖的影响由Tab 2可知:PA对MAEC增殖有明显的抑制作用,且呈浓度和时间依赖关系;RES预处理后,可改善PA对MAEC增殖的抑制作用,其中低浓度(10 μmol·L-1)RES对 MAEC改善增殖作用不明显(P>0.05),较高浓度作用12 h以上明显增强(P<0.05),且呈浓度依赖性。
Tab 2 Influence of RES pretreatment on proliferation of mouse aortic endothelial cells treated w ith PA(±s,n=3)
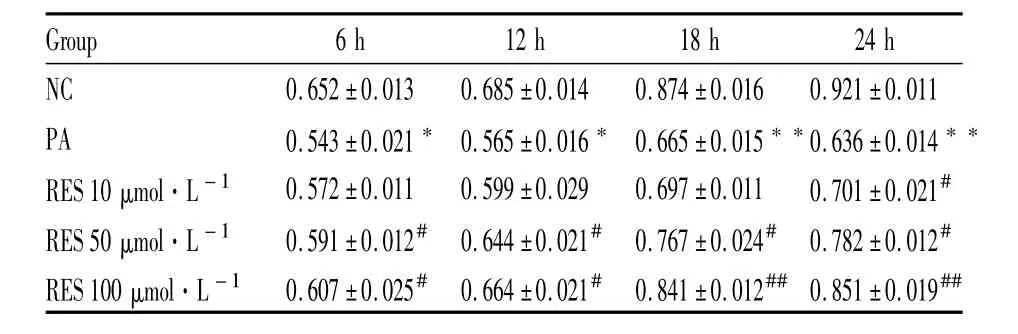
Tab 2 Influence of RES pretreatment on proliferation of mouse aortic endothelial cells treated w ith PA(±s,n=3)
*P<0.05,**P<0.01 vs NC;#P<0.05,##P<0.01 vs PA
Group 6 h 12 h 18 h 24 h NC 0.652±0.013 0.685±0.014 0.874±0.016 0.921±0.011 PA 0.543±0.021*0.565±0.016*0.665±0.015**0.636±0.014**RES10μmol·L-1 0.572±0.011 0.599±0.029 0.697±0.011 0.701±0.021#RES50μmol·L-1 0.591±0.012# 0.644±0.021# 0.767±0.024# 0.782±0.012#RES100μmol·L-1 0.607±0.025# 0.664±0.021# 0.841±0.012## 0.851±0.019##

Fig 3 Com parison ofm RNA expression of CHOP and GRP78 in thoracic aorta of 3 groups*P<0.05 vs SCD group;#P<0.05 vs HCD group

Fig 4 The immunohistochem ical results of eNOS in thoracic aorta of 3 groups(×400)A:SCD group;B:HCD group;C:HCD+RES group.
2.6 白藜芦醇对棕榈酸诱导M AEC中GRP78蛋白表达的影响 Western blot结果表明:与NC组相比,PA组MAEC表达的GRP78蛋白水平均明显升高(P<0.05);单独使用RES组对GRP78表达没有明显影响(P>0.05);不同浓度RES干预后GRP78的蛋白水平表达相对于PA组明显降低(P<0.05)(Fig 5)。
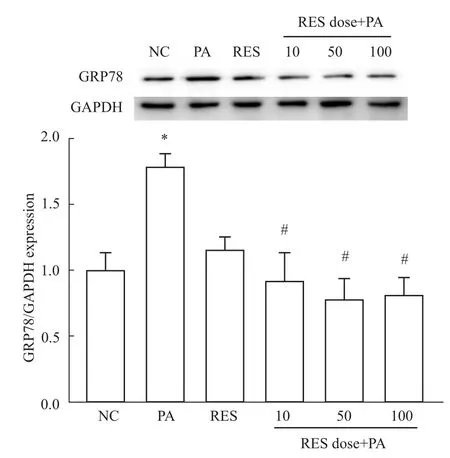
Fig 5 Effect of RES pretreatment on expression of GRP78 protein induced by PA in MAEC*P<0.05 vs NC group;#P<0.05 vs PA group
2.7 白藜芦醇对棕榈酸诱导MAEC中CHOP蛋白表达的影响 与NC组相比,PA组CHOP表达明显增加,且定位在细胞核;与PA组相比,中、高剂量RES干预组CHOP表达明显减少,而低浓度RES组与PA组相比,CHOP的减少不明显(Fig 6)。
2.8 白藜芦醇对棕榈酸诱导MAEC中eNOS蛋白表达的影响 eNOS主要在胸主动脉内皮细胞的胞质中表达。与NC组相比,PA组eNOS表达明显减少;与PA组相比,低浓度RES预处理后,eNOS蛋白表达无明显增加,中、高浓度RES预处理后,eNOS蛋白表达明显增加(Fig 7)。
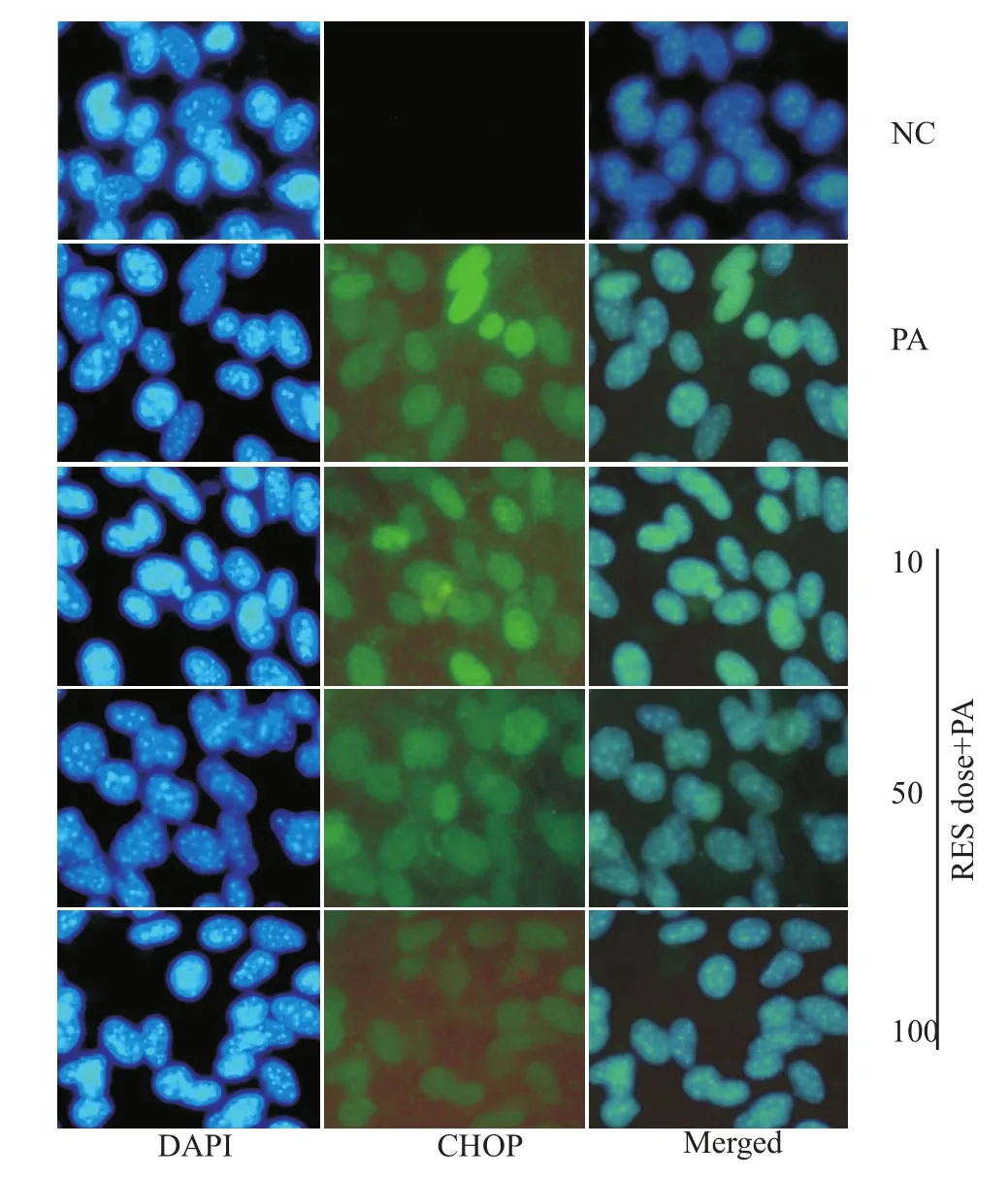
Fig 6 Effect of RES pretreatment on expression of CHOP protein induced by PA in MAECs

Fig 7 Effects of RES pretreatment on expression of eNOS protein induced by PA in MAECsA:NC group;B:0.5 mmol·L-1 PA group;C:10μmol·L-1 RES+0.5 mmol·L-1 PA group;D:50μmol·L-1 RES+0.5 mmol·L-1 PA group;E:100μmol·L-1 RES+0.5 mmol·L-1 PA group.
3 讨论
UPR有3个主要的效应蛋白:ATF6、IRE1α和PERK,在基础状态下,这3个效应蛋白都与分子伴侣GRP78结合,当发生 ERS时,它们与GRP78分离,然后被激活[7]。钱磊等[2]研究发现,高脂饮食或者PA诱导时胸主动脉或内皮细胞发生ERS。本研究发现,小鼠高热量高胆固醇饮食12周后,胸主动脉组织弹力纤维排列紊乱,ERS相关基因水平明显升高,表明该饮食明显激活内皮细胞的ERS通路;白藜芦醇干预后,血管内皮中PERK、IRE1α及下游CHOP、GRP78基因的转录水平均明显降低,提示白藜芦醇保护高脂损伤大血管的作用机制可能与其缓解 ERS、降低 PERK、IRE1α及其下游 CHOP、GRP78的基因表达有关。另有研究表明白藜芦醇可抑制缺血/再灌注和衣霉素诱导的ERS及视网膜血管变性[8],并通过抑制GRP78蛋白的表达从而减少ERS和糖尿病大鼠的早期肾损害[9],与本文的动物实验研究结果基本一致。
高脂饮食后小鼠血清中16碳的软脂酸(PA)和18碳的硬脂酸均升高,以PA升高最为明显[10],因此本研究先通过低、中、高剂量的白藜芦醇预处理MAEC,然后用 PA(0.5 mmol·L-1)诱导血管内皮细胞,结果发现,中、高浓度白藜芦醇(50、100μmol·L-1)可明显改善PA对内皮细胞增殖的抑制作用,且呈明显的剂量依赖关系(Tab 2)。PA可明显增加GRP78、CHOP的蛋白表达,中、高浓度白藜芦醇则明显减少PA诱导的ERS。有报道称白藜芦醇可抑制乙醇诱导的ERS及Caspase-12,导致的肝细胞凋亡[11],也可在HepG2细胞中通过诱导去乙酰化酶SIRT1的高表达来诱导氧调节蛋白150(ORP150)的表达以减缓PA诱导的ERS和胰岛素抵抗[12],与本文的细胞研究结果基本一致。
NO主要由eNOS催化生成后分泌到血液,参与调控血管扩张、免疫反应等多种生理和病理学过程[13]。在糖尿病早期阶段,由eNOS表达改变引起的NO水平异常会导致内皮功能障碍的发生[14],白藜芦醇可通过上调人脐静脉内皮细胞中eNOS的表达来发挥其血管保护作用[15]。本研究发现[16],高脂饮食导致血管内皮细胞eNOS表达减少,细胞实验证实PA可抑制eNOS的表达,而动物和细胞实验的结果均表明白藜芦醇的干预或预处理可增加eNOS的表达(Fig 4、6),提示高脂饮食和PA诱导的小鼠血管内皮细胞受损与eNOS的表达减少密切相关,而白藜芦醇可能通过增加eNOS的表达来逆转内皮细胞的损伤。白藜芦醇是SIRT1的特异性激动剂,研究表明在肝细胞中,Exedin-4通过增加SIRT1的表达来减缓ERS标志基因的表达,本研究将在后续的细胞实验中继续观察白藜芦醇是否也能以类似的方式来减少ERS标志基因的表达。
综上所述,本研究从体内和体外两方面证实了白藜芦醇对高热量高胆固醇饮食和棕榈酸诱导胸主动脉及血管内皮细胞损伤的保护作用,可能与其明显减少ERS和增加eNOS的表达有关。然而白藜芦醇具体如何影响ERS下游的通路,进而改变eNOS的表达、影响血管的舒张功能?以及其对ERS的影响是直接作用还是间接作用?需要进一步的实验来证实,其机制的阐明将为开发白藜芦醇作为以ERS及其下游PERK、IRE1α等为靶点的药物提供理论依据。
参考文献:
[1] Shen M,Wang L,Yang G,etal.Baicalin protects the cardiomyocytes from ER stress-induced apoptosis:Inhibition of CHOP through induction of endothelial nitric oxide synthase[J].PloS one,2014,9(2):e88389.
[2] Lu Y,Qian L,Zhang Q,et al.Palmitate induces apoptosis in mouse aortic endothelial cells and endothelial dysfunction in mice fed high-calorie and high-cholesterol diets[J].Life Sci,2013,92(24):1165-73.
[3] Yu W,Fu Y C,Wang W.Cellular and molecular effects of resveratrol in health and disease[J].J Cell Biochem,2012,113(3):752-9.
[4] 任俊伟,杨琴.白藜芦醇对脑缺血/再灌注氧化应激损伤保护机制的研究进展[J].中国药理学通报,2011,27(04):448-51.
[4] Ren JW,Yang Q.Protectivemechanism of resveratrol on cerebral ischemia/reperfusion injury via ameliorating oxidative stress[J].Chin Pharmacol Bull,2011,27(04):448-451.
[5] Malhotra JD,Miao H,Zhang K,etal.Antioxidants reduce endoplasmic reticulum stress and improve protein secretion[J].Proc Natl Acad Sci USA,2008,105(47):18525-30.
[6] Lagouge M,Argmann C,Gerhart-Hines Z,et al.Resveratrol improvesmitochondrial function and protects againstmetabolic disease by activating SIRT1 and PGC-1alpha[J].Cell,2006,127(6):1109-22.
[7] Kaplon R E,Chung E,Reese L,et al.Activation of the unfolded protein response in vascular endothelial cells of nondiabetic obese adults[J].JClin Endocrinol Met,2013,98(9):E1505-9.
[8] Li C,Wang L,Huang K,et al.Endoplasmic reticulum stress in retinal vascular degeneration:protective role of resveratrol[J].Invest Ophthalmol Vis Sci,2012,53(6):3241-9.
[9] 王雅芸,徐家蓉,缪 珩,等.白藜芦醇对糖尿病大鼠肾皮质氧化应激损伤的保护作用 [J].中华糖尿病杂志,2012,4(4):229-33.
[9] Wang Y R,Xu JR,Miao H,et al.Protective effect of resveratrol from renal cortical oxidative stress injury in diabetic rats[J].Chin JDiabetes,2012,4(4):229-33.
[10]Staiger K,Staiger H,Weigert C,etal.Saturated,butnotunsaturated,fatty acids induce apoptosis of human coronary artery endothelial cells via nuclear factor-κB activation[J].Diabetes,2006,55(11):3121-6.
[11]Liu LQ,Fan ZQ,Tang Y F,etal.The resveratrol attenuates ethanol-induced hepatocyte apoptosis via inhibiting ER-related caspase-12 activation and PDE activity in vitro[J].Alcohol Clin Exp Res,2014,38(3):683-93.
[12]Jung TW,Lee K T,Lee M W,et al.SIRT1 attenuates palmitate-induced endoplasmic reticulum stress and insulin resistance in HepG2 cells via induction of oxygen-regulated protein 150[J].Biochem Biophys Res Commun,2012,422(2):229-32.
[13]Gotoh T,Mori M.Nitric oxide and endoplasmic reticulum stress[J].Arterioscler Thromb Vasc Biol,2006,26(7):1439-46.
[14]Andriambeloson E,Kleschyov A L,Muller B,et al.Nitric oxide production and endothelium-dependent vasorelaxation induced by wine polyphenols in rat aorta[J].Br J Pharmacol,1997,120(6):1053-8.
[15]Takizawa Y,Kosuge Y,AwajiH,etal.Up-regulation ofendothelial nitric oxide synthase(eNOS),silentmating type information regulation 2 homologue1(SIRT1)and autophagy-related genes by repeated treatmentswith resveratrol in human umbilical vein endothelial cells[J].Br JNutr,2013,110(12):2150-5.
[16]Lee J,Hong SW,Park S E,et al.Exendin-4 attenuates endoplasmic reticulum stress through a SIRT1-dependent mechanism[J].Cell Stress Chaperones,2014,PMID:24446069[Epub ahead of print].