(4-(5-氨基-4-苯基嘧啶)-2-基)哌嗪)-1-酮类衍生物的合成
易雪静,邓兰青,2
(1.洞庭湖区特色中药材综合利用重点实验室岳阳职业技术学院,湖南岳阳 414000;2.中南大学化学化工学院,湖南 长沙 410083)
2-哌嗪基-4-苯基嘧啶类化合物在医药中是重要的中间体,具有良好的生理活性和药物活性。最近有研究表明,一些2-哌嗪基-4-苯基嘧啶类化合物可作为4-取代脯氨酸酰胺的二肽抑制剂,用于2型糖尿病的治疗[1]。有些2-哌嗪基-4-苯基嘧啶类化合物还具有杀菌、镇痛等活性作用,可用于类风湿关节炎等慢性炎症性疾病的治疗[2-3],以及抗肿瘤[4]、抗精神抑郁[5]和哮喘等过敏性疾病[6]的治疗。因此,2-哌嗪基-4-苯基嘧啶类化合物的合成在药物的研发中显得非常重要,成为当前研究的热点之一。
孟启等以苯乙酮和苯胺衍生物为原料,利用活性结构拼接的方法,合成了一系列2-哌嗪基-4-苯基嘧啶衍生物,但反应过程中甲苯作溶剂,反应操作困难、副产物较多,不易实现工业化[7]。蒋达洪等以巯基乙酸为原料,经酯化、加成、缩合等五步反应设计合成了5个含哌嗪基7-溴噻吩并[3,2-d]嘧啶类化合物。该法操作简单,但总收益率较低,仅在24% ~30%[4]。
本课题组研究以羧酸(1a~f)和4-芳基-2-(哌嗪-1-基)嘧啶-5-胺(2a~c)为原料,采用 2-(7-氮杂-1H-苯并三氮唑-1-基)-1,1,3,3-四甲基脲六氟磷酸酯(HATU)为胺酸羧合剂,设计合成了一系列(4-(5-氨基-4-苯基嘧啶)-2-基)哌嗪)-1-酮类衍生物(3a~j)。
1 实验部分
1.1 试剂与仪器
甲醇、二氯甲烷、甲苯、四氢呋喃、、二氧六环等均为分析纯。
Bruker-AV400型核磁共振仪;Aglilent 6000LC/MS液质联用仪;WFH-203型三用紫外分析仪;X-4数字显微熔点仪。
1.2 化合物3a~3j的合成
合成路线如下:
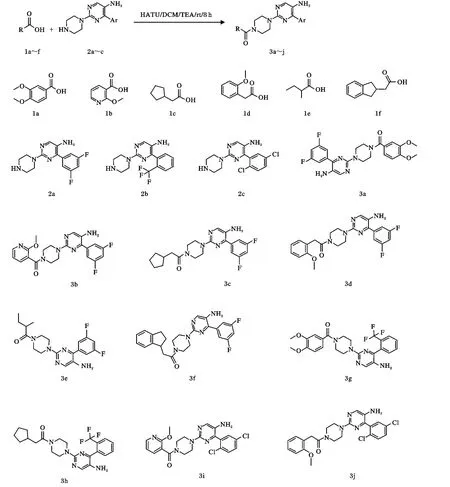
对于3,4-二甲氧基苯甲酸(1a)、2-甲氧基烟酸(1b)、环戊乙酸(1c)、2-(2-甲氧基苯基)乙酸(1d)、2-甲基丁酸 (1e)、2-(2,3-二氢-1H-茚-1-基)乙酸(1f)这6种羧酸与3个环状仲胺(2a,2b,2c)的酰化反应,经过多次实验后,确定最佳反应条件为:以2-(7-偶氮苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)为缩合剂。分别称取1.25 mmol酸(1a~1f)置于18个圆底烧瓶中(附上标签1a-2a,1a-2b,1a-2c,1b-2a,1b-2b,1b-2c,1c-2a,1c-2b,1c-2c,1d-2a,1d-2b,1d-2c,1e-2a,1e-2b,1e-2c,1f-2a,1f-2b,1f-2c),依次加入 6 mL无水 DCM,对应称取1.00 mmol的胺(2a~2c),依次向各个反应瓶加入2.00 mmol的三乙胺,于室温下搅拌,反应1 h,然后再向上述反应瓶中加入1.50 mmol的HATU,搅拌,室温下反应7 h。反应结束后,用0.10 mol的NaOH水溶液洗涤,再用DCM萃取,有机层经无水硫酸镁干燥,过滤,滤液减压蒸除溶剂,再将其真空下干燥10 h,粗产品经硅胶柱层析分离(DCM∶MeOH=15∶1),得到10个目标产物(3a~j)。
化合物3a:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(3,4-二甲氧基)苯甲酮,淡黄色固体,354.9 mg,收率 78%,LC-MS分析纯度 100%,m.p.625.36 ℃,分子式 C23H23F2N5O3,1H NMR(DMSO-d6,400 MHz)δ:3.37(t,J=12,4H,CH2),3.59(t,J=8,4H,CH2),3.84(s,6H,CH3),6.29(s,2H,NH2),6.61(t,J=10,1H,CH),7.18(d,J=8,1H,CH),7.32(d,J=10,2H,CH),7.50(d,J=10,1H,CH),7.63(s,1H,CH),8.02(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:50.2,51.9,56.3,104.5,111.5,111.8,114.3,120.2,130.8,131.4,136.4,145.2,149.7,150.9,152.4,165.3,168.8;ESI-MS m/z(%):456.2([M+1]+,100),457.1([M+2]+,33.2)。
化合物 3b:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(3-(2-甲氧基)吡啶)甲酮,淡黄色固体,319.5 mg,收率75%,LC-MS分析纯度100%,m.p.644.61 ℃,分子式 C21H20F2N6O2,1H NMR(DMSO-d6,400 MHz)δ:3.29 ~ 3.40(m,8H,CH2),4.08(s,3H,CH3),6.29(s,2H,NH2),6.64 ~ 6.65(m,2H,CH),7.29(s,2H,CH),7.45(d,J=10,1H,CH),8.02(s,1H,CH),8.21(d,J=8,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:49.8,51.6,53.8,104.8,111.7,112.3,122.2,131.3,136.5,139.4,145.5,152.4,163.8,165.1,169.2;ESI-MS m/z(%):427.1([M+1]+,100),428.1([M+2],29.4),214.2([1/2M+1]+,30.4)。
化合物3c:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(2-环戊基)乙酮,白色固体,332.8 mg,收率83%,LC-MS分析纯度 100%,m.p.517.8 ℃,分子式 C21H25F2N5O,1H NMR(DMSO-d6,400 MHz)δ:1.33 ~1.75(m,9H,CH,CH2),2.16(d,J=12,2H,CH2),3.34(t,J=10,4H,CH2),3.56(t,J=8,4H,CH2),6.28(s,2H,NH2),6.63(t,J=10,1H,CH),7.31(d,J=10,2H,CH),8.03(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:24.6,31.3,38.5,39.0,46.8,52.1,104.9,111.8,131.2,136.3,136.6,145.5,150.9,152.3,152.6,165.3,171.2;ESI-MS m/z(%):402.2([M+1]+,100),403.2([M+2]+,25.3),201.7([1/2M+1]+,15.6)。
化合物 3d:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(2-(2-甲氧基)苯基)乙酮,淡黄色固体,346.8 mg,收率 79%,LC-MS分析纯度98.3%,m.p.585.61 ℃,分子式 C23H23F2N5O2,1H NMR(DMSO-d6,400 MHz)δ:3.34(t,J=10,4H,CH2),3.59(t,J=8,4H,CH2),3.82(s,3H,CH3),3.87(s,2H,CH2),6.30(s,2H,NH2),6.65(t,J=12,1H,CH),6.81 ~6.90(m,3H,CH),7.14(d,J=12,1H,CH),7.32(d,J=12,2H,CH),8.01(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:32.3,46.8,51.7,56.3,104.8,111.4,113.0,121.4,126.2,128.5,131.3,132.8,136.5,145.1,152.4,157.6,160.7,165.1;ESI-MS m/z(%):440.2([M+1]+,100),441.2([M+2]+,26.8),220.6([1/2M+1]+,17.1)。
化合物3e:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(2-甲基)丁酮,淡黄色固体,315 mg,收率84%,LC-MS 分析纯度100%,m.p.469.36 ℃,分子式 C19H23F2N5O,1H NMR(DMSO-d6,400 MHz)δ:0.92(t,J=16,3H,CH3),1.21(d,J=8,3H,CH3),1.65 ~ 1.72(m,2H,CH2),2.53 ~ 2.62(m,1H,CH),3.34(t,J=8,4H,CH2),3.45(t,J=8,4H,CH2),6.26(s,2H,NH2),6.66(t,J=10,1H,CH),7.31(d,J=12,2H,CH),8.03(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:10.7,17.8,27.4,39.1,47.1,51.7,104.9,111.4,131.1,136.5,145.1,152.3,165.2,175.4;ESI-MS m/z(%):376.2([M+1]+,100),377.1([M+2]+,22.4)。
化合物3f:(4-(5-氨基-4-(3,5-二氟苯基)嘧啶-2-基)哌嗪)-1-(2-(2,3-二氢-1H-茚-1-基))乙酮,淡黄色固体,368.2 mg,收率 82%,LC-MS分析纯度100%,m.p.608.86 ℃,分子式 C25H25F2N5O,1H NMR(DMSO-d6,400 MHz)δ:1.83 ~ 1.88(m,1H,CH2),2.03 ~ 2.10(m,1H,CH2),2.32 ~ 2.38(m,1H,CH2),2.51 ~ 2.58(m,1H,CH2),2.83 ~ 2.97(m,2H,CH2),3.12(t,J=10,1H,CH),3.33(t,J=12,4H,CH2),3.55(t,J=10,4H,CH2),6.25(s,2H,NH2),6.63(t,J=12,1H,CH),7.18(s,4H,CH),7.28(d,J=10,2H,CH),7.98(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:30.8,31.4,33.8,46.6,51.7,54.3,104.9,111.3,125.3,125.9,126.4,128.1,130.9,136.4,143.2,144.1,145.5,151.9,165.2,171.3;ESI-MS m/z(%):450.2([M+1]+,100),451.2([M+2]+,28.9)。
化合物3g:(4-(5-氨基-4-(2-三氟甲基)苯基)嘧啶-2-基)哌嗪)-1-(3,4-二甲氧基)苯甲酮,白色固体,350.6 mg,收率 72%,LC-MS分析纯度 100%,m.p.638.47 ℃,分子式 C24H24F3N5O3,1H NMR(DMSO-d6,400 MHz)δ:3.34(t,J=12,4H,CH2),3.56(t,J=10,4H,CH2),3.86(s,6H,CH3),6.25(s,2H,NH2),7.19(d,J=10,1H,CH),7.30(d,J=8,2H,CH),7.51(d,J=12,1H,CH),7.64(s,1H,CH),8.03(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:50.3,52.0,56.2,111.5,113.0,114.1,120.8,130.6,131.2,131.7,140.4,145.0,149.9,150.6,152.4,169.2;ESI-MS m/z(%):488.1([M+1]+,100),489.1([M+2]+,28.1)。
化合物3h:(4-(5-氨基-4-(2-三氟甲基)苯基)嘧啶-2-基)哌嗪)-1-(2-环戊基)乙酮,淡黄色固体,350.7 mg,收率 81%,LC-MS 分析纯度 100%,m.p.530.91 ℃,分子式 C22H26F3N5O,1H NMR(DMSO-d6,400 MHz)δ:1.35 ~1.80(m,9H,CH,CH2),2.13(d,J=10,2H,CH2),3.29(t,J=10,4H,CH2),3.58(t,J=8,4H,CH2),6.29(s,2H,NH2),7.25(d,J=10,2H,CH),7.98(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:24.1,31.4,38.3,39.4,46.4,51.9,113.3,131.0,132.1,140.2,145.4,151.5,152.2,171.3;ESI-MS m/z(%):433.5([M+1]+,100),434.2([M+2]+,25.7),217.7([1/2M+1]+,12.5)。
化合物3i:(4-(5-氨基-4-(2,5-二氯苯基)嘧啶-2-基)哌嗪)-1-(3-(2-甲氧基)吡啶)甲酮,淡黄色固体,389.3 mg,收率 85%,LC-MS 分析纯度 97.6%,m.p.698.27 ℃,分子式 C21H20Cl2N6O2,1H NMR(DMSO-d6,400 MHz)δ:3.28 ~ 3.36(m,8H,CH2),4.05(s,3H,CH3),6.26(s,2H,NH2),6.64(t,J=8,1H,CH),7.47(d,J=10,2H,CH),7.67(d,J=12,1H,CH),7.98(s,1H,CH),8.03(s,1H,CH),8.21(d,J=10,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:49.5,51.9,53.6,112.2,122.0,128.7,130.0,130.5,130.9,131.3,131.9,132.8,139.4,145.1,145.6,152.3,163.5,169.2;ESI-MS m/z(%):459.1([M]+,100),461.1([M+2],62.5),230.1([1/2M+1]+,29.5)。
化合物3j:(4-(5-氨基-4-(2,5-二氯苯基)嘧啶-2-基)哌嗪)-1-(2-(2-甲氧基)苯基)乙酮,淡黄色固体,343.8 mg,收率 73%,LC-MS 分析纯度 96.1%,m.p.649.27 ℃,分子式 C23H23Cl2N5O2,1H NMR(DMSO-d6,400 MHz)δ:3.32(t,J=12,4H,CH2),3.56(t,J=10,4H,CH2),3.85(s,3H,CH3),3.87(s,2H,CH2),6.25(s,2H,NH2),6.80 ~ 6.88(m,3H,CH),7.15(d,J=10,1H,CH),7.51(d,J=12,2H,CH),7.72(d,J=12,2H,CH),7.97(s,1H,CH),8.02(s,1H,CH);13C NMR(DMSO-d6,400 MHz)δ:32.7,46.3,51.9,56.0,112.6,121.8,126.3,128.3,128.9,130.1,130.4,130.9,131.1,131.5,132.3,132.9,145.5,152.3,157.8,160.1;ESI-MS m/z(%):472.1([M]+,100),474.1([M+2]+,64.1),236.6([1/2M]+,17.9)。
2 结果与讨论
2.1 缩合剂的影响
目前,常用的酸胺缩合剂有1,3-二环己基二亚胺(DCC)[8]、2-(1-H 苯并三唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HBTU)[9]、1-(3-二甲氨基丙基)-3-乙基碳化二亚胺盐酸盐(EDCI)[10]和 2-(7-氮杂-1H-苯并三氮唑-1-基)-1,1,3,3-四甲基脲六氟磷酸酯(HATU)等。本课题组选用底物1c和2a合成产物3c进行实验,分别用DCC、HBTU、EDCI和HATU 4种缩合剂进行对比实验,其收率见表1。

表1 缩合剂对收率的影响Table 1 Effects of condensation agents on the yield
由表1可知,DCC、HBTU、EDCI 3种缩合剂收率在52% ~68%,且用DCC作缩合剂时易产生沉淀、用EDCI和HBTU作缩合剂时,反应时间都较长,而以HATU作缩合剂的收率可高达83%,明显高于前三者,缩合效果好。
2.2 碱的影响
酸胺缩合反应可选用NaOH、Na2CO3、三乙胺和吡啶等碱作为缚酸剂吸附的办法进行催化,以提高产物的收率。本课题组选用底物1b和2a合成产物3b进行实验,分别用NaOH、Na2CO3、三乙胺和吡啶4种碱作为催化剂,其催化效果见表2。

表2 催化剂对收率的影响Table 2 Effects of catalysts on the yield
由表2可知,三乙胺和吡啶作为有机碱比无机碱NaOH和Na2CO3能获得更高的收率。综合价格因素,我们选用了相对便宜的三乙胺作催化剂。
2.3 溶剂的影响
选用底物1a和2b合成产物3g进行实验,分别用甲苯、二氯甲烷(DCM)和四氢呋喃(THF)、二氧六环4种溶剂进行比较,结果见表3。

表3 溶剂对收率的影响Table 3 Effects of solvents on the yield
由表3可知,用DCM作溶剂时,收率明显高于甲苯和二氧六环,THF和甲苯的沸点偏高,毒性较大,选用DCM作溶剂时,条件温和,后处理简单。
3 结论
合成了一系列(4-(5-氨基-4-苯基嘧啶)-2-基)哌嗪)-1-酮类衍生物,化合物经1H NMR、13C NMR和ESI-MS鉴定,与结构相符。
本课题组建立了一条合成(4-(5-氨基-4-苯基嘧啶)-2-基)哌嗪)-1-酮类衍生物的方法,为哌嗪嘧啶酮类衍生物的合成提供了一条有效途径。该方法具有操作步骤简单、收率高、后处理简单、反应条件温和等优点。
[1]Ammirati M J,Andrews K M,Boyer D D,et al.(3,3-Difluoro-pyrrolidin-1-yl)-[(2S,4S)-(4-(4-pyrimidin-2-ylpiperazin-1-yl)-pyrrolidin-2-yl]-methanone:A potent,selective,orally active dipeptidyl peptidase IV inhibitor[J].Bioorganic & Medicinal Chemistry Letters,2009,19:1991-1995.
[2]Hisadome M,Fukuda T,Sumichika H,et al.A novel antirheumatic drug suppresses tumor necrosis factora and augments interleukin-10 in adjuvant arthritic rats[J].European Journal of Pharmacology,2000,409:331-335.
[3]Hisadome M,Fukuda T,Adachi K,et al.Combination benefit of a pyrimidylpiperazine derivative(Y-40138)and methotrexate in arthritic rats[J].European Journal of Pharmacology,2004,497:351-359.
[4]蒋达洪,黄敏.含哌嗪基噻吩并[3,2-d]嘧啶类抗癌试剂的设计与合成[J].化学试剂,2012,34(9):797-799.
[5]杜会霞,吴纬纬,夏炽中.1-(2-嘧啶基)-4-(3-氨丙基)哌嗪的合成[J].山西大学学报,2003,26(2):150-152.
[6]Nagashima S,Hondo T,Nagata H,et al.Novel 7H-pyrrolo[2,3-d]pyrimidine derivatives as potent and orally active STAT6 inhibitors[J].Bioorganic & Medicinal Chemistry,2009,17:6926-6936.
[7]孟启,蒋楠,姜艳,等.2-哌嗪基-4-苯基嘧啶衍生物的合成研究[J].化学通报,2003,76(7):624-629.
[8]Zhang Jianqiu.Development and application of DCC catalysts to meet new demands[J].China Petroleum Processing and Petrochemical Technology,2013,15(1):14-18.
[9]潘和平,陈正英.多肽固相合成缩合试剂——HBTU合成方法的改进[J].化学试剂,1996,18(6):362-363.
[10]刘紫微,李兰,赵辉鹏,等.3-丙烯酰胺基苯硼酸的合成与表征[J].合成技术及应用,2007,22(3):13-16.

