高糖激活PI3K/AKT/mTORC1通路诱导人肾小管上皮细胞骨桥蛋白的表达
王凤梅,蒋克国,张桂霞,周海胜,查晓军,郝 丽,王德光
糖尿病肾病(diabetic nephropathy,DN)是我国终末期肾脏病(ESRD)的主要原因之一,且比重逐年上升。众多研究表明,长期血糖升高可激活多元醇通路、PKC通路、已糖胺途径,促使活性氧类产生过多,以及葡萄糖在非酶促下生产的糖基化终末产物(AEGs)在细胞外聚集,导致细胞外基质蓄积、肾小球硬化等病理改变。高糖还可诱导多种细胞因子如转化生长因子-β1(TGF-β1)、血管内皮生长因子(VEGF)等表达参与这一过程[1]。然而,DN的发生发展机制目前还不是十分清楚,是否有其他重要蛋白和信号转导通路参与其发病进展过程有待于进一步研究。
骨桥蛋白(osteopontin,OPN)是一种具有多种功能的磷酸化糖蛋白,主要与avβ整合素或CD44家族结合,参与细胞间黏附、趋化、迁移和信号传导等生理及病理过程,在肿瘤、动脉粥样硬化等多种疾病的发生发展中起重要作用。在糖尿病动物模型中发现肾脏OPN表达升高,利用基因敲除OPN基因后,可减轻系膜细胞膨胀,降低尿蛋白产生,并发现OPN通过激活NF-κB途径,增加足细胞能动性,参与蛋白尿的形成[2]。在DN中,肾脏局部表现为炎性细胞浸润、间质纤维化,伴OPN、TGF-β等表达升高,利用抗体中和OPN表达后,减轻局部的巨噬细胞聚集,延缓纤维化进展[3]。以上研究表明,OPN参与DN单核巨噬细胞聚集、间质纤维化及蛋白尿产生等过程,一定程度上抑制OPN表达后可减轻上述病变,但引起OPN表达升高的具体机制仍不清楚。探讨OPN是否能成为逆转DN病理改变新的靶点及其具体的调控机制,目前已成为研究热点。
在本实验中,我们以HK-2细胞为模型,研究高糖刺激下OPN的表达,并进一步探讨其调控机制。
1 材料与方法
1.1 主要试剂及药品 DMEM低糖培养基(葡萄糖浓度4.5 mmol·L-1)、DMEM高糖培养基(葡萄糖浓度25 mmol·L-1)购于美国Hyclone公司;胎牛血清购自美国Gibco公司;鼠抗p-AKT(ser473)、p-S6,兔抗 Raptor和 Rictor购自 Cell Signaling;兔抗OPN购自美国Abcam公司;鼠抗β-actin、辣根过氧化酶标记的IgG羊抗鼠和羊抗兔二抗购自美国Santa Cruz公司。TRIzol试剂盒、DMSO试剂购自上海生工;逆转录试剂盒购自立陶宛Fermentas公司;ECL显影剂和PVDF膜购自美国Millipore公司。LY294002(溶于DMSO)购于碧云天生物研究所;rapamycin(溶于 DMSO)购于 Sigma公司;Lipo-fectamine 2000购于Invitrogen公司。
1.2 HK-2细胞培养 HK-2细胞为东南大学附属中大医院刘必成教授惠赠,给予DMEM低糖培养基和10%胎牛血清,置于37℃,5%CO2条件下培养,当细胞密度为80%~90%时,用0.25%胰酶(含0.1 mol·L-1EDTA)消化传代。实验组换用DMEM高糖培养基,对照组用含相同浓度甘露醇的DMEM培养基,检测高糖刺激不同时间点(12、24、48、72 h)OPN的表达。
1.3 RNA干扰 高糖培养24 h的HK-2细胞接种在12孔板中,继续高糖培养24 h,使细胞密度达40%~50%,利用脂质体转染技术,参照 Lipofectamine 2000转染试剂说明书分别转染 Raptor、Rictor及随机无靶点阴性对照(NC)siRNA。以上siRNA均由上海Gene Pharma公司合成,序列分别为 5′-GGACAACGGCCACCAGUAC-3′; 5′-ACUUGUGAAGAAUCGUAUC-3′;5′-UUCUCCGAACGUGUCACGU-3′。siRNA转染4~6 h后换用含10%胎牛血清的高糖培养基培养,48 h收样,Western blot检测相关蛋白的表达。
1.4 Real-time PCR法检测OPN mRNA表达 按TRIzol试剂说明书抽提不同组HK-2细胞总RNA。按标准步骤进行反转录,所得cDNA进行Real-time PCR实验,以β-actin为对照。Real-time PCR引物由上海生工合成,引物如下:OPN上游5′-AGCACAGCATCGTCGGGAC-3′,下 游 5′-TCCTTGGTCGGCGTTTGGCTG-3′;β-actin上游 5′-CACCCGCCGCCAGCTCAC-3′,下 游 5′-GCCCCACGATGGAGGGGAAGA-3′。以比较Ct法的相对定量表达差异计算,2-△△Ct表示基因的相对表达量:△△Ct=[Ct(待测基因)-Ct(β-actin)]试验组 -[Ct(待测基因)-Ct(β-actin)]对照组。
1.5 Western blot检测 OPN、p-AKT、p-S6、Raptor、Rictor蛋白表达 细胞按实验分组条件处理后,收集细胞,加入蛋白提取液裂解细胞。紫外分光光度计测定蛋白含量,每样本各取50μg蛋白,10%SDS-PAGE电泳,PVDF膜转印2 h,以5%脱脂奶粉封闭45 min,分别加入稀释的一抗OPN(1∶1 000),p-AKT(1 ∶100),p-S6(1 ∶1 000),Raptor(1∶1 000),Rictor(1∶1 000),β-actin(1∶1 000)于4℃孵育24 h后,辣根过氧化物酶标记的羊抗鼠、羊抗兔IgG二抗室温孵育4 h,ECL化学发光法显色,曝光显影,扫描仪扫描结果。GEL-Pro4图像分析软件分析结果,表达强度用OPN/β-actin,再用对照组平均值为1进行校正。
1.6 统计学分析 应用SPSS 11.0软件系统进行分析,计量资料用¯x±s表示,组间比较采用方差分析和t检验。
2 结果
2.1 高糖刺激上调HK-2细胞中OPN mRNA及蛋白的表达 为分析高糖对HK-2细胞OPN表达的影响,HK-2细胞经低糖培养基过夜培养后,换成高糖培养基继续培养,紧接着在不同时间点收集细胞,分析OPN的表达。如Fig 1 A所示:Real-time PCR分析表明,高糖刺激后OPN mRNA表达水平呈时间依赖性升高。高糖刺激48 h后,OPN mRNA的表达水平达高峰,是对照组的(1.60±0.03)倍(P<0.05)。进一步Western blot分析也表明,高糖呈时间依赖性上调OPN蛋白的表达,以72 h最高,但与48 h比较差异无统计学意义(Fig 1 B)。

Fig 1 mRNA and protein expression of OPN in HK-2 cells cultured in 25 mmol·L-1 glucose
2.2 高糖激活 PI3K/AKT/mTOR信号通路PI3K/AKT/mTOR信号通路在代谢调节中发挥重要作用[4]。为研究高糖刺激是否对 PI3K/AKT/mTOR信号通路有影响,我们提取高糖刺激48 h后的HK-2细胞蛋白裂解液,并通过Western blot分析p-AKT和p-S6(mTOR的下游靶分子及活性指标)的表达情况。研究表明,与对照组相比较,高糖刺激后p-AKT和p-S6蛋白的表达明显上调。因此,高糖激活PI3K/AKT/mTOR信号通路(Fig 2)。

Fig 2 Effect of high glucose on protein expression of p-AKT and p-S6 in HK-2 cells induced by 25 mmol·L-1 glucose(HG)for 48 h
2.3 抑制PI3K/AKT/mTOR信号通路下调高糖刺激下OPN的表达 为探讨高糖刺激是否通过激活PI3K/AKT/mTOR信号通路上调OPN的表达,我们应用PI3K特异性抑制剂LY290042、mTOR特异性抑制剂rapamycin处理HK-2细胞,观察高糖刺激下OPN的表达情况。研究结果表明,LY290042和rapamycin均明显降低了OPN的表达水平,且两者联合使用发挥更好的效果(Fig 3)。因此,以上结果表明,高糖是通过激活PI3K/AKT/mTOR信号通路上调OPN的表达。
2.4 mTORC1介导了高糖刺激下OPN的表达mTOR在哺乳动物细胞中能与不同的蛋白结合组装成两种复合体,即 mTOR复合物1(mTORC1)和mTOR复合物2(mTORC2)。mTORC1对rapamycin敏感,它的特有组成成分为Raptor蛋白;而mTORC2对rapamycin不敏感,其特有组成成分为Rictor蛋白。为进一步确认mTORC1和mTORC2在高糖刺激下OPN表达增强中的作用,我们运用RNA干扰技术分别敲低了Raptor和Rictor,然后检测高糖刺激下OPN表达变化的情况。如Fig 4所示,Raptor和Rictor siRNA均成功敲低了相应蛋白的表达;且与对照细胞相比,敲低 Raptor后 HK-2细胞OPN表达明显减少(P<0.05),而敲低Rictor后OPN表达无明显变化。以上结果表明,高糖刺激是通过激活 PI3K/AKT/mTORC1信号通路上调 OPN的表达。
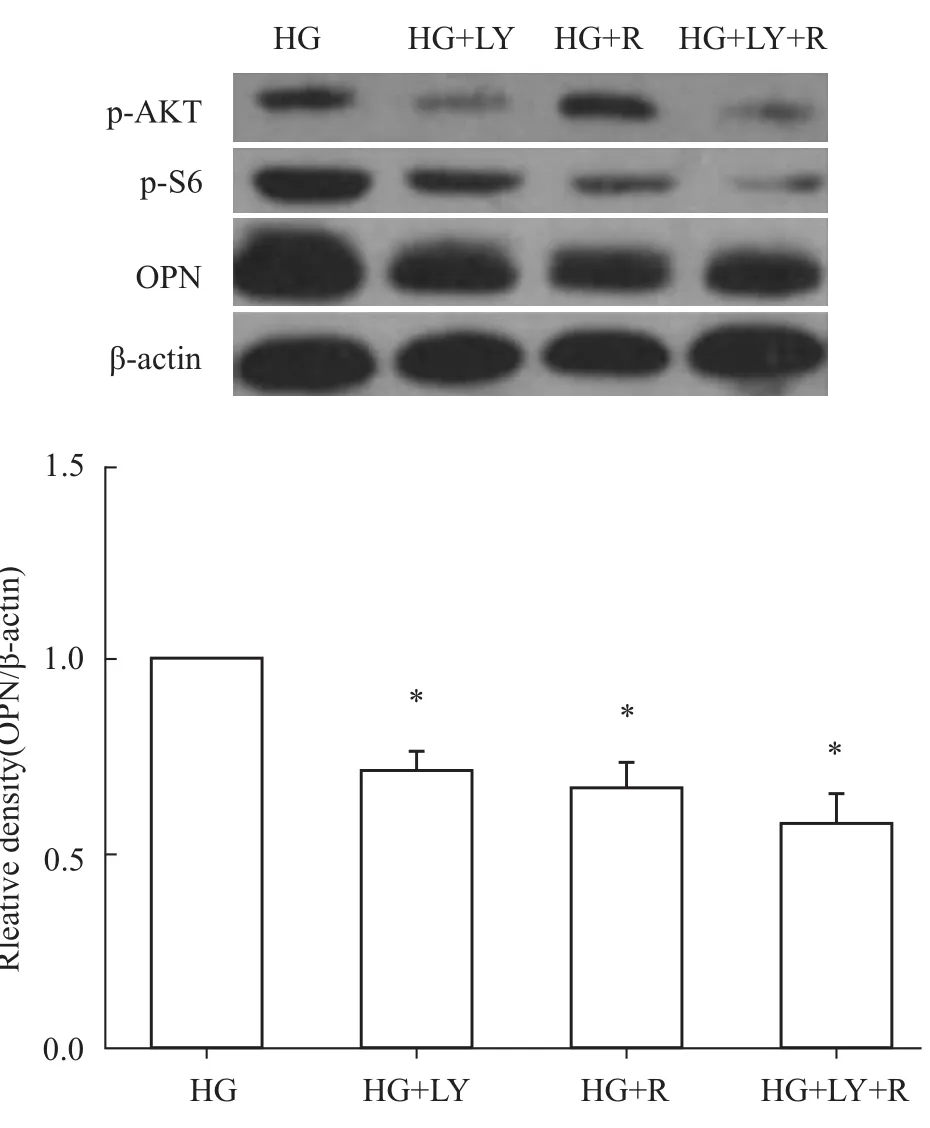
Fig 3 Effects of LY294002,rapamycin and the combination on protein expression of OPN in HK-2 cells cultured in 25 mmol·L-1 glucose for 48h
3 讨论
既往研究探讨OPN在糖尿病动物模型及细胞实验中的作用,如参与蛋白尿形成及炎细胞浸润、氧化应激、胶原蛋白合成等过程[2-3,5-6]。本研究建立在OPN在DN中起作用的前提下,以HK-2细胞为实验模型,发现,高糖刺激呈时间依赖性上调OPN mRNA及蛋白水平表达,同时高糖激活PI3K/AKT/mTOR信号通路。进一步探讨高糖调节肾小管上皮细胞OPN表达的机制,运用特异性抑制剂和RNA干扰技术,抑制PI3K/AKT/mTOR信号通路,创新性提出高糖通过激活PI3K/AKT/mTORC1信号通路上调OPN的表达。

Fig 4 Protein expression of OPN in HK-2 cells transfected with siRaptor,siRictor
Lee等[7]在鼠肾小球上皮细胞中发现高糖通过激活PI3K/AKT通路,抑制腺苷酸活化蛋白激酶(AMPK),活化mTOR,促进翻译抑制分子eIF-4E结合蛋白1(4E-BP1)磷酸化,进而增加蛋白合成,促进肾脏肥大。活化的PI3K/AKT/mTOR通路还参与DN中系膜基质增生、EMT等病理改变,并损伤足细胞参与蛋白尿形成[8]。近年研究发现,mTOR特异性抑制剂雷帕霉素(rapamycin)能够延缓DN动物模型中GBM增厚及肾小球的肥大,减轻系膜基质蓄积、减轻蛋白尿[9-11]。Junaid等[12]在人肾小管上皮细胞中发现,抑制PI3K后可降低OPN mRNA表达,但未进一步探讨下游具体信号通路。在DN大鼠模型中发现,雷帕霉素抑制OPN[13],据此,我们推测雷帕霉素可能通过抑制PI3K/AKT/mTOR通路,下调肾小管上皮细胞OPN的表达来减轻DN的病理改变。本研究通过高糖刺激HK-2细胞,激活PI3K/AKT/mTOR信号通路,同时OPN表达升高,运用特异性抑制剂和RNA干扰技术从不同途径抑制PI3K/AKT/mTORC1信号通路均降低OPN表达,而干扰mTORC2对OPN表达无影响,证实高糖通过激活PI3K/AKT/mTORC1信号通路上调OPN的表达。
实验发现,高糖促进OPN在mRNA水平表达增加。OPN基因启动子存在 NF-κB、Smads、TGF-β调控位点,DN中活化的 NF-κB、TGF-β/Smads通路可以在转录水平促进OPN的表达[14]。此外,高糖活化的PKC、肾小管处蓄积的AGEs,均可激活NF-κB和TGF-β/Smads信号通路,诱导相关基因如OPN、TGF-β活化[15]。且 OPN与 TGF-β存在相互作用,共同参与DN的发生、发展过程。在DN动物模型中,发现雷帕霉素可以抑制 TGF-β/Smads通路及OPN表达,减轻肾小管-间质损伤[13]。因此,活化的PI3K/AKT/mTORC1通路激活4E-BP1调控 NF-κB、细胞周期蛋白等蛋白质的翻译过程,NF-κB、TGF-β、avβ3是 PI3K/AKT/mTORC1通路的下游分子,我们猜测PI3K/AKT/mTORC1通路可能通过上调这些蛋白的活性来增强OPN的表达。我们在将来的研究中要进一步探讨这个问题。Hsieh等在DN动物模型及高糖诱导下的鼠肾小管上皮细胞中,利用芯片分析发现氧化应激、PKC-β1信号通路及RAS系统均参与调控OPN,并且之间存在交互作用,形成复杂的调控网络[16-17]。因此,高糖调控OPN受多个信号通路调控,抑制 PI3K/AKT/mTORC1并不能完全阻断OPN表达。
DN是糖尿病最严重并发症之一,发生率高,危害性大,明确其发病机制,进而逆转疾病进展成为研究热点。本实验揭示 PI3K/AKT/mTORC1/OPN在DN的发生、发展中可能起到重要作用,干扰、抑制这一通路可能是治疗DN的一个新的靶点。我们已完成的研究发现,mTORC1抑制剂雷帕霉素可延缓DN进展[5-6],我们也将继续在动物模型中探讨该作用是否通过抑制OPN表达所致,进一步验证OPN调控机制。
参考文献:
[1] Satirapoj B.Nephropathy in diabetes[J].Adv Exp Med Biol,2012,771:107-22.
[2] Lorenzen J,Shah R,Biser A,et al.The role of osteopontin in the development of albuminuria[J].J Am Soc Nephrol,2008,19(5):884-90.
[3] Kelly D J,Wilkinson-Berka J L,Ricardo SD,et al,Progression of tubulointerstitial injury by osteopontin induced macrophage recruitment in advanced diabetic nephropathy of transgenic(mRen-2)27 rats[J].Nephrol Dial Transplant,2002,17(6):985-91.
[4] Zha X J,Sun Q,Zhang H B,et al.mTOR upregulation of glycolytic enzymes promotes tumor development[J].Cell Cycle,2011,10(7):1015-6.
[5] Nicholas SB,Liu J,Kim J,et al.Critical role for osteopontin in diabetic nephropathy[J].Kidney Int,2010,77(7):588-600.
[6] Sun J,Xu Y,Deng H,et al.Involvement of osteopontin upregulation on mesangial cells growth and collagen synthesis induced by intermittent high glucose[J].J Cell Biochem,2010,109(6):1210-21.
[7] Lee M J,Feliers D,Mariappan M M,et al.A role for AMP-activated protein kinase in diabetes-induced renal hypertrophy[J].Am J Physiol Renal Physiol,2007,292(2):F617-27.
[8] Inoki K,Mori H,Wang JY,et al.mTORC1 activation in podocytes is a critical step in the development of diabetic nephropathy in mice[J].J Clin Invest,2011,121(6):2181-96.
[9] 王德光,李学旺,李 航,等.胰岛素通过激活PI3K/mTOR通路诱导人系膜细胞血管内皮细胞生长因子转录 [J].中国糖尿病杂志,2009,17(4):308-10.
[9] Wang D G,Li X W,Li H,et,al.Insulin stimulates vascular endothelial growth factor gene expression in mesangial cells through a PI3K/mTOR signaling pathway[J].Chin J Diabet,2009,17(4):308-10.
[10]王德光,李学旺,李 航,等.小剂量雷帕霉素延缓小鼠糖尿病肾病进展的研究 [J].中国糖尿病杂志,2010,18(7):500-3.
[10]Wang D G,Li X W,Li H,et,al.A low dose of rapamycin ameliorates renal injuries of type 2 diabetic mice[J].Chin J Diabet,2010,18(7):500-3.
[11]Lloberas N,Josep M C,Marcalla F,et al.Mammalian target of rapamycin pathway blockade slows progression of diabetic kidney disease in rats[J].J Am Soc Nephrol,2006,17(5):1395-404.
[12]Junaid A,Amara F M.Osteopontin:correlation with interstitial fibrosis in human diabetic kidney and PI3-kinase-mediated enhancement of expression by glucose in human proximal tubular epithelial cells[J].Histopathology,2004,44(2):136-46.
[13]罗利彬,刘 彬,王慧慧,等.雷帕霉素对糖尿病肾病大鼠组织TGF-β及 OPN表达的影响 [J].黑龙江医学科学,2012,35(5):5-6.
[13]Luo L B,Liu B,Wang H H,et al.Effect of rapamycin on the expression of transforming growth factor and osteopontin in the diabetic nephropathy rats[J].Heilongjiang Med Pharm,2012,35(5):5-6.
[14]Aoyama I,Shimokata K,Niwa T.Oral adsorbent AST-120 ameliorates interstitial fibrosis and transforming growth factor-beta(1)expression in sporitaneously diabetic rats[J].Am J Nephrol,2000,20(3):232-41.
[15]Oyama Y,Akuzawa N,Nagai R,et al.PPARγligand inhibits osteopontin gene expression through interference with binding of nuclear factors to A/T-rich sequence in THP-1 cells[J].Circ Res,2002,90(3):348-55.
[16]Hsieh T J,Chen R,Zhang S L,et al.Upregulation of osteopontin gene expression in diabetic rat proximal tubular cells revealed by microarray profiling[J].Kidney Int,2006,69(6):1005-15.
[17]Biecker E,De Gottardi A,Neef M,et al.Long-term treatment of bile duct-ligated rats with rapamycin(sirolimus)significantly attenuates liver fibrosis:analysis of the underlying mechanisms[J].J Pharmacol Exp Ther,2005,313(3):952-61.
——雷帕霉素

