哮喘大鼠血清褪黑素及海马褪黑素受体1的变化
陈 雯,费广鹤
支气管哮喘是一种由多种炎性细胞及气道结构细胞参与的慢性炎症性疾病[1-2]。其最重要的病理生理特征是长期慢性缺氧和气道及系统性慢性炎症,并导致多脏器功能的损害[3]。中枢神经系统,尤其是海马,对慢性缺氧和炎性应激非常敏感,是重要的受累部位。海马作为边缘系统的一部分,是下丘脑-垂体-肾上腺皮质(HPA)轴的高位调节中枢,富含多不饱和脂肪酸,易受氧化应激的损伤,是脑内各种病理因子表达的敏感区[5-6]。哮喘等慢性应激状态导致海马神经元萎缩、损伤,引起海马结构和功能改变[7]。
褪黑素(melatonin,Mel)是松果体腺等分泌的吲哚类激素,具有抗炎、抗氧化、神经保护等作用[8]。我们的前期研究[9-10]证实,哮喘患者的外周褪黑素水平下降,褪黑素在支气管哮喘的发生、发展中,可能呈现抗炎、抗氧化等保护性作用[11]。李光等[12]证实,褪黑素能抑制间歇低氧导致的氧化应激,从而对间歇低氧导致的大鼠海马损伤具有保护作用,但其分子生物学机制尚不明了。哺乳动物中,褪黑素多依赖褪黑素受体(melatonin receptor,MT)发挥作用[13],其中,褪黑素受体 1(melatonin receptor 1,MT1)在中枢神经系统分布广泛。因此,我们提出假设:机体为适应哮喘的慢性炎症及慢性应激反应,可能内源性上调中枢神经系统内褪黑素受体表达,弥补外周褪黑素水平的下降,参与神经保护和神经免疫调节作用。本研究通过建立哮喘大鼠模型,用免疫组织化学、免疫印迹及RT-PCR等技术检测哮喘组及对照组大鼠海马组织MT1的分布及表达,结合血清中褪黑素水平的变化,初步探讨海马组织MT1在哮喘发生、发展中的神经保护及神经免疫调节作用。
1 材料与方法
1.1 材料与试剂
1.1.1 主要试剂 山羊抗大鼠MT1抗体(美国,Santa Cruz公司),ABC免疫组织化学试剂盒(美国,Vector Laboratories公司),逆转录试剂盒(一步法)及PCR扩增试剂盒(大连宝生物公司),大鼠MT1和β-actin引物(生工生物工程上海有限公司),褪黑素酶联免疫吸附检测试剂盒(武汉优尔生科技股份有限公司)。
1.1.2 哮喘模型的建立及分组 成年SPF级♂SD大鼠60只,周龄7周,体质量180~200 g,由安徽医科大学实验动物中心提供。适应性喂养1周后,随机分成对照组(20只)和哮喘组(40只)。对照组随机分为2组,每组10只,均于建模d 17取材,10只用于免疫印迹、RT-PCR及血清褪黑素检测,10只用于免疫组织化学检测。哮喘组随机分4组,每组10只:分别于建模d 5、d 10、d 17取材以行免疫印迹、RT-PCR及血清褪黑素检查的3组(d 5、d 10、d 17),及d 17取材行免疫组织化学检测的一组。大鼠饲养在安静、温度(22±2)℃、12 h光照及12 h黑暗环境(L7∶00~19∶00,D19∶00~7∶00)。
哮喘模型的制备:①哮喘组:采用卵清蛋白(ovalbumin,OVA,Sigma,GradeⅢ)致敏及激发建立哮喘模型;d1每只用OVA 500μg加氢氧化铝干粉8 mg于生理盐水1.5 ml配成混悬液,腹腔内注射,于d 7予以10 g·L-1OVA 2 ml皮下注射增强致敏。d 14~17连续以8 L·min-1驱动流速超声雾化器吸入10 g·L-1OVA 30 min,激发哮喘发作。哮喘大鼠表现为烦躁不安、呼吸急促、腹式呼吸、哮鸣音、腹肌收缩和跌倒。②阴性对照组:d 1和d 7分别予以生理盐水替代OVA腹腔及皮下注射,d 14~17予以生理盐水雾化吸入,每天30 min。
1.2 方法
1.2.1 标本收集 分别在d 5、d 10、d 17 6∶00~6∶20 am收集眼眶静脉血;全血离心后,血清标本置-20℃冰箱保存待行褪黑素浓度检测。后予以不同组大鼠戊巴比妥钠腹腔注射麻醉后,麻醉状态下灌流生理盐水,迅速取出海马冻在干冰中,-70℃冰箱内储存,待行免疫印迹及RT-PCR检查。拟行免疫组织化学检测的大鼠在d 17 6∶00~7∶00 am予以戊巴比妥钠麻醉后,打开胸腔,剪破右心耳,经左心室行质量分数为4%的多聚甲醛(PBS,pH 7.4溶解)全身灌注固定,而后取海马组织浸入质量分数为30%的蔗糖/PBS过夜,常规包埋切片(厚度10 μm)待行免疫组织化学检测。所有大鼠取材于当日6∶00~7∶00 am完成。
1.2.2 免疫组织化学方法检测MT1在大鼠海马组织的表达及定位 采用ABC法进行免疫组化学染色。切片常规脱蜡、水化,质量分数为3%的双氧水去除内源性过氧化物酶,枸橼酸盐缓冲液微波修复,质量分数为 5%的羊血清(Vector Laboratories,USA)封闭,一抗羊抗鼠 MT1(1∶2 000,Santa Cruz Biotechnology,Santa Cruz,CA,USA),37℃孵育1 h,4℃孵育过夜;滴加生物素标记的二抗IgG,室温避光孵育30 min,滴加链霉亲和素-过氧化物酶,室温孵育1 h,DAB染色,苏木精对比染色,中性树胶封固。以细胞内出现棕黄色颗粒、染色强度高于背景非特异性染色者为阳性。
1.2.3 逆转录 -聚合酶链反应(RT-PCR)检测MT1 mRNA表达 取30 mg海马组织,用柱式TRIzol总RNA抽提试剂盒提取组织总RNA,操作步骤按说明书进行。采用随机引物方法扩增第1链cDNA。MT1聚合酶链反应(PCR)引物序列:上游引物5′-TGCCCTGGTGGTTTTCCATT-3′,下 游 引 物 5′-CAGTTTGGGTTTGCTGTCCG-3′;扩增片段大小121 bp。内参β-actin上游引物5′-CACGGCATTGTCACCAACTG-3′,下游引物 5′-AACACAGCCTGGATGGCTAC-3′;扩增片段大小203 bp。PCR反应条件:预变性94℃ 5 min;94℃ 1 min,58℃ 1 min,72℃1 min,共36个循环,扩增产物用质量分数为1.5%的琼脂糖凝胶电泳,紫外分析仪观察结果,MUVB-20凝胶成像分析系统(Ultralum,USA)对扩增产物进行扫描,分别测定MT1及β-actin的吸光度值。
1.2.4 Western blot检测MT1蛋白表达 取30 mg海马组织在研磨器剪碎后,加入蛋白裂解液300μl,液氮内研磨呈匀浆,冰上裂解30 min后,裂解液4℃下13 000×g离心5 min,取上清,并置于-20℃保存。BCA法(BCA protein assay kit;Pierce,Rockford,IL,USA)检测蛋白含量,加 2×SDS加样缓冲液,置于PCR仪上98℃变性10 min。按每孔25μg蛋白量加样,进行SDS聚丙烯酰胺凝胶电泳。转膜后,用PBS缓冲液配制含质量分数为5%的脱脂奶粉的封闭液4℃封闭过夜。分别加入一抗:MT1(1∶200,Santa Cruz)、β-actin(1∶500,Chemicon)和相应二抗孵育,洗膜,ECL显影,胶片成像。结果使用Kodak 1D image analysis DC290 software测定Western blot条带灰度值,以β-actin为内参照,进行半定量分析。
1.2.5 酶联免疫吸附测定法(ELISA)检测血清褪黑素水平 Mel浓度采用ELISA法检测,按说明书严格操作。吸50μl标准液、对照或样品,加入酶标试剂50μl温育,洗涤;加入显色剂A 50μl,封板膜封板后置37℃温育30 min,洗涤,再加入显色剂B 50μl,轻轻震荡混匀,37℃避光显色15 min,加终止液50μl,终止反应。以空白对照孔调零,在60 min内在450 nm波长依序测量各孔的吸光度(OD值)。此ELISA试剂盒检测血清褪黑素水平的范围为12.35~1 000 ng·L-1。
1.3 统计学处理 所有数据均用¯x±s表示,使用SPSS 16.0软件 (SPSS,Inc.,Chicago,IL,USA)进行分析。多组均数间比较采用单因素方差分析,组间两两比较采用Bonferroni检验。
2 结果
2.1 免疫组织化学染色检测大鼠海马组织内MT1分布 哮喘组与阴性对照组大鼠海马组织中MT1表达均呈阳性,表现为聚集性棕黄色阳性颗粒,哮喘组MT1染色强度强于对照组。MT1广泛分布于海马组织中,CA1-CA3中MT1阳性的细胞主要集中于三角形胞体中。见Fig 1。
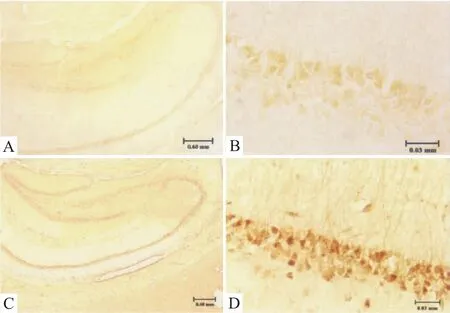
Fig 1 Immunohistochemistry of MT1 in hippocampus
2.2 RT-PCR检测大鼠海马组织内MT1 mRNA水平表达 与阴性对照组比较,不同时期哮喘组大鼠海马组织中MT1 mRNA表达均明显增加(P<0.05,n=4)。与对照组比较,d 5哮喘组大鼠海马组织中MT1mRNA表达明显增加(P<0.05,n=4),但与d 10哮喘组无明显差异(P>0.05,n=4)。d 17哮喘组大鼠海马组织中MT1mRNA表达较阴性对照组及d 5组均明显增加(P<0.05,n=4);平均吸光强度与β-actin比较结果显示,d 17哮喘组MT1分别是阴性对照组及 d 5的(3.75±0.14)倍及(2.14±0.06)倍。见 Fig 2。
2.3 Western blot检测大鼠海马组织内MT1蛋白表达水平 与阴性对照组比较,不同时期哮喘组大鼠海马组织中MT1蛋白表达均明显增加(P<0.05,n=4)。与对照组比较,d 5哮喘组大鼠海马组织中MT1蛋白表达明显增加(P<0.05,n=4),但与 d 10哮喘组无明显差异(P>0.05,n=4)。d 17哮喘组大鼠海马组织中MT1蛋白表达较阴性对照组及d 5组均明显增加(P<0.05,n=4);平均吸光强度与βactin比较结果显示,d 17哮喘组MT1分别是阴性对照组及d 5哮喘组的(3.20±0.16)倍及(1.50±0.05)倍。见 Fig 3。
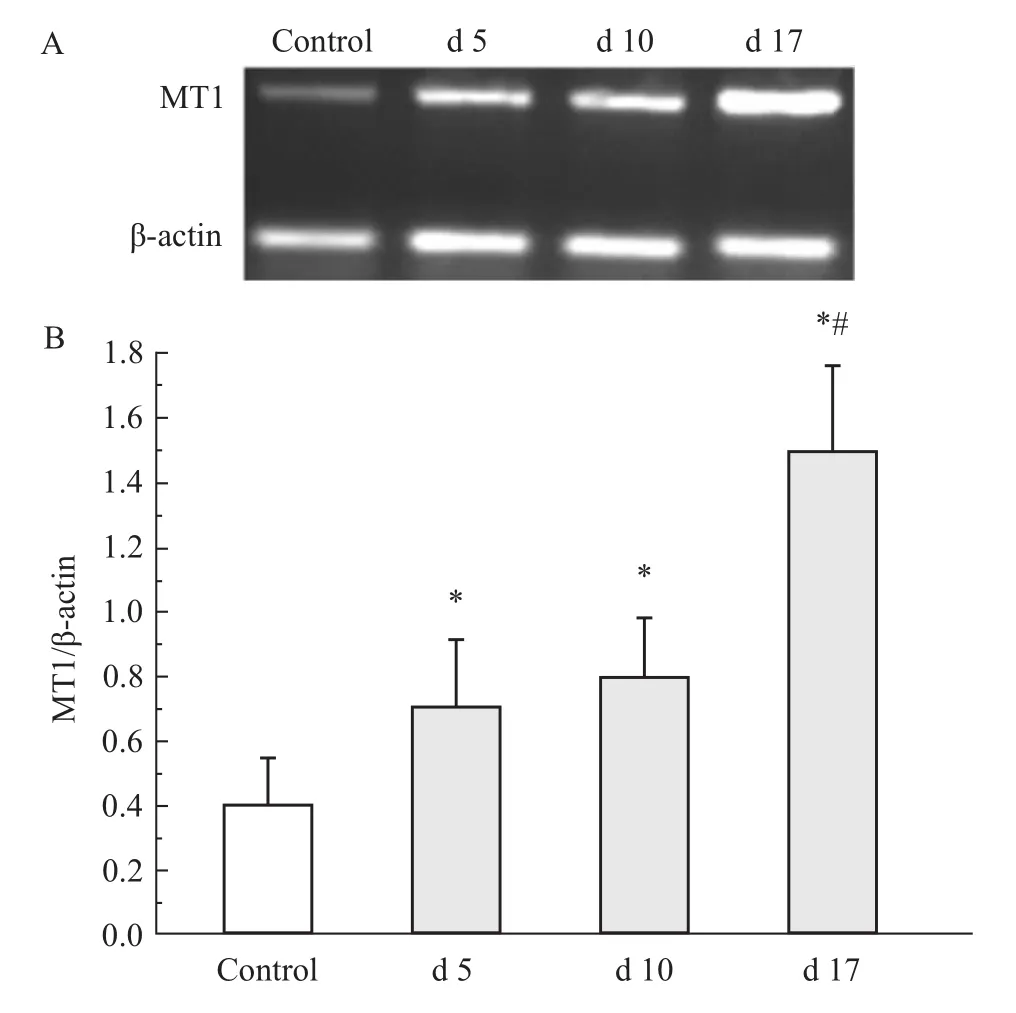
Fig 2 Gene expression of MT1 in hippocampus
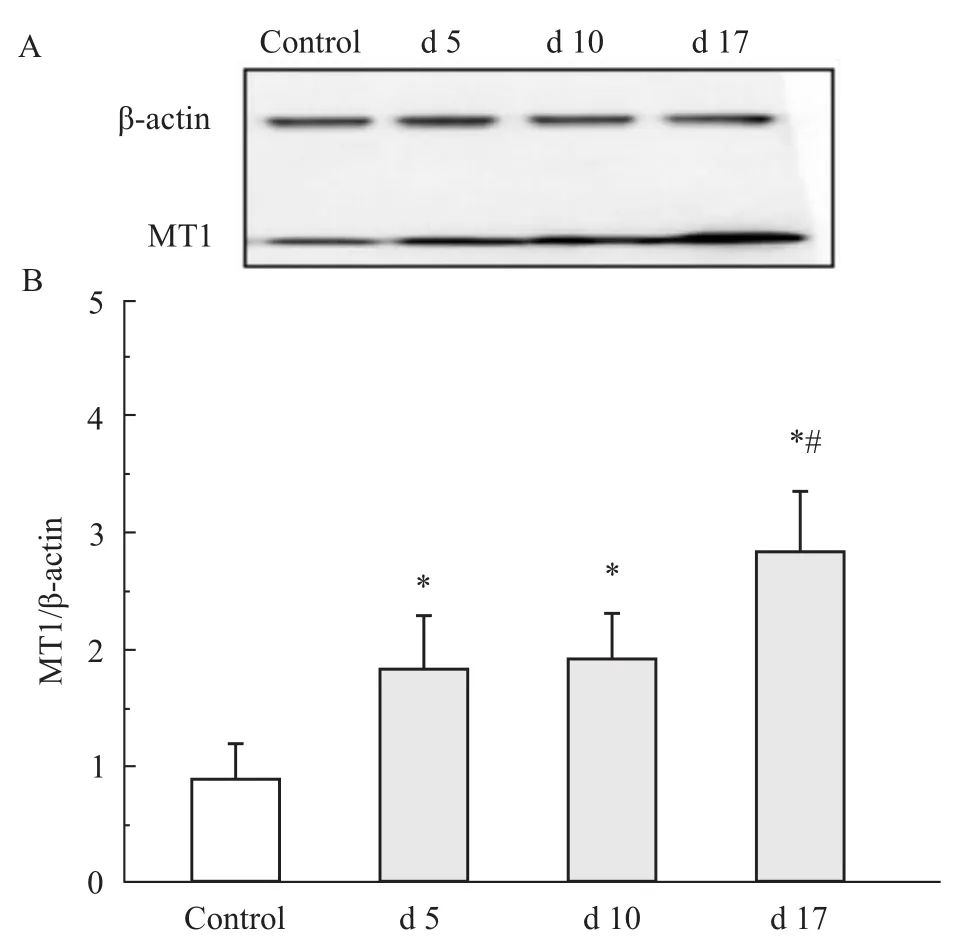
Fig 3 Protein expression of MT1 in hippocampus
2.4 血清Mel检测 与阴性对照组比较,不同时期哮喘组大鼠血清Mel水平均明显下降(P<0.05,n=10)。与对照组比较,d 5哮喘组大鼠血清Mel浓度明显降低(P<0.05,n=10),但与d 10哮喘组无明显差异(P>0.05,n=10)。而d 17哮喘组大鼠血清Mel浓度较对照组及d 5组均明显下降(P<0.05,n=10)。见 Fig 4。
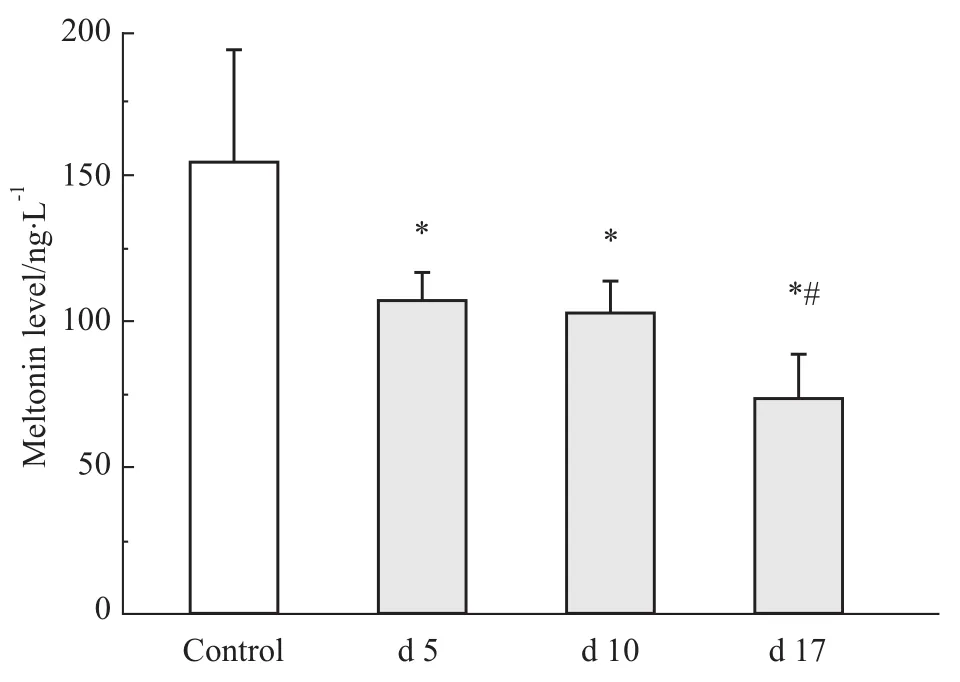
Fig 4 Serum melatonin levels in different groups
3 讨论
本实验以经典的OVA方法成功复制哮喘大鼠模型,并通过免疫组织化学技术从形态学初步探讨了MT1在大鼠哮喘海马组织中的分布及表达,通过Western blot和RT-PCR技术证实了MT1在哮喘大鼠模型海马组织中的过表达,且在哮喘的发生、发展过程中,其上调趋势呈时间依赖性;而同期血清褪黑素的水平则明显下降。
褪黑素是一种受体依赖的吲哚类激素,其作为一种自由基清除剂,具有广谱抗氧化能力[13]。由于高度的脂溶性,褪黑素可以自由通过血 -脑屏障[14],并通过MT在中枢神经系统内参与神经免疫调节及神经保护作用。MT1及MT2在视交叉上核(SCN)、小脑、下丘脑、基底节、海马等区域均有表达,尤其在海马组织表达非常丰富[15]。本课题组先前的研究[9-10]证实,哮喘患者血清中褪黑素水平的下降,提示褪黑素可能参与哮喘的发病机制,但其与MT的关系及分子机制尚不明了。
近年来研究[16-17]表明,哮喘的发生、发展过程中,中枢神经系统与免疫系统之间存在着双向的联系及相关调节,如哮喘大鼠中枢神经系统中SP、c-FOX蛋白等与肺内呈现同样的上升趋势,哮喘的发病机制中可能存在神经免疫调节的参与。孔祥英等[18]指出,哮喘的慢性炎症及慢性缺氧可引起海马形态学的改变和炎性损伤。本实验模拟了哮喘的发生、发展过程,从形态学、基因及蛋白水平证实了哮喘大鼠海马组织MT1表达的进行性上调。海马组织MT1的高表达弥补了外周褪黑素水平的下降,作为反馈性代偿,在哮喘所致的慢性缺氧和应激状态下发挥抗炎及抗氧化作用,参与清除自由基,并与HPA轴相互影响,可能参与神经保护和神经免疫调节。本实验中,海马MT1表达的增高在哮喘的发生、发展过程中呈现时间依赖性模式,即随大鼠对变应原(OVA)的接触时间逐渐增加,而血清中褪黑素水平逐渐下降,外周与中枢神经系统内指标变化的时间相关性表明两者间可能相互影响,且与哮喘的发生、发展存在着某种因果联系。在大鼠哮喘模型的建立过程中,海马组织MT1在基因及蛋白水平表达上调的一致性,进一步证实MT1水平的增加源于哮喘大鼠内源性的基因调控。上述实验结果证实了我们预先的假设,即在哮喘的发生、发展过程中,血清褪黑素水平逐渐下降,海马MT1水平逐渐增加,表明MT1在哮喘大鼠模型的中枢神经系统中起着重要的神经保护和神经免疫调节作用。
综上所述,在哮喘的慢性炎症及慢性应激过程中,海马MT1水平的内源性上调,可能是机体应对血清褪黑素外周水平降低的一种适应性代偿,增强了褪黑素在中枢神经系统中的抗炎及抗氧化作用,从而参与哮喘的发病机制及神经免疫调节。其对褪黑素在哮喘的治疗提供了新的途径。
参考文献:
[1] Busse W W,Lemanske R F Jr.Asthma[J].N Engl J Med,2001,344(5):350-62.
[2] 魏小敏,费广鹤,荣学本,李 静.热休克蛋白70调节突触融合蛋白 Syntaxin1在哮喘中的表达[J].中国药理学通报,2012,28(6):791-6.
[2] Wei X M,Fei GH,Rong X B,Li J.The modulation of heat shock protein 70 on the expresson of syntaxin1 in asthmatic model[J].Chinese Pharmacological Bulletin,2012,28(6):791-6.
[3] Caramori G,Papi A.Oxidants and asthma[J].Thorax,2004,59(2):170-3.
[4] Barnes P J.Neurogenic inflammation in the airways[J].Respir Physiol,2001,125(1-2):145-54.
[5] 刘社兰,许德义.海马在神经免疫调控中的作用[J].广西医学,2000,22(5):998-1001.
[5] Liu SL,Xu D Y.The role of the hippocampus in the neuroimmunomodulation[J].Guangxi Med J,2000,22(5):998-1001.
[6] Menendez-Pelaez A,Poeggeler B,Reiter R J,et al.Nuclear localization of melatonin in different mammalian tissues:immunocy-tochemical and radioimmunoassay evidence[J].J Cell Biochem,1993,53(4):373-82.
[7] Sousa N,Lukoyanov N V,Madeira M D,et al.Reorganization of the morphology of hippocampal neurites and synapses after stressinduced damage correlates with behavioral improvement[J].Neuroscience,2000,97(2):253-66.
[8] Kaur C,Sivakumar V,Robinson R,et al.Neuroprotective effect of melatonin against hypoxia-induced retinal ganglion cell death in neonatal rats[J].J Pineal Res,2013,54(2):190-206.
[9] 费广鹤,刘荣玉,张志红,周江宁.支气管哮喘患者唾液褪黑素和皮质醇水平及其与病情的关系[J].中华结核和呼吸杂志,2003,26(11):679-82.
[9] Fei G H,Liu R Y,Zhang Z H,Zhou JN.Relationships between melatonin and cortisol and the status of disease in patients with bronchial asthma[J].Chin J Tubercul Resp Dis,2003,26(11):679-82.
2、UE通过向eNodeB发送Tracking Area Update Request消息以及指示了Selected Network和old GUMMEI的RRC参数来发起一个TAU流程。
[10]Fei GH,Liu R Y,Zhang ZH,Zhou JN.Alterations in circadian rhythms of melatonin and cortisol in patients with bronchial asthma[J].Acta Pharmacol Sin,2004,25(5):651-6.
[11]Gumral N,Caliskan S,Ozgüner F,et al.Melatonin levels and enzymatic antioxidant defense system decrease in blood of patients with bronchial asthma[J].Toxicol Ind Health,2009,25(6):411-6.
[12]李 光,柴文戍,康 健.褪黑素对间歇低氧大鼠海马损伤保护作用的研究[J].中国全科医学,2011,14(21):2414-6.
[12]Li G,Chai WS,Kang J.Study on the protective effect of melatonin against intermittent hypoxia induced hippocampal injury in rats[J].Chin General Pract,2011,14(21):2414-6.
[13]Dubocovich M L,Markowska M.Functional MT1 and MT2 melatonin receptors in mammals[J].Endocrine,2005,27(2):101-10.
[14]Corvino V,Marchese E,Michetti F,Geloso M C.Neuroprotective strategies in hippocampal neurodegeneration induced by the neurotoxicant trimethyltin[J].Neurochem Res,2013,38(2):240-53.
[15]徐海伟,黎海蒂,范晓棠,龚发云.Mel-la,Mel-1b褪黑素受体在大鼠海马分布的原位杂交研究[J].神经解剖学杂志,2001,17(2):147-50.
[15]Xu H W,Li H D,Fan X T,Gong F Y.The Distribution of Mel-1a,Mel-1b melatonin receptor in the hippocampus of rats:in situ hybridization study[J].Chin J Neur,2001,17(2):147-50.
[16]董 榕,刘 悦,薛德彬,王月涵.P物质对哮喘大鼠神经内分泌功能的调节[J].中国药理学通报,2010,26(1):95-9.
[16]Dong R,Liu Y,Xue D B,Wang Y H.The role of substance Pto modulate the neuroendocrine function in asthmatic rats[J].Chin Pharmacol Bull,2010,26(1):95-9.
[17]Chen SD,Wen Z H,Chang W K,et al.Acute effect of methylprednisolone on the brain in a rat model of allergic asthma[J].Neurosci Lett,2008,440(2):87-91.
[18]孔祥英,熊建平,白家驷,肖桃元.慢性哮喘豚鼠及其在低氧干预下海马脑区超微结构的变化[J].第三军医大学学报,2003,25(5):420-2.
[18]Kong X Y,Xiong JP,Bai JS,Xiao T Y.Ultrastructural changes of hippocampus in guinea pigs with chronic asthma and the effects of hypoxia treatment[J].Acta Acad Med Mil Tert,2003,25(5):420-2.

