应用Micro CT观察洛伐他汀和秋水仙碱对CCl4致肝损伤后小鼠骨代谢的影响
吕思敏,于 琼,夏海珊,崔 燎,2,吴 铁
(1.广东医学院药学院,广东东莞 523808;2.广东天然药物研究与开发重点实验室,广东湛江 524023)
四氯化碳(CCl4)是建立肝损伤模型最常用的物质,其作用机制与氧自由基的脂质过氧化相关[1-2]。慢性肝病常伴有骨代谢的改变,可致肝性骨营养不良及骨质疏松等肝性骨病的发生,以骨质疏松最为常见[3]。目前发现,不仅原发性胆汁性肝硬化可发生骨质疏松症,其它原因的肝脏疾病也可引起。因此,防治肝脏疾病所导致的骨质疏松症日渐受到重视。
秋水仙碱是公认的抗肝纤维化药物,但邱永祥等[4]试验证明,秋水仙碱对小鼠的肝脏有损伤作用。临床研究表明[5],服用他汀类药物可以升高血清骨钙素水平。但在肝损伤后的治疗中是否能够预防骨丢失,目前还未见报道。
本实验旨在用小鼠建立肝损伤的动物模型,通过Micro CT观察骨组织结构,以探讨在肝损伤中骨丢失的状况,并同时观察洛伐他汀、秋水仙碱在护肝的同时是否有减少骨丢失的作用,为其应用于肝硬化性骨病的防治提供实验依据。
1 材料与方法
1.1 动物 本院实验动物中心提供的普通级昆明种小白鼠32只,体质量(36.77±5.23)g,♀♂兼用。
1.2 药物 四氯化碳(分析纯),购于天津市大茂化学试剂厂。实验时,用花生食用调和油配成体积分数为 40%的 CCl4溶液。秋水仙碱片,批号120125,购于西双版纳版纳药业有限责任公司;洛伐他汀片,批号20120108,购于北京万生药业有限责任公司;实验时用蒸馏水配制成混悬液。
1.3 仪器与试剂 Micro CT仪(viva CT40;SCANCO Medical AG),BioTek Synergy 2多功能酶标仪,Eppendorf 5415R小型高速冷冻离心机,赛多利斯BT 25S电子天平。谷草转氨酶(AST/GOT)测定试剂盒、谷丙转氨酶(ALT/GPT)测定试剂盒、总超氧化物歧化酶(T-SOD)测试盒、丙二醛(MDA)测试盒、谷胱甘肽过氧化物酶(GSH-Px)测试盒、考马斯亮蓝蛋白测定试剂盒均购于南京建成生物工程研究所。
1.4 实验方法 取上述小鼠随机分为4组,每组8只,分笼饲养,对照组(CON):给予花生油0.1 ml·(10 g)-1皮下注射,首剂加倍,每隔5天注射1次,于造模次日给予蒸馏水10 ml·kg-1灌胃,每日1次,连续1个月;四氯化碳组(CTC):为肝损伤模型组,给予体积分数为40%的CCl4花生油溶液按0.1 ml·(10 g)-1皮下注射,首剂加倍,每隔5天注射1次,注射后给予蒸馏水10 ml·kg-1灌胃,每日1次,连续1个月;洛伐他汀组(LOV):按模型组同法给予CCl4后,按2.6 mg·kg-1给予洛伐他汀溶液灌胃,每日1次,连续1个月;秋水仙碱组(COL):按模型组同法给予CCl4后,按0.065 mg·kg-1给予秋水仙碱溶液灌胃,每日1次,连续1个月。上述动物饲养条件相同,自由进食和饮水。每隔5天称体重1次,均于实验d 30晚上禁食,禁食12 h后动物摘眼球取血,分离血清,测定AST、ALT;剥离肝脏,制备肝匀浆,测 GSH-Px、SOD、MDA;同时剥离右侧胫骨,用于Micro CT检测。
1.5 观察指标及测定方法
1.5.1 小鼠体重及肝脏重量的观察 小鼠肝脏系数的计算:肝脏系数 =[肝脏重量(g)/小鼠体重(g)]×100%
1.5.2 血清学指标AST、ALT活性的检测 小鼠血样3 000 r·min-1离心 10 min(4℃),取血清,采用比色法,用酶标仪进行检测,具体步骤均按试剂盒说明书操作。
1.5.3 肝匀浆抗氧化指标的检测 准确称取肝脏相同部位0.2 g,用冷生理盐水1.8 ml制备10%肝匀浆,按试剂盒说明书分别测定SOD活性、MDA和GSH-Px水平。
1.5.4 Micro CT对小鼠胫骨骨小梁的分析[6-7]将小鼠胫骨除尽肌肉和附着组织,放入Micro CT仪,对胫骨近干骺端进行X射线扫描。扫描条件为:电压70 kVp,电流114μA,扫描时间为24.8 min(单层),间隔时间为200 ms,分辨率为中度(Medium)。进行角度为180°的投射,对同一样品扫描获得500张不同截面的1024×1024像素的图片,对于胫骨选取距生长板远端1 mm,层厚2 mm的骨组织为兴趣区域(region of interest,ROI)进行三维重建。完成图像二值化,选定ROI内松质骨进行三维可视化呈现。定量分析使用其软件(SCANCO Medical AG),分析参数。
1.6 统计学处理 所有数据用¯x±s表示,多组用F检验,两两比较用q检验。
2 结果
2.1 各组小鼠实验前及实验后的体重变化 小鼠体重各组间无统计学意义,但有下列趋势:对照组小鼠体重随时间稍有增加趋势,在实验结束时,体重比实验前增幅10.54%,其余各组小鼠在给予CCl4后体重下降,后逐步回升(Tab 1)。
2.2 各组小鼠实验后肝重量及肝指数的变化 如Tab 2所示,与对照组比较,模型组小鼠肝脏指数明显升高,升高了约28.48%(P<0.05)。与对照组相比,洛伐他汀组、秋水仙碱组的肝脏指数明显升高(P<0.05),与模型组相比较,差异无统计学意义。
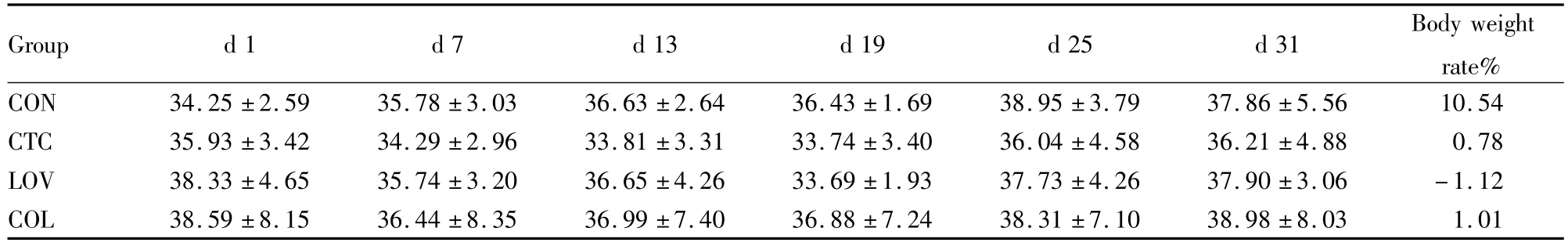
Tab1 EffectsofdrugsonbodyweightinCCl4inducedliverinjuryinmice(¯x±s,n=8)
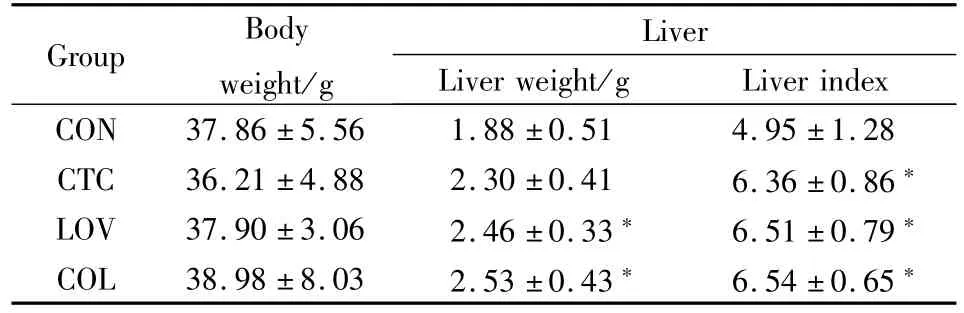
Tab2 EffectsofdrugsonliverindexinCCl4induced liverinjuryinmice(¯x±s,n=8)
2.3 各组小鼠实验后血清AST和ALT活性的变化 实验数据表明(Tab3),由CCl4引起的肝损伤模型组血清AST、ALT活性比对照组明显升高,分别升高了37.54%、97.59%(P<0.05),差异有显著性,提示造模成功。但洛伐他汀组、秋水仙碱组的AST和ALT活性均高于对照组,且差异有统计学意义(P<0.05)。

Tab3 EffectsofdrugsonactivitiesofserumASTandALTin CCl4inducedliverinjuryinmice(¯x±s,n=8)
2.4 各组小鼠实验后肝匀浆SOD活性及GSH-Px和MDA水平的变化 如Tab4所示,与对照组比较,模型组小鼠肝匀浆中SOD活性和GSH-Px水平明显降低,分别降低了18.48%(P<0.05)、24.96%(P<0.05),MDA水平明显升高,升高了约52.63%(P<0.05),提示造模成功。与模型组比较,洛伐他汀组、秋水仙碱组小鼠肝匀浆中GSH-Px水平均明显增强,分别增加了39.74%、29.09%(P<0.05)。洛伐他汀和秋水仙碱组小鼠肝匀浆中SOD活性、MDA水平与模型组相比,差异均无显著性。
2.5 MicroCT对小鼠胫骨骨组织结构参数的分析
2.5.1 MicroCT测定小鼠胫骨BVF、Tb.N、Tb.Sp和Tb.Th值 如Tab5所示,模型组的骨体积分数(BVF)、骨小梁数量(Tb.N)明显低于对照组,分别降低了约48.01%(P<0.05)、48.52%(P<0.05),而骨小梁分离度(Tb.Sp)明显高于对照组,升高了约154.54%(P<0.05),但骨小梁厚度(Tb.Th)和对照组相比,差异无显著性。表明小鼠胫骨的松质骨在给予CCl4后出现了明显的骨小梁体积分数下降,骨小梁数量降低,间隙增宽,出现较为严重的结构退变,表现骨质疏松症状。秋水仙碱治疗组的BVF值、Tb.N值明显低于对照组(P<0.05),Tb.Sp值明显高于对照组(P<0.05),Tb.Th值与对照组相比差异无显著性,这表明秋水仙碱组骨量丢失严重,骨量与模型组相当,说明秋水仙碱对CCl4致肝损伤所引发的骨小梁减少以及结构退变的改善作用较弱。洛伐他汀治疗组的BVF、Tb.N值介于模型组与对照组之间,且数据结果更为接近对照组,Tb.Th值与对照组相比差异无显著性,这表明两者骨小梁量相仿,骨量增加,说明洛伐他汀对CCl4致肝损伤所引发的骨小梁数量减少及骨小梁结构退变的改善作用较强。

Tab4 EffectsofdrugsonSOD,GSH-PxandMDAinliverhomogenateinCCl4inducedliverinjuryinmice(¯x±s,n=8)

Tab5 ChangesofdrugsonBVF,Tb.N,Tb.SpandTb.Thof proximaltibialinCCl4inducedliverinjuryinmice(¯x±s,n=8)
2.5.2 MicroCT测定的小鼠胫骨TMD和Conn.D.值 如Tab6所示,模型组的组织矿物密度(TMD)值明显低于对照组,降低了约46.51%(P<0.05),说明小鼠的骨密度降低,模型组的连接密度(Conn.D.)值明显低于对照组,降低了 71.83%(P<0.05),说明小鼠的骨小梁网络之间的连接数量较低,提示出现骨质疏松症状。秋水仙碱治疗组的Conn.D.值介于模型组与对照组之间,且数据结果更为接近模型组,但其TMD值与模型组相比差异有显著性,增加了约88.24%(P<0.05),说明秋水仙碱组能增加骨量,但是连接性不好。洛伐他汀治疗组的Conn.D.值介于模型组与对照组之间,数据结果更为接近对照组,且其TMD值与模型组相比差异有显著性,增加了约196.28%(P<0.05),说明洛伐他汀能够增加骨量且连接性较好。

Tab 6 Changes of drugs on TMD and Conn.D.of proximal tibial in CCl4 induced liver injury in mice(¯x±s,n=8)
2.5.3 Micro CT测定的小鼠胫骨SMI和DA值如Tab 7所示,模型组的结构模型指数(SMI)值明显高于对照组,增加了61.29%(P<0.05),说明小鼠的骨小梁结构形态由板状结构退变成杆状结构,呈现出骨质疏松症状。模型组的各向异性的程度(DA)低于对照组,降低了25.48%(P<0.05),也提示出现骨质疏松症状。秋水仙碱治疗组的DA值介于模型组与对照组之间,SMI数值接近于模型组,说明秋水仙碱对骨小梁的板状结构与杆状结构的调整无影响。洛伐他汀治疗组的DA值明显低于模型组(P<0.05),SMI接近于模型组,说明洛伐他汀对骨小梁的板状结构与杆状结构的调整亦无影响。

Tab 7 Changes of drugs on SMI and DA of proximal tibial in CCl4 induced liver injury in mice(¯x±s,n=8)
2.6 Micro CT对小鼠胫骨ROI区的三维重建图的分析 如Fig 1所示,通过扫描重建所得的三维图像观察到骨结构形态,以及骨小梁的数量变化情况,模型组出现了骨小梁断裂、变短的情况,而且在中央还出现了很大的间隙,这表明CCl4致肝损伤后能够诱导骨质疏松的产生。而洛伐他汀组、秋水仙碱组骨小梁的形态结构、紧密程度介于对照组与模型组之间,但洛伐他汀组的骨小梁较秋水仙碱的更为紧密,且间隙较小,表明洛伐他汀对于CCl4致肝损伤所引发的骨质疏松症状有更好的保护作用。
3 讨论
3.1 四氯化碳可诱导小鼠肝损伤并出现骨质疏松本实验用体积分数为40%的CCl4花生油对小鼠进行皮下注射,5 d 1次,连续1个月,从血清学指标以及肝匀浆的抗氧化指标检测结果来看,说明CCl4对肝细胞具有明显的破坏作用,故在本实验条件下,用CCl4染毒小鼠造成肝损伤的实验动物模型是成功的。CCl4是目前用于诱导肝损伤的经典物质,其机制是CCl4进入机体后,在肝内代谢生成三氯甲基和氯甲基自由基,从而启动脂质过氧化作用,进而破坏肝细胞的膜性结构。三氯甲基自由基还能抑制钙泵的活性,使胞内钙离子浓度升高,造成肝细胞受损[8]。

Fig 1 Three-dimensional reconstruction scheme of ROI area for mice tibial
与对照组相比,模型组的 BVF、Tb.N、TMD、Conn.D.、DA值明显降低,而Tb.Sp、SMI明显升高,说明骨小梁大量丢失,间隙增宽,骨密度降低,出现严重的结构退变,而且骨小梁结构形态由板状结构退变成杆状结构,表明CCl4致肝损伤后的小鼠出现骨质疏松症状。肝性骨病是临床常见的疾病,该病常常发生于原发性胆汁淤积性肝硬化、慢性活动性肝炎、酒精性肝硬化以及肝移植,引起骨密度减少、骨质疏松等骨代谢异常。由实验结果可知,用CCl4对小鼠造成肝损伤的实验动物模型造成了骨质疏松,其骨量的丢失可能与肝受损不能合成某些蛋白或是细胞因子有关。因为肝损伤不能代偿时,对体内许多激素、细胞因子、有毒物质等的代谢都有影响,从而影响到骨代谢。肝损伤时,单核细胞和血管内皮细胞过度分泌IL-1、IL-6、TNF-α等细胞因子,这些因子可共同促进破骨细胞形成,使骨吸收增强,影响骨重建,从而诱导骨丢失[9]。另外,肝功能异常引起维生素D、钙磷代谢异常,使骨形成减少,影响骨代谢[10]。陶坤明等[11]提出,由胆汁淤积导致的高胆红素血症损伤成骨细胞的增殖能力,亦会导致骨质疏松。也有研究报道[12],骨铜和骨镁增加,抑制成骨细胞和破骨细胞的功能,降低骨的转换率而导致骨质疏松。
3.2 秋水仙碱抗肝纤维化作用及对骨密度的影响本实验用CCl4造成小鼠肝损伤,给予秋水仙碱后虽能升高GSH-Px水平,但未能降低血清AST、ALT活性,从试验结果可以看出,本次实验秋水仙碱用药后对小鼠肝损伤没有明显的保护作用。关于秋水仙碱是否有抗肝纤维化作用一直存在着争议,多数研究报道秋水仙碱有抗肝纤维化的作用。但秋水仙碱与细胞中微管蛋白结合,阻止其聚合,亦可使微管解聚,从而抑制细胞的增殖、分化和物质运输传递,使肝细胞受损[4],因此,未能产生明显的抗肝纤维化作用。本实验周期为30 d,用CCl4造成小鼠肝损伤,实验结果未能看出秋水仙碱具有保肝作用,可能因为CCl4用量不足,不足以显示细胞毒作用;亦可能是由于试验周期短的缘故,本实验为应激反应,肝损伤处于前期,未恶化成为肝纤维化,而秋水仙碱未能发挥明显的保护作用。
本试验中,秋水仙碱治疗组的BVF值明显低于对照组,TMD值比模型组明显增加,说明秋水仙碱能增加骨量,但是连接性不好,这表明秋水仙碱对肝损伤后的骨量丢失无明显的保护作用,可能是因为实验中秋水仙碱未能降低转氨酶的活性,所以未能体现出其有抗骨丢失的作用。秋水仙碱的LD50较低,过量则会对骨髓和肝脏有损害。另有试验证明[4],秋水仙碱通过影响GSH系统和细胞巯基的稳态,使细胞对药物更为敏感。
3.3 洛伐他汀护肝作用及预防骨质疏松的作用本研究中,洛伐他汀虽能升高GSH-Px活性,但血清AST、ALT活性未发生改变,从实验结果来看,洛伐他汀用药后对肝损伤没有明显影响。他汀类药物有一定肝脏毒性,可引起肝酶升高,但小剂量洛伐他汀对肝脏是安全的[13]。洛伐他汀治疗组的TMD值与模型组相比差异有显著性,这说明洛伐他汀能够增加骨量且连接性较好,表明洛伐他汀对肝损伤导致的骨丢失有明显的保护作用。洛伐他汀对CCl4致肝损伤后骨量丢失的保护作用较秋水仙碱好,不仅洛伐他汀治疗组BVF、Conn.D.、TMD值更为接近对照组,而且Tb.N、Tb.Th值比秋水仙碱的大,Tb.Sp值比秋水仙碱的小,表明洛伐他汀能使骨小梁数量增加,骨小梁厚度增大,骨小梁分离度变小,抗骨丢失效果优于秋水仙碱。洛伐他汀能够增加骨密度,可能是因为有促骨形成作用和(或)抑制骨吸收作用。洛伐他汀是新型调节血脂及抗动脉粥样硬化药,有报道[5]发现他汀类药物可以增强骨形态发生蛋白的表达,具有成骨潜能。也有研究[14]发现,洛伐他汀可以抑制骨髓基质干细胞向脂肪细胞分化,而促进其向成骨细胞分化。亦有报道[15],他汀类药物通过抑制HMG-CoA还原酶活性等相关途径,诱导成骨细胞分化,促进成骨因子表达,促进骨质吸收来刺激骨形成,和(或)抑制骨吸收来增加骨密度。
综上所述,本实验通过小鼠皮下注射CCl4,成功建立肝损伤的动物模型,且骨丢失严重,出现明显的骨质疏松症状。对肝损伤后骨代谢的改变,通过Micro CT的结果分析,秋水仙碱组能增加骨量但是连接性不好,表明秋水仙碱对肝损伤后的骨量丢失无明显的保护作用。洛伐他汀BVF、TMD、Conn.D.值等表明洛伐他汀能增加骨量且连接性较好,对肝损伤导致的骨丢失有明显的保护作用。而且Tb.N、Tb.Th、Tb.Sp值显示洛伐他汀能使骨小梁数量增加,骨小梁厚度增大,骨小梁分离度变小,表明洛伐他汀对于CCl4造成肝损伤后的抗骨丢失的作用强于秋水仙碱。另外,本实验观察到洛伐他汀、秋水仙碱用药后,洛伐他汀及秋水仙碱对小鼠的保肝作用并不明显,可能由于小鼠皮下注射CCl4药物剂量不足,或是试验周期短等的原因所致,有待下一步进行探讨。
参考文献:
[1] Chen SR,Zou L Y,Li L,Wu T.The protective effect of glycyrrhetinic acid on carbon tetrachloride-induced chronic liver fibrosis in mice via upregulation of nrf2[J].PLoS One,2013,8(1):e53662.
[2] Li L,Li W,Kim Y H,Lee Y W.Chlorella vulgaris extract ameliorates carbon tetrachloride-induced acute hepatic injury in mice[J].Exp Toxicol Pathol,2013,65(1-2):73-80.
[3] 黄 英,杨颜茹.丙型肝炎后肝硬化与骨质疏松的临床研究[J].吉林医学,2012,33(23):4938-9.
[3] Huang Y,Yang Y R.Clinical study of hepatitis C cirrhosis and osteoporosis[J].Jilin Med J,2012,33(23):4938-9.
[4] 邱永祥,阮 明,贾凤兰,等.秋水仙碱对小鼠肝脏的损伤作用[J].毒理学杂志,2005,19(2):131-3.
[4] Qiu Y X,Yuan M,Jia F L,et al.The toxic effect of colchicine on the liver of mice[J].J Toxicol,2005,19(2):131-3.
[5] 曹国龙,王天兵.洛伐他汀对尾悬吊大鼠骨量及其骨髓基质干细胞增殖、分化的影响[J].中国组织工程研究,2012,16(36):6674-8.
[5] Cao G L,Wang T B.Effects of lovastatin on bone mass and the differentiation and proliferation of bone marrow stromal cells in tailsuspended rats[J].J Clin Rehab Tiss Eng Res,2012,16(36):6674-8.
[6] Follet H,Farlay D,Bala Y,et al.Determinants of microdamage in elderly human vertebral trabecular bone[J].PLoSOne,2013,8(2):e55232.
[7] 王 军,毕 龙,白建萍,等.显微CT与组织切片技术在骨形态计量研究中的比较[J].中国矫形外科杂志,2009,17(5):381-4.
[7] Wang J,Bi L,Bai JP,et al.Comparative study of micro-CT and histological section in bone morphometry[J].Orthoped J China,2009,17(5):381-4.
[8] 韩 泳,王 玉,崔燕芒,赵 燕.黄芩素对四氯化碳诱导小鼠急性肝损伤的保护作用[J].中国药理学通报,2013,29(6):883-4.
[8] Han Y,Wang Y,Cui Y M,Zhao Y.The hepatoprotective effects of Baicalein on CCl4-induced acute liver injury in mice[J].Chin Pharmacol Bull,2013,29(6):883-4.
[9] 杨颜茹,郭 强,段惠春.IL-6、TNT-α、1,25二羟维生素 D3以及骨密度测定在酒精性肝硬化骨质疏松中的临床应用价值[J].甘肃医药,2013,32(3):163-6.
[9] Yang Y R,Guo Q,Duan H C.The clinical value of interleukin-6,tumor necrosis factor-α,1,25 dihydroxyvitamin D3 determination in alcoholic cirrhosis osteoporosis[J].Gansu Med J,2013,32(3):163-6.
[10]王 翔,薛雁山.肝硬化性骨质疏松症及其CT评价研究[J].国际医学放射学杂志,2009,32(5):457-62.
[10]Wang X,Xue Y S.Osteoporosis in patients with liver cirrhosis:evaluation with computed tomography[J].Int JMed Radiol,2009,32(5):457-62.
[11]陶坤明,姚定康.原发性胆汁性肝硬化并发骨质疏松的研究进展[J].国际消化病杂志,2009,29(1):55-7.
[11]Tao K M,Yao D K.Progress in the study of osteoporosis in primary biliary cirrhosis[J].Int J Dig Dis,2009,29(1):55-7.
[12]邹丽宜,吴 铁.小鼠肝硬化导致骨丢失及人参茎叶皂苷的防治作用[J].药学学报,2001,36(12):886-90.
[12]Zou L Y,Wu T.Liver cirrhosis induced bone loss in mice and the effect of Ginsenosides[J].Acta Pharm Sin,2001,36(12):886-90.
[13]张淑花.小剂量洛伐他汀对肝脏影响研究[J].包头医学院学报,2008,24(2):144-5.
[13]Zhang SH.Study on the effect of a small dose of lovastatin on the liver[J].J Baotou Med Coll,2008,24(2):144-5.
[14]Li X,Cui Q,Kao C,et al.Lovastatin inhibits adipogenic and stimulates osteogenic differentiation by suppressing PPARγ2 and increasing Cbfa1/Runx2 expression in bone marrow mesenchymal cell cultures[J].Bone,2003,33(4):652-9.
[15]薛昊罡,冷 冰.辛伐他汀治疗骨质疏松的实验研究进展[J].中国老年学杂志,2010,30(24):3836-7.
[15]Xue H G,Leng B.Experimental research progress of simvastatin in the treatment of osteoporosis[J].Chin J Gerontol,2010,30(24):3836-7.

