醋酸铅对大鼠胰岛瘤细胞INS-1自噬与凋亡的影响
付荣,孙丽,王晓丽,胡士涛,季虹,荣海钦,*
1.济南大学山东省医学科学院医学与生命科学学院,济南250062
2.山东省内分泌与代谢病研究所山东省医学科学院,济南250062
近年来,糖尿病的患病率呈逐年上升的趋势,合理的防治糖尿病尤为重要。糖尿病是一种以血糖升高、胰岛素分泌不足和胰岛素抵抗为特征的代谢性疾病[1]。胰岛 β细胞的减少是其发生发展的核心[2-3]。胰岛β细胞的减少通常是由于细胞凋亡,导致胰岛β细胞凋亡的一个重要因素是细胞内的氧化压力[4-5]。此外,作为另一种细胞破坏的方式,自噬性细胞死亡也愈来愈为人们所关注[6]。
目前研究发现多种重金属可导致细胞的自噬与凋亡[7]。铅是一种有害重金属,由于其广泛使用已在世界很多地方造成了严重的环境污染和健康问题。铅可通过多种途径进入人体,并可对多个系统(包括神经、血液、消化、循环和泌尿系统等)造成伤害[8-9]。研究表明,铅能够改变细胞氧化还原状态,通过促进胰岛β细胞产生活性氧造成氧化压力,进一步导致胰岛β细胞凋亡[10]。但是铅能否引起胰岛细胞自噬,及引起自噬可能的分子机制尚未明确。本实验通过研究不同浓度的醋酸铅对胰岛β细胞INS-1自噬与凋亡的影响,探讨重金属污染物铅造成胰岛β细胞损伤可能的分子机制,为采取相应措施降低胰岛β细胞损伤从而为降低2型糖尿病的患病风险提供理论依据。
1 材料和方法(Materials and methods)
1.1 仪器与试剂
仪器:细胞培养箱(SANYO),酶标仪(BIO-RAD Model 680),电泳仪/转印电泳槽(BIO-RAD),荧光显微镜(Olympus BX51)。
试剂:RPMI-1640培养基(hyclone),胎牛血清(hyclone),醋酸铅(分析纯,天津市化学试剂一厂),磺酰罗丹明B(sulforhodamine B,SRB,Sigma),三氯乙酸(trichloroacetic acid,TCA,Bio Basic),磷酸甘油醛脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(CW 0100,北京康为世纪公司),微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)抗体(CST 2775),聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)抗体(CST 9542),70 kDa磷酸化 S6激酶(phosphorylated 70 kDa S6 kinase,p70 S6)抗体(CST 9202),磷酸化的 p70 S6(p-p70 S6)抗体(CST 9205),HRP-山羊抗兔二抗、HRP-山羊抗小鼠二抗(碧云天),超敏发光液ECL试剂盒、活性氧检测试剂盒(北京普利莱技术有限公司)。
1.2 实验材料
细胞系:大鼠胰岛瘤细胞系(INS-1)购自武汉大学中国典型培养物保藏中心(CCTCC)。将大鼠胰岛瘤细胞INS-1培养于含10%的新生胎牛血清、1%青链霉素、50 mmoly·L-1β-巯基乙醇的 RPMI-1640培养基中,37℃,5%CO2培养箱中常规培养,待细胞长至满度约80%时,用0.25%胰酶进行消化传代。
1.3 SRB法检测细胞存活率
将 INS-1细胞以1.5×105个·mL-1接种于96孔板,每组设6个重复孔。培养24 h后分组暴露,设立醋酸铅组(醋酸铅浓度分别为 0.1、1 和 10 μmol·L-1)与正常对照组(加等量培养基),暴露24和48 h后,吸去培养基,SRB法染色,以检测波长515 nm测定各孔吸光度(optical density,OD)并计算各组细胞相对存活率(相对存活率=药物处理组OD值/对照组OD值 ×100%)。
1.4 Western blot法检测自噬与凋亡标志蛋白的表达
将 INS-1细胞以1.5×106个·mL-1接种于10 cm培养皿,培养24 h后分组暴露,设立醋酸铅组(醋酸铅浓度分别为 0.1、1 和 10 μmol·L-1)与正常对照组(加等量培养基),暴露24和48 h后,提取细胞蛋白,Bradford法测每组蛋白浓度。加上样缓冲液,制备成蛋白样品,进行Western blot实验,检测各组细胞自噬标志蛋白LC3-II、凋亡标志蛋白PARP的剪切带(89 kDa)及mTOR信号途径标志分子p-p70 S6K表达情况,以GAPDH作为内参。
1.5 活性氧检测试剂盒检测细胞内ROS水平
将INS-1细胞以1.5×106个·mL-1接种于3.5 cm培养皿中,培养24 h后,设立醋酸铅组(醋酸铅浓度分别为 0.1、1 和 10 μmol·L-1)与正常对照组(加等量培养基),暴露48 h后,加入检测探针2',7'-二氯荧光素二乙酸盐(2',7'-dichlorofluorescin diacetate,DCFHDA),探针浓度用培养基稀释至 10 μmol·L-1,置于培养箱(37℃,5%CO2)中负载探针1 h;10%PBS洗皿3次,使用倒置荧光显微镜以激发波长488 nm,发射波长525 nm检测各组荧光强度并拍照。
1.6 NAC预处理细胞,检测细胞自噬与凋亡是否受到抑制
将实验细胞分为对照组、NAC组、NAC+醋酸铅组和醋酸铅组,对照组药物剂量为0,NAC组为只加入400 μmol·L-1的NAC,NAC+醋酸铅组为先加入400 μmol·L-1的 NAC,1 h 后再加入 10 μmol·L-1醋酸铅,醋酸铅组为只加入10 μmol·L-1醋酸铅。暴露48 h后,SRB法检测细胞存活率,利用活性氧检测试剂盒检测细胞内ROS,Western blot法检测LC3-II与PARP的剪切带(89 kDa)水平的变化,以GAPDH作为内参。
1.7 数据统计
采用统计软件SPSS 17.0对相关数据进行分析,组间比较采用单因素方差分析(One-Way ANOVA)和t检验,以p<0.05作为差异有统计学意义的标准(在以下各图表中,*表示:与对照组相比,p<0.05)。
2 结果(Results)
2.1 醋酸铅对INS-1细胞存活率的影响
与对照组100%细胞存活率相比,醋酸铅暴露24 h 后,1 和 10 μmol·L-1醋酸铅组的细胞存活率明显降低(p <0.05),48 h 后 0.1、1 和 10 μmol·L-1组的细胞存活率均明显降低(如图1)。
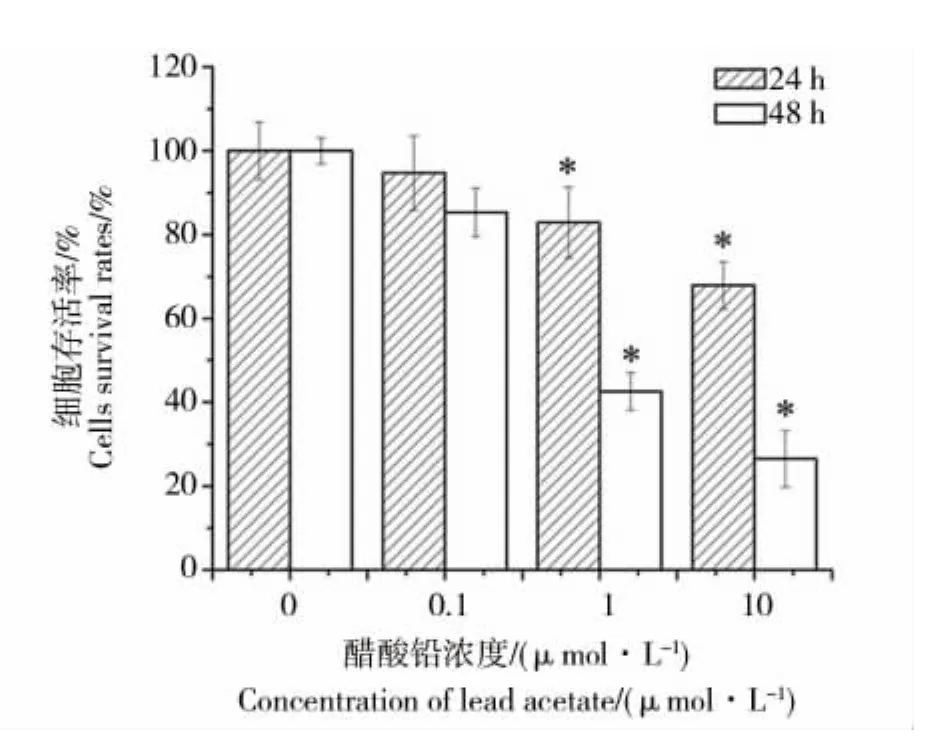
图1 不同浓度醋酸铅对INS-1细胞存活率的影响 (*p<0.05)Fig.1 The effect of lead acetate on survival rates in INS-1 cells(*p<0.05)
2.2 醋酸铅对INS-1细胞LC3-II、PARP的切割带(89 kDa)及p-p70 S6K表达的影响
与对照组相比,1 和 10 μmol·L-1醋酸铅暴露组自噬标志蛋白LC3-II及凋亡标志蛋白PARP的剪切带表达均有所增加,且增加呈时间-剂量依赖性(如图2)。而mTOR信号途径标志分子p-p70 S6K表达却无明显变化(如图3)。
2.3 醋酸铅暴露后INS-1细胞内活性氧(ROS)水平
与对照组相比,以 0.1、1 和 10 μmol·L-1醋酸铅暴露INS-1细胞48 h后,INS-1细胞内有活性氧产生,且呈剂量依赖性(如图4)。
2.4 NAC处理后INS-1细胞自噬和凋亡情况
与对照组相比,NAC+醋酸铅组和醋酸铅组OD值均减低,差异具有统计学意义(各组OD值分别为0.831±0.047、0.811±0.058、0.543±0.056和 0.287±0.028,p<0.05),NAC+醋酸铅组存活率明显高于醋酸铅组(p <0.05)(如图 5),细胞内 ROS 减少(如图 6),且LC3-II和 89 kDa的 PARP剪切带表达均减少(如图 7)。
3 讨论(Discussion)

图2 醋酸铅对INS-1细胞LC3-Ⅱ和PARP的剪切产物表达的影响Fig.2 Effects of lead acetate on LC3-Ⅱand cleaved PARP in INS-1 cells

图3 醋酸铅对INS-1细胞p-p70 S6K表达的影响Fig.3 Effects of lead acetate on p-p70 S6K in INS-1 cells

图4 醋酸铅对 INS-1 细胞内 ROS 水平的影响(A:对照、B:0.1 μmol·L-1、C:1 μmol·L-1、D:10 μmol·L-1)(×100)Fig.4 Effects of lead acetate on intracellular ROS in INS-1 cells(A:control,B:0.1 μmo·lL-1,C:1 μmo·lL-1,D:10 μmo·lL-1)(×100)

图5 NAC对醋酸铅暴露的INS-1细胞存活率的影响(*p<0.05)Fig.5 Effects of NAC on survival rates in lead acetate exposed INS-1 cells(*p<0.05)

图6 NAC对醋酸铅暴露的INS-1细胞内ROS的影响(A:对照、B:NAC、C:NAC+醋酸铅、D:醋酸铅)(×100)Fig.6 Effects of NAC on intracellular ROS in lead acetate exposed INS-1 cells(A:control;B:NAC;C:NAC+lead acetate;D:lead acetate)(×100)

图7 NAC对醋酸铅暴露的INS-1细胞LC3-Ⅱ和PARP的剪切产物表达的影响Fig.7 Effects of NAC on LC3-Ⅱand cleaved PARP in lead acetate exposed INS-1 cells
胰岛素是人体内最主要的降糖激素,所以胰岛β细胞作为人体内产生胰岛素的细胞在糖尿病的发生发展中起着重要作用。减少胰岛β细胞的破坏,维持胰岛β细胞的功能对于糖尿病的防治具有重要意义。胰岛β细胞的减少是由多种原因引起的细胞死亡,细胞死亡主要包括3种类型:细胞坏死、细胞凋亡和自噬性细胞死亡[11]。正常状态下,自噬性细胞死亡是细胞通过产生自噬体以“自身消化”的方式来调控细胞内衰老蛋白的循环,清除受损的细胞器,保护饥饿状态下的细胞,所以自噬对于维持细胞稳态具有重要作用。然而,自噬也可引起细胞通过非细胞凋亡方式死亡,自噬异常还可导致某些疾病的发生,如癌症、神经变性性疾病、肝性脑病等,目前一些研究还发现了其对糖尿病具有潜在作用[12]。本实验利用不同浓度的醋酸铅暴露胰岛β细胞INS-1,来观察重金属铅对胰岛β细胞自噬与凋亡的作用。
3.1 醋酸铅对INS-1细胞存活率的影响
在本实验中,SRB实验结果显示,与对照组相比,0.1 μmol·L-1醋酸铅暴露组的细胞存活率在处理时间为24 h时与对照组没有明显差异,考虑可能与0.1 μmol·L-1醋酸铅浓度较低或24 h作用时间较短,不足以诱导细胞的自噬和凋亡,引起细胞存活率的降低;也可能与醋酸铅既诱导了细胞保护性的自噬,又诱导了细胞的凋亡有关。细胞存活率为两者共同作用的结果,而0.1 μmol·L-1醋酸铅组暴露细胞24 h时两者作用相抵,表现为细胞存活率与对照组没有明显差异,但自噬在何种条件下可保护细胞免于发生凋亡,何种条件下可促使细胞向凋亡转化,从而促进细胞的死亡,还需进一步的实验证实。
3.2 醋酸铅对INS-1细胞自噬与凋亡的影响
为了观察细胞是否发生了自噬和凋亡,本实验分别选用了自噬和凋亡的标志蛋白 LC3-Ⅱ和PARP,通过Western blot法检测其表达情况。细胞中LC3-Ⅱ的表达情况与细胞中自噬体的数量直接相关,故可反应自噬的活性[13]。作为细胞凋亡的标志分子,PARP与DNA末端结合而被激活,随后被剪切为包含89 kDa的片段,该剪切带可防止细胞内能量的耗尽,并参与细胞凋亡的后续阶段[14]。自噬的分子途径可根据mTOR分子是否参与分为两种:mTOR-依赖途径和mTOR-非依赖途径。mTOR为自噬调节的核心因子,被激活后可使其底物p70 S6K磷酸化为p-p70 S6K[15]。故根据p-p70 S6K表达情况可推测醋酸铅诱导的INS-1细胞自噬的可能途径。本实验中,随着作用时间和醋酸铅浓度的增加,LC3-II及PARP的剪切带表达均有所增加,说明醋酸铅可诱导INS-1细胞的自噬和凋亡,且自噬和凋亡水平的增加呈时间-剂量依赖性。但是p-p70 S6K的表达没有明显差异,推测醋酸铅诱导的细胞自噬可能是通过mTOR-非依赖途径。
3.3 醋酸铅诱导INS-1细胞自噬与凋亡的可能机制
铅作为一种应用广泛的重金属,其毒性及机制也早已被人们熟知,Willis[16]在1965年首先报道了铅可诱导氧化应激,后来许多研究也证实了这一结论[17-18]。铅能够改变细胞的氧化还原状态,通过促进胰岛β细胞产生活性氧造成氧化压力,导致胰岛β细胞的凋亡。本实验中也观察到醋酸铅暴露的INS-1细胞内有活性氧产生,且呈剂量依赖性。NAC是一种广谱型抗氧化剂,通过促进谷胱甘肽(GSH)的合成来维持细胞GSH水平,清除自由基。因其对细胞毒性小,副作用少,因此被用来缓解各种条件导致的氧化应激[19]。本试验中NAC+醋酸铅组细胞存活率明显高于醋酸铅组,NAC+醋酸铅组与醋酸铅组相比LC3-II和89 kDa的PARP切割带表达均明显减少,即ROS的清除减少了醋酸铅诱导的细胞自噬和凋亡。其原因可能是NAC通过增加GSH合成和增强谷胱甘肽过氧化酶(GSH-Px)活性来减轻醋酸铅引起的氧化损伤,这说明ROS参与醋酸铅诱导的INS-1细胞自噬和凋亡。
综上所述,我们认为醋酸铅可能是通过刺激细胞内ROS的产生而诱导INS-1细胞自噬与凋亡,醋酸铅诱导的INS-1细胞自噬可能是通过mTOR-非依赖途径。本课题利用胰岛瘤细胞作为模式细胞研究铅对胰岛细胞自噬和凋亡的影响,瘤细胞与正常细胞生长特点和功能可能有所差异,因此,醋酸铅对肿瘤细胞与对正常细胞自噬和凋亡过程的影响可能有区别。醋酸铅诱导自噬具体的分子通路、自噬与凋亡之间的关系等问题也尚不明确,还需要进一步的实验进行研究,为下一步采取相应措施降低胰岛β细胞损伤从而降低2型糖尿病的患病风险提供更加可靠的依据。
致谢:感谢中国科学院生态环境研究中心章大鹏老师的帮助与支持。
[1]Lorenzo C,Rewers M J,Wagenknecht L E,et al.Insulin resistance,β-cell dysfunction,and conversion to type 2 diabetes in a multiethnic population,the insulin resistance atherosclerosis study[J].Diabetes Care,2010,33(1):67-72
[2]Defronzo R A,Abdul-Ghani M A.Preservation of β-cell function:The key to diabetes prevention[J].Journal of Clinical Endocrinology&Metabolism,2011,96(8):2354-2366
[3]Kahn S E.Clinical review 135:The importance of β-cell failure in the development and progression of type 2 diabetes[J].Journal of Clinical Endocrinology&Metabolism,2001,86(9):4047-4058
[4]Henriksen Erik J,Diamond-Stanic Maggie K,Marchionne Elizabeth M.Oxidative stress and the etiology of insulin resistance and type 2 diabetes[J].Free Radical Biology&Medicine,2011,51(5):993-999
[5]Robertson R P,Harmon J S.Diabetes,glucose toxicity,and oxidative stress:A case of double jeopardy for the pancreatic islet β cell[J].Free Radical Biology&Medicine,2006,41(2):177-184
[6]Marchetti P,Masini M.Autophagy and the pancreatic beta-cell in human type 2 diabetes[J].Autophagy,2009,5(7):1055-1056
[7]Chen YW,Ching YY,Chun F H,et al.Heavy metals,islet function and diabetes development[J].Islets,2009,1(3):169-176
[8]Flora G,Gupta D,Tiwari A.Toxicity of lead:A review with recent updates[J].Interdisciplinary Toxicology,2012,5(2):47-58
[9]Gillis B S,Arbieva Z,Gavin L M.Analysis of lead toxicity in human cells[J].BMC Genomics,2012,13:344
[10]Afridi H I,Kazi T G,Kazi N,et al.Evaluation of status of toxic metals in biological samples of diabetes mellitus patients[J].Diabetes Research and Clinical Practice,2008,80(2):280-288
[11]Lockshin R A,Zakeri Z.Apoptosis,autophagy,and more[J].International Journal of Biochemistry&Cell Biology,2004,36(12):2405-2419
[12]Masini M,Lupi R,Bugliani M,et al.A role for autophagy in beta cell life and death[J].Islets,2009,1(2):157-159
[13]Kuma A,Matsui M,Mizushima M.LC3,an autophagosome marker,can be incorporated into protein aggregates independent of autophagy:Caution in the interpretation of LC3 localization[J].Autophagy,2007,3(4):323-328
[14]Boulares A H,Yakovlev A G,Ivanova V,et al.Role of poly(ADP ribose)polymerase(PARP)cleavage in apoptosis:Caspase 3 resistant PARP mutant increases rates of apoptosis in transfected cells[J].Journal of Biological Chemistry,1999,274(33):22932-22940
[15]Jung C H,Ro S H,Cao J,et al.mTOR regulation of autophagy[J].Federation of European Biochemical Societies Letters,2010,584(7):1287-1295
[16]Wills E D.Mechanisms of lipid peroxide formation in tissues.Role of metals and haematin proteins in the catalysis of the oxidation unsaturated fatty acids[J].Biochimica et Biophysica Acta,1965,98:238-251
[17]Rehman U S.Lead induced regional lipid peroxidation in brain[J].Toxicology Letters,1984,21(3):333-337
[18]Somashekaraiah B V,Padmaja K,Prasad A R.Effect of lead on lipid peroxidation of the hepatic subcellular organelles of developing chick embryos[J].Biochemistry International,1992,27(5):803-809
[19]Gurer H,Ercal N.Can antioxidants be beneficial in the treatment of lead poisoning[J].Free Radical Biology&Medicine,2000,29(10):927-945

