双酚A对斑马鱼精巢性激素生成酶基因表达的影响
云丹,刘晓丽,程乐华,周忠良
华东师范大学生命科学学院,上海200241
4-二羟基二苯基丙烷,简称双酚 A(bisphenol A,BPA),系苯酚衍生物,广泛用于如聚碳酸脂(polycarbonate,PC)、环氧树脂(epoxideresin,EP)等化工产品的制造。研究发现BPA不仅通过与肝脏雌激素受体结合诱导雄鱼产生卵黄蛋白原[1-2],也干扰鱼类性激素调节并影响鱼类的性别分化[3-4],是典型的拟雌激素化学物。BPA对精巢发育的影响也有大量的报道,BPA能导致精子数量减少、活力降低、畸形率增加而损害雄性生殖功能[5-6],损伤生精细胞、支持细胞和间质细胞的结构和功能,干扰和阻碍精子的发育和成熟及对精子有直接毒性[7]。然而,BPA对精巢发育影响的检测仍停留在组织病理层面,且关于BPA调节精巢发育的分子机制以及精巢结构与分子机制相结合的研究不多,BPA对精巢结构影响的机理还不是很清楚。
鱼类与所有其他脊椎动物一样,其性腺发育过程受性激素的调节和控制。在性激素的合成途径中,细胞色素 P450酶起着重要的作用。其中,CYP17基因参与精巢中胆固醇转化为睾酮的过程[8];CYP11B基因能催化雄鱼精巢中的睾酮转化为11-KT;CYP19A基因编码的细胞色素P450芳香化酶(CYP19A)控制雄激素转换为雌激素的过程。性腺的活动是受下丘脑和垂体分泌激素的控制,下丘脑释放的促性腺激素释放激素(GnRHs),作用于垂体上的受体,从而控制促性腺激素的合成和释放,包括黄体化激素(luteinizing hormone,LH)和促卵泡激素(follicle stimulating hormone,FSH)[9]。在雄性动物中,FSH可以通过促卵泡激素受体(FSHR)的介导来刺激精子的发生并促进雄激素的合成[10-13]。研究发现,环境拟雌激素化学物壬基酚(NP)可影响斑马鱼精巢性激素合成酶基因的表达。BPA也是拟雌激素化学物,但分子结构区别于NP。BPA对精巢发育的作用途径至今不很清楚。本文以模式动物斑马鱼(Danio rerio)为实验对象,通过不同浓度BPA暴露以及同一浓度不同暴露时间的动力学实验,以成鱼精巢性激素合成酶基因(相关P450酶基因)及雌雄激素受体基因、促卵泡激素受体基因为靶点,结合精巢组织病理学特征,研究BPA对性激素合成酶基因表达的影响,并深入研究环境内分泌干扰物对精子发育和精巢结构影响的作用途径。
1 材料与方法(Materials and Methods)
1.1 仪器与试剂
仪器:电动匀浆器(Fluko公司),PCR仪和CEX96TMReal-Time PCR 仪(Bio-Rad),UV-VIS7500紫外分光光度计(天美公司),荧光显微镜(Leica,DM4000B)。
试剂:双酚 A(纯度 >99%,Fluka),RNAiso Plus试剂(TaKaRa),Prime Script RT Master Mix Perfect Real Time试剂盒和SYBR Premix Ex TaqTM试剂盒(TaKaRa)。
1.2 实验材料
实验鱼:斑马鱼(Danio rerio),体长(2.83±0.16)cm,体重(0.40±0.05)g,为性成熟雄性个体,购于上海银河热带鱼养殖场,在实验室驯养两周后进行暴露实验,驯养鱼用水为曝气除氯后的自来水。
1.3 实验设计
浓度-效应实验:设置4个BPA试验浓度组,分别为500、1 000、2 000 和4 000 μg·L-1;每个浓度组设两平行,丙酮作为溶剂,试剂对照组丙酮浓度为10 μL·L-1;暴露试验在5 L的玻璃缸中进行,放试液3 L,随机放入试验鱼8尾;试验期间每天喂食3次,换1/3试液,持续增氧,水体温度控制在(28±1)℃,光照周期为14 h:10 h(光暗比),暴露期为21 d。取样时将斑马鱼置于冰面上,冻僵后取精巢,过液氮,-80℃冰箱保存待用;精巢组织学研究以Bouin液固定。
时间-效应实验:在浓度-效应实验的基础上,选取 BPA2000 μg·L-1浓度组进行时间-效应实验,暴露期间的实验方法与浓度-效应实验相同。分别在暴露后第6天、12天、18天、21天进行取样,样本处理同浓度-效应实验。
1.4 实验步骤
1.4.1 斑马鱼精巢中相关基因Real-time PCR测定
取50 mg精巢组织加入1 mL RNAiso Plus提取出总RNA,分光光度仪测出RNA浓度(A260/A280在1.8~2.0范围内),UVP凝胶图像分析仪上观察RNA完整性及有无降解情况。之后用Prime Script RT Master Mix Perfect Real Time试剂盒将总RNA反转录为cDNA:根据每20 μL反应体系可最大使用1000 ng RNA,计算出加入RNA的体积,加入5×Prime Script RT Master Mix 4 μL,再加入 RNase Free H2O补足至20 μL,混匀后,放入PCR仪,37℃保持15 min,85℃作用5 s。从Genebank获得斑马鱼ERβ、FSHR mRNA序列,应用Primer 5.0软件设计分析得到特异性引物(上海英潍捷基贸易有限公司合成),其他引物引用自文献,具体见表1。Real-time PCR反应体系包括SYBR Premix Ex TaqTM 12.5μL,正向引物和反向引物各 0.5 μL(10 μmol·L-1),样品 cDNA模板 1 μL,加入 RNase Free H2O 补足至 25 μL。扩增条件为:95℃预变性30 s;95℃ 5 s,60℃ 30 s,40次循环;65℃ 5 s至95℃,在最后1个循环结束后做溶解曲线验证引物特异性。实验数据用2-ΔΔCt方法分析,以β-actin为内标基因,空白对照组为参照因子进行计算。
1.4.2 精巢组织石蜡切片
精巢组织学研究采用常规石蜡切片:样品用Bouin氏液固定24 h,各级乙醇冲洗,脱水,经二甲苯透明,浸蜡包埋(温度不超过58℃),制成5 μm切片,展片,用2%的明胶涂抹的载玻片捞片,30℃恒温箱烤片过夜,脱蜡复水,H.E.染色,脱水,中性树胶封片后在显微镜下观察并拍照。

表1 引物的序列、序列号和来源Table 1 Sequence of the primers,accession number of primers and references of the primers
1.4.3 数据统计分析
数据采用SPSS16.0软件进行统计分析。用单因素ANOVA法分析暴露引起的差异,若差异显著则用Tukey法比较不同暴露组之间的差异(p<0.05时即被认为差异显著),实验数据采用平均值±标准差表示。
2 结果(Results)
2.1 PA暴露对成年斑马鱼精巢CYP17、CYP11B和CYP19A基因表达的影响
图1所示的是不同浓度BPA暴露21d后斑马鱼精巢性类固醇合成相关细胞色素P450酶类的基因表达量。从图1a中可以看出,CYP17 mRNA的表达量与BPA的浓度存在一定的负相关性,随着BPA浓度的增加,CYP17mRNA的表达量下降,分别为对照组的(0.84±0.25)、(0.40±0.15)、(0.32±0.16)和(0.01±0.01)倍。与对照相比,BPA浓度大于1 000 μg·L-1的各实验组,差异显著(p <0.01)。CYP11B mRNA 的表达量,除 4 000 μg·L-1外,其余各实验组虽有变化,但与对照组无显著性差异(图1b)。4 000 μg·L-1组的 CYP11B mRNA 的平均表达量为对照组的(5.50±2.19)倍,可能是组内个体差异较大,统计处理未能显示差异。BPA可诱导CYP19AmRNA的表达量上调,其中BPA浓度为2 000 μg·L-1时 CYP19AmRNA 的表达量最高,为对照组的(2.68 ±0.72)倍(p <0.05),在 4 000 μg·L-1有所下降,但仍高于对照(图1c)。
图2 所示为暴露在 BPA 2 000 μg·L-1时,不同时间下斑马鱼精巢性类固醇合成相关细胞色素P450酶类的表达量。从图2a可以看到,在BPA作用下,CYP17 mRNA的表达是有波动的,在6 d时最低,为对照组的(0.11±0.01)倍,12 d时平均表达量有所回升,但始终低于对照组(p<0.01)。CYP11B mRNA的平均表达量则有一个先降后上升的调节过程。12 d时显著下调,为对照组的(0.54±0.05)倍(p<0.01);18 d时回升到对照水平;21 d时略高于对照,差异均不显著(图 2b)。BPA 2 000 μg·L-1诱导精巢CYP19A mRNA的表达有时间效应,暴露18 d的样本中,部分个体出现上调,21 d时,大部分个体上调显著,平均值为对照组的(2.77±0.50)倍,差异显著(p<0.01)。

图1 BPA暴露对斑马鱼精巢性激素合成相关酶基因表达的影响(a.CYP17 mRNA的表达,b.CYP11B mRNA的表达,c.CYP19A mRNA的表达,*p<0.05,**p<0.01,n=6)Fig.1 Effects of BPA on the expression of steroidogenic genes in testis of zebrafish(a.expression of CYP17 mRNA,b.expression of CYP11B mRNA,c.expression of CYP19A mRNA,*p<0.05,**p<0.01,n=6)

图2 不同暴露时间下BPA对斑马鱼精巢性激素合成相关酶基因表达的影响(a.CYP17 mRNA的表达,b.CYP11B mRNA的表达,c.CYP19A mRNA的表达,*p<0.05,**p<0.01,n=6)Fig.2 Effects of BPA on the expression of steroidogenic genes in testis of zebrafish under different exposure times(a.expression of CYP17 mRNA,b.expression of CYP11B mRNA,c.expression of CYP19A mRNA,*p<0.05,**p<0.01,n=6)
2.2 BPA暴露对成年斑马鱼精巢性激素受体及促卵泡激素受体基因表达的影响
图3显示了暴露于不同浓度BPA21 d后斑马鱼精巢内雌激素受体(ERα和ERβ)、雄激素受体(AR)和促卵泡激素受体(FSHR)mRNA的相对表达量。从图中可看到,BPA 浓度大于 2 000 μg·L-1时,精巢ERα的表达量明显上调,与对照组相比有显著性差异(p<0.05),对ERβ也有影响,但上调的量少于ERα(图 3a,b)。BPA 浓度大于 1 000 μg·L-1个试验组样品,精巢AR mRNA的表达略有上调(图3c),但与对照组差异不显著。BPA对精巢FSHR mRNA表达影响的浓度-效应曲线呈倒“U”字型(图3d)。500 μg·L-1组FSHR mRNA表达量显著大于对照(p<0.05);1 000 μg·L-1组最高,为对照组的(6.31 ±1.13)倍;而 2 000 μg·L-1组的表达量虽明显大于对照,但低于 1 000 μg·L-1组。浓度 4 000 μg·L-1组中部分个体的表达量低于对照,其平均表达量与对照无差异。
图4 所示为暴露在 BPA2 000 μg·L-1时,不同时间下斑马鱼精巢内的ERα mRNA、ERβ mRNA、AR mRNA和FSHR mRNA的表达量。如图4a、4b,BPA的暴露时间对ERα mRNA和ERβ mRNA的表达产生了明显的累积效应,随着暴露时间的增加,ERα mRNA和ERβ mRNA的表达量逐渐升高,在18 d时分别为对照组的(1.98±0.87)、(1.32±0.27)倍(p<0.05),在21d时分别为(4.36±2.12)倍(p<0.05)和(2.02±0.47)倍(p<0.01)。从图4c可以看出,AR mRNA的表达量与对照组没有差异性.图4 d显示,FSHR mRNA的表达量随着暴露时间的延长而增加,在暴露21 d时,与对照组差异显著,为对照组的(2.8±0.81)倍(p<0.05)。
2.3 BPA暴露对成年斑马鱼精巢组织结构的影响
图5a所示为正常精巢生精小管的结构,在组织切片中可以看到精子(Sp)均匀的分布于管腔中央,紧贴同一生精小管管壁排列紧密的是多个精小囊,每个精小囊中内有处于精原细胞(Sg)、初级精母细胞(PS)、次级精母细胞(SS)、精细胞(St)等不同发育时期的生殖细胞。图5b、5c所示为暴露于BPA引起的斑马鱼精巢组织学变化。图5b显示,暴露于2 000 μg·L-1BPA 引起斑马鱼精巢生精小管内非细胞区域增加,精子浓缩严重,精原细胞(Sg)和精母细胞(PS 和 SS)数目都有所减少;BPA 4 000 μg·L-1组斑马鱼精巢退化(图5c),精小囊破裂,各个时期的细胞散乱分布在精小管中。

图3 BPA暴露对斑马鱼精巢性激素受体基因表达的影响(a.ERα mRNA的表达,b.ER mRNA的表达,c.AR mRNA的表达*p<0.05,n=6)Fig.3 Effects of BPA on the expression of AR mRNA and ERα mRNA in testis of zebrafish(a.expression of ERα mRNA,b.expression of ERβ mRNA,c.expression of AR mRNA*p<0.05,n=6)

图4 不同暴露时间下BPA对斑马鱼精巢性激素受体基因表达的影响(a.ERα mRNA的表达,b.ERβ mRNA的表达,c.AR mRNA的表达*p<0.05,n=6)Fig.4 Effects of BPA on the expression of AR mRNA and ERα mRNA in testis of zebrafish under different exposure times(a.expression of ERα mRNA,b.expression of ERβ mRNA,c.expression of AR mRNA*p<0.05,n=6)
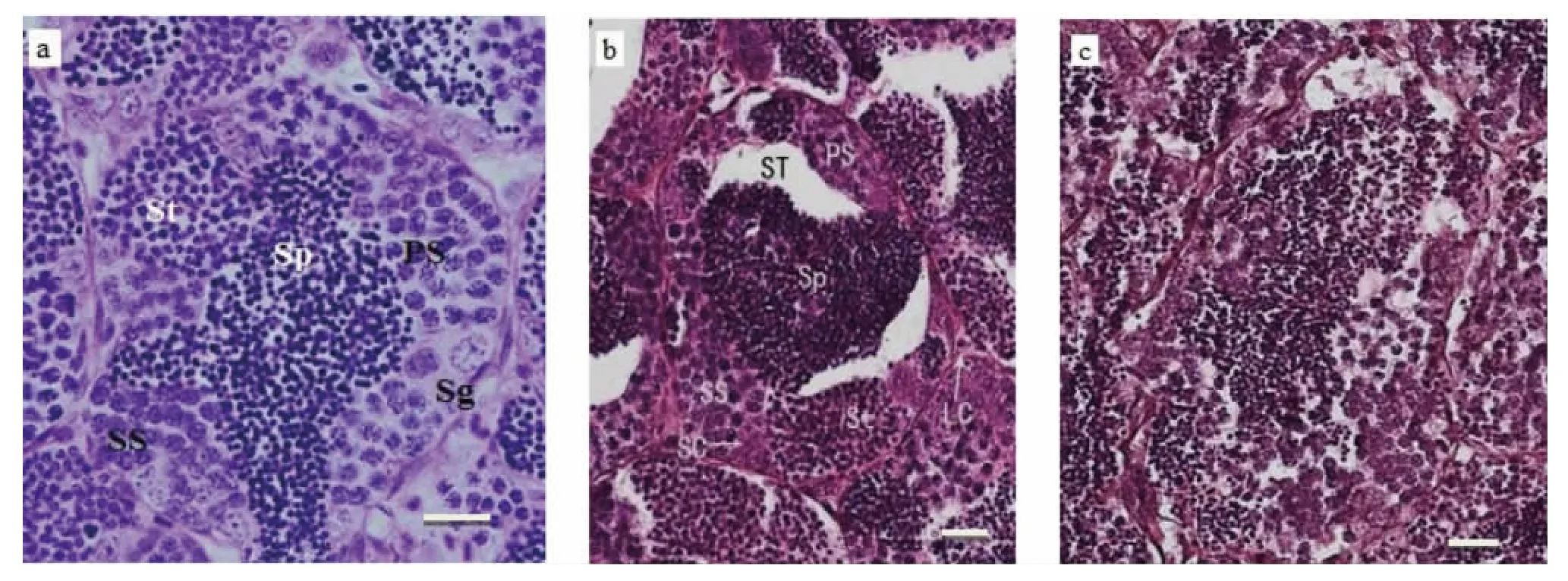
图5 暴露于BPA对斑马鱼精巢结构的影响(a. 对照;b.2 000 μg·L-1;c.4 000 μg·L-1;Sg 精原细胞;PS 初级精母细胞;SS次级精母细胞;St精细胞;Sp精子;SC支持细胞;LC间质细胞;ST生精小管;标尺=10μm)Fig.5 The effects of BPA on the testis of zebrafish(a.Control;b.2 000 μg·L-1;c.4 000 μg·L-1;Sg Spermatogonium;PS Primary Spermatocyte;SS Secondary Spermatocyte;St Spermatids;Sp Spermatozoa;SC Sertoli Cells;LC Leydig Cells;ST Seminiferous Tubules;Scale bar=10μm)
3 讨论(Discussion)
鱼类性腺发育受到下丘脑-垂体-性腺(HPG)信息通路的调节和控制,激素及其受体在信息传递中起重要作用,也成为环境内分泌干扰物(EDCs)作用的主要靶点[17]。细胞色素P450系列酶参与了类固醇激素的合成过程。其中,由CYP17基因编码的细胞色素 P450 17α-羟化酶(17α-hydroxylase)、17,20-裂解酶(17,20-lyase)能参与精巢中胆固醇转化为睾酮的过程,控制着精巢中性激素合成的总量[8];CYP11B基因编码的P45011β-羟化酶(P45011β)能催化雄鱼精巢中的睾酮转化为11-酮基睾酮(11-KT);P450芳香化酶(P450arom)是调控脊椎动物体内雌激素形成的关键酶,鱼类CYP19A基因编码性腺中的P450arom,主要分布于卵巢[18],在精巢间质细胞中有少量表达,调控原始精原细胞的增殖[13]。
小鼠研究表明,E2可干扰精巢CYP17 mRNA的表达,抑制睾酮的合成[19]。在鱼类中也存在类似结果,暴露于 E2和 EE2可导致雄性黑头呆鱼(Pimephalespromelas)CYP17mRNA表达下调[20-21],暴露于 250 μg·L-1壬基酚(NP)的斑马鱼精巢CYP17 mRNA表达显著下调[14]。本研究结果显示,暴露于 1 000 μg·L-1BPA 也可使斑马鱼精巢CYP17 mRNA表达显著下调,且具有显著的剂量-效应关系。可以推断,BPA抑制斑马鱼精巢CYP17基因表达是一种拟雌激素效应。BPA对斑马鱼精巢的拟雌激素效应还体现在对编码雌激素受体ER基因,ERα mRNA和ERβ mRNA表达的诱导。本研究结果显示,BPA 浓度为 2 000 μg·L-1时,斑马鱼精巢ERα mRNA和ERβ mRNA的表达量显著上调,且存在着明显的时间累积效应。这种现象与 E2[22]及NP[14]暴露结果是相似的。
11-KT是鱼类以及其他脊椎动物维持雄性功能的关键激素,调节精原细胞的减数分裂[23-24],以及精子形成等关键步骤[13]。自然条件下随着精巢的发育、精子的形成直到排精,血浆11-KT的含量逐步升高[23,25]。有报道称,青鳉(Oryzias latipes)、斑马鱼精巢中CYP11B mRNA表达可被外源拟雌激素化合物戊基酚(PP)、NP 抑制[14,26],并呈现浓度-效应关系。本实验结果显示,BPA暴露21 d时,斑马鱼精巢CYP11B mRNA的表达不仅没有被抑制,而最高浓度组(4 000 μg·L-1)的表达显著上调(图 1b);时间效应结果显示,暴露在 BPA 2 000 μg·L-1,斑马鱼精巢CYP11B mRNA呈现先抑后升的变化,在12d时该基因表达显著下调,随后逐步回升,21 d时则高于对照(图2b)。由此可见,虽然 NP、PP和BPA都是公认的环境拟雌激素化合物,但是在对鱼类精巢的作用可能存在不同的途径。BPA不直接干扰睾酮转化成11-KT的过程。
外源内分泌干扰物对鱼类CYP19A影响的研究多集中于卵巢,对精巢CYP19A影响报道较少。刘晓丽等[14]报告NP对斑马鱼精巢中CYP19A mRNA影响,125 μg·L-1NP 可使其表达上调。Hatef等[2]报告BPA暴露可使金鱼(Carassius auratus)精巢雄激素受体以及芳香化酶基因转录增加,并支持BPA通过抗雄激素和雌激素双重途径导致金鱼精子数量减少的观点。本实验中结果支持这个观点。2 000 μg·L-1BPA 暴露 18 d 时斑马鱼精巢 CYP19A及ER基因表达明显增加(图 2c、4a、4b),此外,虽然BPA没有改变 ARmRNA的表达(图3c),但是CYP17 mRNA表达显著抑制。因此,可以认为BPA对斑马鱼精巢发育的影响存在雌激素和抗雄激素双重效应,不仅直接作用于雌激素受体,也可能通过提高CYP19A基因表达促进内源雌激素的合成,增强雌激素效应。
下丘脑-垂体-性腺轴的控制不是单向的,脑垂体通过分泌LH和FSH作用于性腺,而性腺类固醇激素的变化对下丘脑也有反馈作用。实验结果显示,BPA暴露6 d斑马鱼精巢CYP17 mRNA表达受到明显抑制,其下游基因CYP11B的抑制发生在暴露后的12 d左右,其后逐渐回升,精巢中FSHR mRNA的表达量增加发生在暴露后的18 d左右(图4d)。Baudiffier等[27]在研究抗真菌药物克霉唑对斑马鱼精巢类固醇合成影响时,发现斑马鱼垂体的FSH与精巢的FSHR基因表达都随之发生上调,认为克霉唑导致的精巢11-KT合成减少激活了FSH/FSHR通路,引起脑垂体对精巢雄性激素合成的补偿调节作用。BPA暴露是否也引发类似的补偿机制还有待于进一步研究。
Lahnsteiner等[28]认为,高剂量的E2可使成熟雄鱼精液量下降,精子密度增加,并有可能导致不育。Hatef等[2]认为BPA的干扰效应使金鱼精子数量减少。本实验结果显示,BPA暴露对斑马鱼成鱼精巢组织有伤害。2 000 μg·L-1浓度组斑马鱼精巢组织中精液减少,精子浓缩,生精小管内非细胞区域增加。类似的现象在NP暴露试验中也有报道[14]。
综上所述,BPA对斑马鱼精巢发育的内分泌干扰效应是双重的。通过诱导ER和CYP19A基因表达以增加雌激素作用;抑制CYP17基因表达以干扰雄激素的生成。性激素的紊乱最终可导致斑马鱼精巢发生组织伤害。性腺雄激素合成的减少有可能启动下丘脑-垂体-性腺(HPG)轴的负反馈调节,其作用机制还有待进一步研究。通讯作者简介:周忠良(1957—),男,副教授,硕士生导师,主要从事鱼类学和生态毒理学研究。
[1]黄晔,任华,孙竹筠,等.壬基酚和双酚A对雄性斑马鱼 (Danio rerio)卵黄蛋白原mRNA的诱导效应[J].生态毒理学报,2008,3(3):274-279 Huang Y,Ren H,Sun Z Y,et al.Vitellogenin mRNA expression in male zebrafish(Danio rerio)induced by nonylphenol and bisphenol-A [J].Asian Journal of Ecotoxicology,2008,3(3):274-279(in Chinese)
[2]Hatef A,Zare A,Alavi S M,et al.Modulations in androgen and estrogen mediating genes and testicular response in male goldfish exposed to bisphenol A [J].Environmental Toxicology and Chemistry,2012,31(9):2069-2077
[3]Rhee J S,Kim R O,Seo J S,et al.Bisphenol A modulates expression of gonadotropin subunit genes in the hermaphroditic fish,Kryptolebias marmoratus [J].Comparative Biochemistryand Physiology, PartC,2010,152:456-466
[4]Rhee J S,Kim B M,Lee C J,et al.Bisphenol A modulates expression of sex differentiation genes in the selffertilizing fish,Kryptolebias marmoratus[J].Aquatic Toxicology,2011,104:218-229
[5]孙延霞,刘基芳.双酚A对雄性小鼠血清中NO,NOS及睾丸组织形态学的影响[J].中国实验诊断学,2008,12(2):196-198 Sun Y X,Liu J F.The damnification of bisphenol A by liqid peroxide and pathologic change on male mice test[J].Chinese Journal of Laboratory Diagnosis,2008,12(2):196-198(in Chinese)
[6]吕毅,吕海霞,王洪海,等.双酚A对雄性仔鼠生殖功能的影响[J].吉林大学学报:医学版,2008,34(4):618-620 Lu Y,Lu H X,Wang H H,et al.Effects of bisphenol-A on reproductive function in young male mice [J].Journal of Jilin University:Medicine Edition,2008,34(4):618-620(in Chinese)
[7]Aluru N,Leatherland J F,Vijayan M M.Bisphenol A in oocytes leads to growth suppression and altered stress performance in Juvenile rainbow trout[J].Plos One,2010,5(5):e10741.1 e10741.10
[8]Schulz R W,Vischer H F,Cavaco J E B,et al.Gonadotropins,their receptors,and the regulation of testicular functions in fish [J].Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology,2001,129B:407-417
[9]Burns K H,Matzuk M M.Minireview:Genetic models for the study of gonadotropin actions[J].Endocrinology,2002,143:2823 2835
[10]Garcia-Lopez A,Bogerd J,Granneman J C M,et al.Leydig cells express follicle-stimulating hormone receptors in African catfish[J].Endocrinology,2009,150:357 -365
[11]Garcia-Lopez A,de Jonge H,Nobrega R H,et al.Studies in zebrafish reveal unusual cellular expression patterns of gonadotropin receptor messenger ribonucleic acids in the testis and unexpected functional differentiation of the gonadotropins [J].Endocrinology,2010,151:2349-2360
[12]Ohta T,Miyake H,Miura C,et al.Follicle-stimulating hormone induces spermatogenesis mediated by androgen production in Japanese eel,Anguilla japonica [J].Biology of Reproduction,2007,77:970-977
[13]Schulz R W,de França L R,Lareyre J J,et al.Spermatogenesis in fish [J].General and Comparative Endocrinology,2010,165:390-411
[14]刘晓丽,汪奇,贾林芝,等.壬基酚对斑马鱼精巢组织及性激素合成酶基因表达的影响[J].环境科学学报,2011,31(11):2523-2529 Liu X L,Wang Q,Jia L Z,et al.Alterations in testicular histology and the mRNAs of enzymes responsible for sex steroid synthesis in the zebrafish Danio rerio exposed to nonyphenol[J].Acta Scientiae Circumstantiae,2011,31(11):2523-2529(in Chinese)
[15]Shi X,Du Y,Lam P K S,et al.Developmental toxicity and alteration of gene expression in zebrafish embryos exposed to PFOS [J].Toxicology and Applied Pharmacology,2008,230:23-32
[16]Hoffmann J L,Oris J T.Altered gene expression:A mechanism for reproductive toxicity in zebrafish exposed to benzo[a]pyrene [J].Aquatic Toxicology,2006,78:332-340
[17]Kallivretaki E,Eggen R,Neuhauss S,et al.Aromatase in zebrafish:A potential target for endocrine disrupting chemicals[J].Marine Environmental Research,2006,62:S187-S190
[18]Tong S K,Chung B C.Analysis of zebra fish cyp19 promoters[J].Journal of Steroid Biochemistry & Molecular Biology,2003,86:381-386
[19]Nakamura D C,Yanagiba Y k,Duan Z W,et al.Bisphenol A may cause testosterone reduction by adversely affecting both testis and pituitary systems similar to estradiol[J].Toxicology Letters,2010,194:16 -25
[20]Filby A L,Thorpe K L,Tyler C R.Multiple molecular effect pathways of an environmental oestrogen in fish[J].Journal of Molecular Endocrinology,2006,37:121-134
[21]Filby A L,Thorpe K L,Maack G,et al.Gene expression proles revealing the mechanisms of anti-androgenand estrogen-induced feminization in fish [J].Aquatic Toxicology,2007,81:219-231
[22]Menuet A,Pellegrini E,Anglade I,et al.Molecular characterization of three estrogen receptor forms in zebrafish:binding characteristics,transactivation properties,and tissue distributions[J].Biology of Reproduction,2002,66:1881-1892
[23]Miura T,Yamauchi K,Takahashi H,et al.Hormonal induction of all stages of spermatogenesis in vitro in the male Japanese eel(Anguilla japonica)[J].Physiology/Pharmacology,1991,88:5774-5778
[24]Amer M A,Miura T,Miura C,et al.Involvement of sex steroid hormones in the early stages of spermatogenesis in Japanese huchen(Hucho perryi)[J].Biology of Reproduction,2001,65:1057-1066
[25]Zhang W L,Zhou L Y,Senthilkumaran B,et al.Molecular cloning of two isoforms of 11β-hydroxylase and their expressions in the Nile tilapia,Oreochromis niloticus [J].General and Comparative Endocrinology,2010,165:34-41
[26]Yokota H,Abe T,Nakai M,et al.Effects of 4-tertpentylphenol on the gene expression of P450 11betahydroxylase in the gonad of medaka(Oryzias latipes)[J].Aquatic Toxicology,2005,71(2):121 -132
[27]Baudiffier D,Hinfray N,Vosges M,et al.A critical role of follicle-stimulating hormone(Fsh)in mediating the effect of clotrimazole on testicular steroidogenesis in adult zebrafish[J].Toxicology,2012,298:30-39
[28]Lahnsteiner F,Berger B,Kletzl M,et al.Effect of 17βestradiol on gamete quality and maturation in two salmonid species[J].Aquatic Toxicology,2006,79:124 -131

