甲醛对人支气管上皮细胞的毒性及N-乙酰半胱氨酸的保护作用
王明科, 陈双红, 潘沪湘, 巴剑波, 陶永华,*
1. 海军医学研究所,上海 200433 2. 解放军441医院,福鼎 355200
甲醛对人支气管上皮细胞的毒性及N-乙酰半胱氨酸的保护作用
王明科1,2, 陈双红1, 潘沪湘1, 巴剑波1, 陶永华1,*
1. 海军医学研究所,上海 200433 2. 解放军441医院,福鼎 355200
为研究甲醛对人支气管上皮细胞存活率的影响及N-乙酰半胱氨酸(N-acetylcysteine, NAC)的保护效应,以0、50、100、150、200、300和400 μmol·L-1甲醛处理人支气管上皮BEAS-2B细胞24 h,200 μmol·L-1甲醛处理BEAS-2B细胞0、6、24和48 h。以不同浓度(0、0.1、1和10 mmol·L-1)NAC预处理1 h或不同时间(预先3、1 h加入NAC、同时加入甲醛和NAC及加入200 μmol·L-1甲醛1、3 h后)加入1 mmol·L-1NAC,再以200 μmol·L-1甲醛处理BEAS-2B细胞(甲醛处理时间均为24 h),CCK-8(cell counting kit-8)实验和倒置相差显微镜观察甲醛对BEAS-2B细胞存活率的影响及NAC的保护作用。结果显示,甲醛以剂量依赖性方式引起BEAS-2B细胞死亡。200 μmol·L-1甲醛处理BEAS-2B细胞6 h,细胞存活率下降,与对照组比较差异具有统计学意义(p <0.05)。随甲醛处理时间的延长细胞存活率明显下降,存在时间效应关系。不同浓度和不同时间NAC处理可拮抗甲醛引起的细胞存活率下降,存在剂量效应关系,NAC不同时间处理组间细胞存活率未见明显差异。研究表明,甲醛以剂量和时间依赖性方式引起支气管上皮细胞存活率下降,NAC以剂量依赖性方式对甲醛引起的损伤具有保护作用。
甲醛;人支气管上皮细胞;N-乙酰半胱氨酸;保护作用
甲醛是舰船舱室和现代建筑常见的高毒类化学污染物,广泛地存在于塑料制品、树脂和建筑材料,也是家庭常用品如食品防腐剂、化妆品、消毒剂和杀菌剂的组分。此外,甲醛也是某些自然活动(如火灾)和人类活动(如吸烟和汽车燃料燃烧)的副产物[1-2]。甲醛作为人类致癌物,已被确定可引起鼻咽癌并可能引起白血病,甲醛暴露还可引起其他多种健康问题如急慢性毒性、免疫毒性、造血毒性、生殖毒性、遗传毒性等,与苯系物还可能存在联合毒性作用[3-6]。呼吸道吸入是甲醛进入人体的主要方式,呼吸系统也是甲醛侵害人体的首要靶器官。研究发现,甲醛可引起肺组织病理损伤, 炎细胞浸润,炎性细胞因子表达增强[7-9],吸入甲醛可加重哮喘大鼠气道阻力和气道炎症反应[10],也被用来制作急性肺水肿模型[11],利用流行病学调查方法发现甲醛作业工人阻塞性肺功能通气功能障碍异常率增高[12],室内甲醛浓度过高引起居民产生呼吸系统症状的危险性增大[13],但职业性甲醛暴露与肺癌的关系目前尚有争论[14]。神经源性炎症、遗传毒性和致突变性、氧化损伤、表观遗传学改变等机制可能与甲醛对呼吸系统的毒性作用有关[15-18]。
N-乙酰半胱氨酸(N-acetylcysteine,NAC)是天然存在的氨基酸L-半胱氨酸乙酰化的衍生物,分子内含有-SH基团,具有抗氧化、抗诱变、抗癌等多种药理特性,作为经典的化痰药物最早应用于上世纪60年代,现已被用于慢性阻塞性肺病、流行性感冒、急性肺损伤、特发性肺间质纤维化等多种呼吸系统疾病的治疗,对癌症、药物及重金属中毒、心脏病、帕金森氏病、吸烟损害、消化系疾病如肝炎、胰腺炎及其他以自由基氧化损伤为特征的疾病均有潜在的治疗作用[19-20]。NAC可通过直接抗氧化及提高细胞内谷胱甘肽含量间接抗氧化、抑制炎症、调节细胞凋亡和防止核酸分子损伤等多种机制发挥生物学效应[21-22〗。研究报道,NAC能够减轻尼古丁、内毒素及顺铂等物质诱导的I型肺泡上皮细胞的凋亡[23-25],也能抑制香烟提取物诱导的II型肺泡上皮细胞凋亡[26],对甲醛诱导的NIH3T3细胞[27]、成骨细胞[28〗损伤也具有保护作用。此外,NAC还能抑制甲醛诱导的人单核细胞酪氨酸磷酸化[29],对甲醛引起的小鼠学习记忆能力下降也有保护作用[30-31]。但NAC对甲醛诱导的支气管上皮细胞损伤是否具有保护作用,目前未见报道。本研究拟以人支气管上皮细胞(BEAS-2B)为研究对象,探讨甲醛对支气管上皮细胞存活率的影响及NAC的保护效应。
1 材料和方法(Materials and methods)
1.1 仪器与试剂
1.1.1 试剂
胎牛血清(fetal bovine serum, FBS)购自Gibcol,PBS、RMPI 1640培养基购自HyClone,青霉素、链霉素购自上海博光。37%甲醛溶液为上海市国药集团化学试剂有限公司分析纯试剂。96孔、24孔细胞培养板购自Corning。CCK-8(cell counting kit-8)试剂盒、NAC均购自碧云天生物技术研究所。
1.2 细胞
人支气管上皮细胞株BEAS-2B 购自ATCC(American type culture collection)。
1.3 仪器
Model 3110 CO2恒温培养箱为美国Thermo公司产品。SW-CJ-1F超净工作台购自苏净集团苏州安泰空气技术有限公司。μQuant MQX200 酶标仪为美国Bio-Tek公司产品。CKX31倒置相差显微镜购自日本Olympus,MD50数码显微成像系统购自广州明美。
1.4 实验方法
1.4.1 BEAS-2B细胞的培养
参考ATCC提供的方法,常规复苏BEAS-2B细胞,采用含100 U·mL-1青霉素、100 U·mL-1链霉素、10%胎牛血清的RMPI 1640培养基,在37℃、5% CO2培养箱中培养传代,每2~3天换一次液。取对数生长期细胞实验。
1.4.2 CCK-8实验
根据CCK-8试剂盒提供的说明书操作,步骤简要介绍如下:取生长状态良好的BEAS-2B细胞,0.25%胰蛋白酶消化后按1×104/孔接种于96孔培养板,37℃、5% CO2条件下培养,细胞贴壁后将BEAS-2B细胞分成:(1) 空白组:加入细胞培养液但不种植细胞。(2)对照组:细胞正常培养。(3)实验组:不同实验处理。根据实验分组处理后取对照组和实验组各5或6孔,空白组1孔,每孔加入10 μL的CCK-8溶液,37℃孵育1~3 h。选择450 nm波长,在酶标仪上测定各孔吸光度(D)值。按以下公式计算细胞存活率:细胞存活率=(D实验组-D空白组)/(D对照组-D空白组)×100%。
1.4.3 甲醛对BEAS-2B细胞的毒性
不同浓度甲醛对BEAS-2B细胞的损伤:取对数生长期的BEAS-2B细胞,0.25%胰蛋白酶常规消化后按5×104/孔接种于24孔培养板,37℃、5% CO2条件下培养,细胞贴壁后在100 U·mL-1青霉素、100 U·mL-1链霉素、10%胎牛血清的RMPI 1640培养基中加入终浓度0、50、100、200和400 μmol·L-1甲醛处理24 h,倒置显微镜观察细胞形态学变化,照相保存结果。取对数生长期的BEAS-2B细胞,按1×104/孔接种于96孔培养板,37℃、5% CO2条件下培养,细胞贴壁后加入终浓度0、50、100、150、200、300和400 μmol·L-1甲醛处理24 h,CCK-8实验检测计算细胞存活率,利用SPSS18.0软件以细胞存活率对剂量作图,计算半数抑制浓度IC50。
甲醛处理不同时间对BEAS-2B细胞的损伤:取对数生长期的BEAS-2B细胞,0.25%胰蛋白酶常规消化后按1×104/孔接种于96孔培养板,37℃、5% CO2条件下培养,细胞贴壁后加入终浓度200 μmol·L-1甲醛处理0、6、24和48 h,CCK-8实验检测计算细胞存活率。
1.4.4 NAC对甲醛致BEAS-2B细胞损伤的保护作用
取对数生长期的BEAS-2B细胞,0.25%胰蛋白酶常规消化后按5×104/孔接种于24孔培养板,37℃、5% CO2条件下培养,细胞贴壁后将BEAS-2B细胞分成:(1) 对照组:细胞正常培养。(2)甲醛组:在100 U·mL-1青霉素、100 U·mL-1链霉素、10%胎牛血清的RMPI 1640培养基加入终浓度为200 μmol·L-1甲醛。(3)NAC+甲醛组:加入1 mmol·L-1NAC预处理BEAS-2B细胞1 h,再加入终浓度为200 μmol·L-1甲醛。37℃、5% CO2条件下培养24 h,倒置显微镜观察细胞形态学变化,照相保存结果。
不同浓度NAC对甲醛致BEAS-2B细胞损伤的保护作用:取对数生长期的BEAS-2B细胞,0.25%胰蛋白酶常规消化后按1×104/孔接种于96孔培养板,37℃、5% CO2条件下培养,细胞贴壁后加入不同浓度(0、0.1、1和10 mmol·L-1)NAC预处理1 h,再以200 μmol·L-1甲醛处理BEAS-2B细胞24 h,同时以BEAS-2B细胞正常培养为对照组,CCK-8实验检测计算细胞存活率。
NAC不同时间对甲醛致BEAS-2B细胞损伤的保护作用:取对数生长期的BEAS-2B细胞,0.25%胰蛋白酶常规消化后按1×104/孔接种于96孔培养板,37℃、5% CO2条件下培养,细胞贴壁后在不同时间(预先3、1 h、同时加入及加入200 μmol·L-1甲醛1、3 h后)加入1 mmol·L-1NAC,再以200 μmol·L-1甲醛处理(NAC不同时间组甲醛处理时间均为24 h),同时设立BEAS-2B细胞正常培养组及200 μmol·L-1甲醛处理24 h组,CCK-8实验检测计算细胞存活率。
1.4.5 统计学方法
2 结果(Results)
2.1 不同浓度甲醛对BEAS-2B细胞的损伤
正常培养条件下人支气管上皮BEAS-2B细胞呈贴壁单层生长,梭形或多角形,相邻细胞间连接较为紧密(图1A)。50、100 μmol·L-1甲醛处理24 h倒置显微镜观察可见少量BEAS-2B细胞死亡(图1B和C),200 μmol·L-1甲醛处理24 h后倒置显微镜观察可见BEAS-2B细胞大量细胞变圆,培养液中有碎片漂浮(图1D)。400 μmol·L-1甲醛处理24 h后BEAS-2B细胞死亡进一步加重(图1E)。图2是CCK-8实验检测计算后的细胞存活曲线,50 μmol·L-1甲醛处理24 h后与正常对照组比较BEAS-2B细胞存活率即下降(图2),差异具有统计学意义(p <0.05)。100 μmol·L-1与50 μmol·L-1甲醛组细胞存活率无明显差异(p >0.05),随甲醛剂量增加BEAS-2B细胞存活率下降,存在剂量效应关系,利用SPSS18.0软件以细胞存活率对剂量作图,可得甲醛的半数抑制浓度IC50为146.15 μmol·L-1。
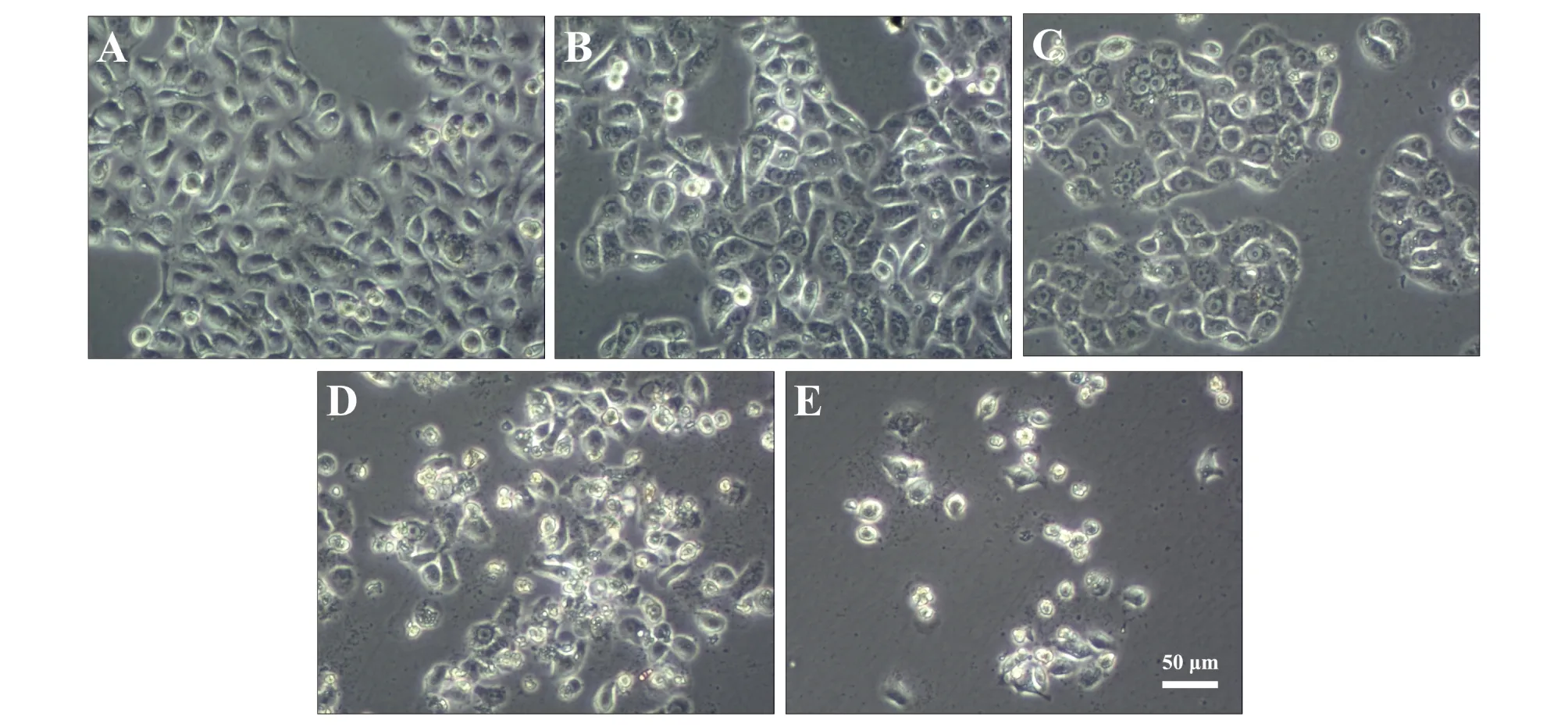
图1 不同浓度甲醛对BEAS-2B细胞的损伤,A、B、C、D、E中甲醛浓度分别为0、50、100、200和400 μmol·L-1Fig. 1 BEAS-2B cells damage after exposure to different concentrations of formaldehyde at 0(A), 50(B), 100(C), 200(D) and 400 μmol·L-1(E)
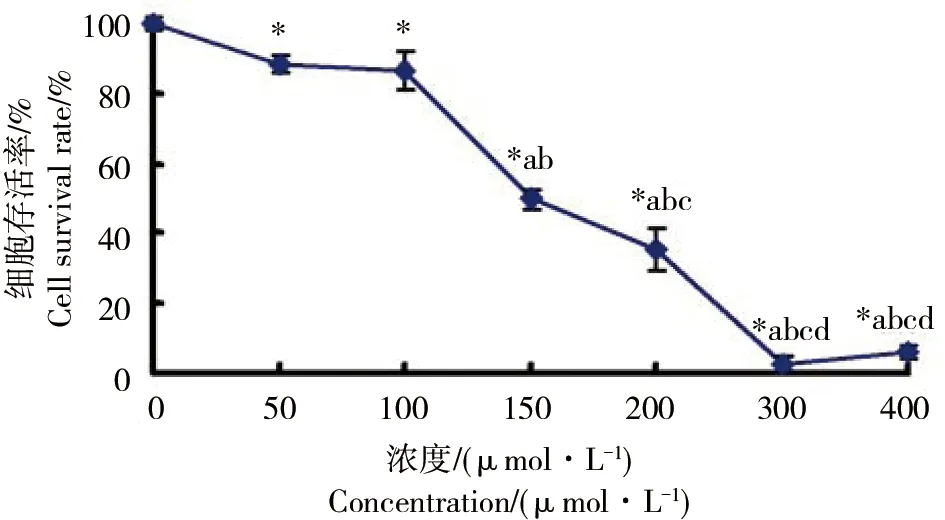
图2 甲醛处理后BEAS-2B细胞存活曲线注:*: p<0.05,与对照组比较,a、b、c和d: p<0.05,分别与50、100、150和200 μmol·L-1甲醛组比较。Fig. 2 The survival curve of BEAS-2B cells induced by formaldehydeNote: *: p<0.05, compared with the control group,a, b, c and d: p<0.05,compared with the formaldehyde group at 50, 100, 150 and 200 μmol·L-1 respectively.
2.2 甲醛处理不同时间对BEAS-2B细胞存活率的影响
通过CCK-8实验检测后发现,200 μmol·L-1甲醛处理BEAS-2B细胞6 h与对照组比较细胞存活率下降,为58.02%±8.36%,差异具有统计学意义(p <0.05)。200 μmol·L-1甲醛处理24、48 h BEAS-2B细胞存活率继续下降,分别为28.27%±7.94%、16.65%±1.63%,48 h内随甲醛处理时间延长BEAS-2B细胞存活率明显下降(p <0.05),存在时间效应关系(图3)。2. 3 NAC对甲醛致BEAS-2B细胞损伤的保护作用
由图4可见,倒置显微镜观察BEAS-2B细胞正常培养条件下呈现支气管上皮贴壁单层生长、梭形或多角形、相邻细胞间连接较为紧密的细胞学形态学特点(图4A)。200 μmol·L-1甲醛处理24 h后可见大量细胞死亡 (图4B)。加入1 mmol·L-1NAC预处理1 h可使死亡细胞减少,相邻细胞间恢复紧密连接状态,说明NAC可减少甲醛诱导的BEAS-2B细胞死亡,NAC对甲醛诱导的BEAS-2B细胞损伤具有保护效应(图4C)。
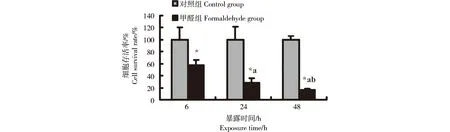
图3 200 μmol·L-1甲醛处理不同时间对BEAS-2B细胞存活率的影响注:*: p< 0.05,与对照组比较,a: p<0.05,与甲醛组处理6 h比较,b: p< 0.05,与甲醛组处理24 h比较Fig. 3 Time-effect of 200 μmol·L-1 formaldehyde on the viability of BEAS-2B cellsNote: *: p< 0.05, compared with the control group,a: p< 0.05, compared with the formaldehyde group treated for 6 h,b: p< 0.05, compared with the formaldehyde group treated for 24 h
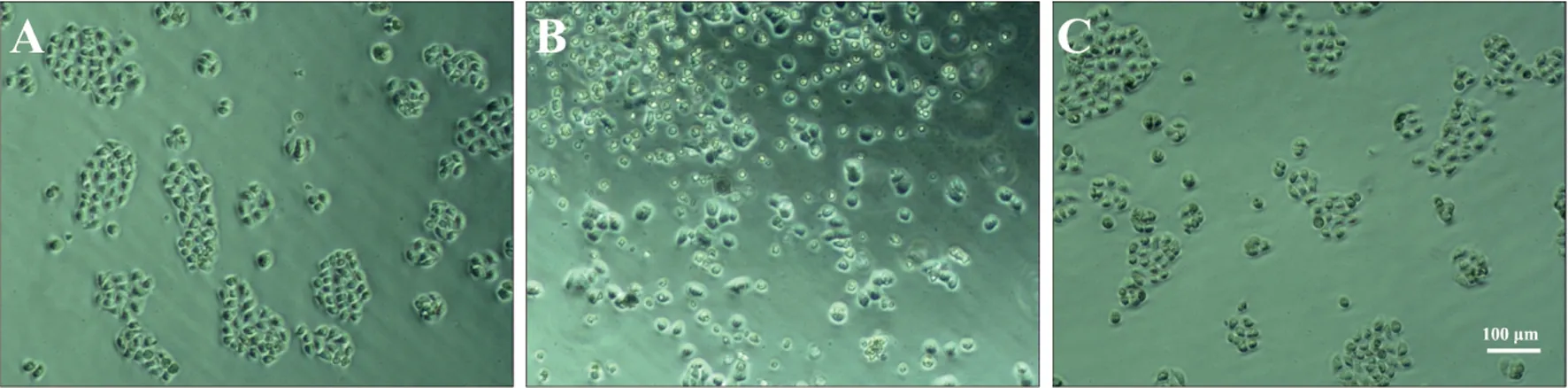
图4 NAC对甲醛致BEAS-2B细胞损伤的保护作用A:对照组,B:甲醛组,C:NAC+甲醛组Fig. 4 The protective effect of NAC on formaldehyde-induced BEAS-2B cells damageA: control group, B: formaldehyde group, C: NAC+formaldehyde group
由图5可见,不同浓度(0、0.1、1和10 mmol·L-1)NAC预处理1 h,再以200 μmol·L-1甲醛处理BEAS-2B细胞24 h,CCK-8实验检测计算细胞存活率,1、10 mmol·L-1NAC预处理1 h组细胞存活率分别为68.94%±4.76%、104.10%±5.03%,与未用NAC预处理组比较细胞存活率均明显升高,差异具有统计学意义(p <0.05)。10 mmol·L-1NAC预处理组与正常培养组细胞存活率已无明显差异(p >0.05),NAC对甲醛诱导BEAS-2B细胞损伤的保护作用存在剂量效应关系。
由图6可见,预先3 h加入NAC再以NAC+甲醛处理、预先1 h加入NAC再以NAC+甲醛处理、同时加入甲醛和NAC及加入甲醛1 h后再以NAC+甲醛处理、加入甲醛3 h后再以NAC+甲醛处理,CCK-8实验检测计算BEAS-2B细胞存活率,NAC预处理、同时加入甲醛和NAC及NAC后处理组细胞存活率与甲醛组比较细胞存活率均明显升高,差异具有统计学意义(p<0.05),但NAC预处理、同时加入甲醛和NAC及NAC后处理各组之间细胞存活率无明显差异(p>0.05),说明预先3 h加入NAC、预先1 h加入NAC、同时加入甲醛和NAC及加入甲醛1 h后再加入NAC、加入甲醛3 h后再加入NAC均对甲醛诱导的BEAS-2B细胞损伤具有保护效应。
3 讨论(Discussion)
Persoz等[32]通过研究肺泡上皮细胞A549和支气管上皮细胞BEAS-2B甲醛暴露24 h后炎症因子白介素-8(interleukin 8, IL-8)和单核细胞趋化蛋白-1(monocyte chemoattractant protein 1, MCP-1)的变化,发现甲醛可能加重严重哮喘呼吸道的炎症反应,甚至可和其他空气污染物如变应原起协同效果。甲醛还能以剂量依赖性方式诱导肺泡上皮细胞A549细胞凋亡,机制可能是甲醛通过激活p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)信号通路而下调重要的内源性抗氧化分子过氧化物酶2(peroxiredoxin 2, Prx 2)表达[33]。CCK-8实验是一种基于可溶性噻唑盐WST-8而广泛应用于细胞增殖和细胞毒性的检测,具有快速、高灵敏度的特点,原理是WST-8在电子耦合试剂存在的情况下,可被线粒体内的一些脱氢酶还原生成橙黄色的Formazan。细胞增殖越多越快,则颜色越深;细胞毒性越大,则颜色越浅。通过酶标仪检测吸光度值即可检测细胞增殖的快慢和对细胞毒性的高低。本实验通过不同浓度(50~400 μmol·L-1)的甲醛处理人支气管上皮细胞BEAS-2B,CCK-8实验和倒置相差显微镜观察发现50、100 μmol·L-1甲醛处理BEAS-2B细胞24 h细胞存活率下降,150、200 μmol·L-1甲醛处理BEAS-2B细胞存活率持续下降,继续增加浓度至300、400 μmol·L-1甲醛可使BEAS-2B细胞死亡进一步加重,说明甲醛可以浓度依赖性方式引起支气管上皮细胞BEAS-2B损伤。绘制细胞存活曲线后利用SPSS18.0软件以细胞存活率对剂量作图,可得甲醛的半数抑制浓度IC50为146.15 μmol·L-1,可为甲醛毒性实验提供参考。通过CCK-8检测甲醛处理不同时间对支气管上皮存活率的影响,结果显示,48 h内随甲醛处理时间延长细胞存活率明显下降,BEAS-2B细胞存活率与甲醛处理时间存在时间效应关系。甲醛可以剂量和时间依赖性方式引起支气管上皮细胞存活率下降,具体机制有待下一步实验研究。
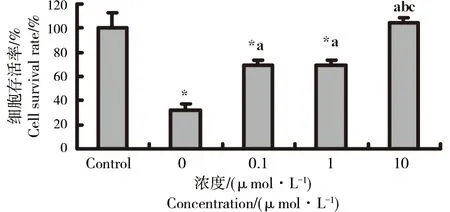
图5 不同浓度NAC对甲醛致BEAS-2B细胞损伤的保护作用注:*: p<0.05,与对照组比较,a、b和c: p<0.05,分别与0、0.1和1 mmol·L-1 NAC组比较Fig. 5 The protective effect of NAC at different concentrations on formaldehyde-induced BEAS-2B cells damageNote: *: p<0.05, compared with the control group,a, b and c: p<0.05,compared with the NAC group at 0, 0.1 and 1 mmol·L-1 respectively
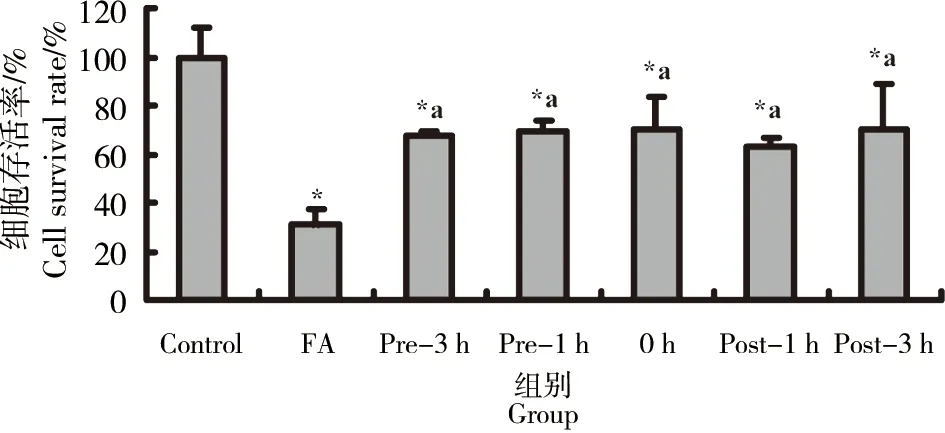
图6 NAC不同时间对甲醛致BEAS-2B细胞损伤的保护作用注:*: p<0.05,与对照组比较,a: p<0.05,与甲醛组比较。Fig. 6 The protective effect of NAC at different times on formaldehyde-induced BEAS-2B cells damageNote: *: p<0.05, compared with the control group,a: p<0.05,compared with the formaldehyde(FA) group.
NAC是天然存在的氨基酸L-半胱氨酸乙酰化的衍生物,已被广泛应用于临床[19],并可能通过多种机制对甲醛诱导的肺损伤有保护作用[34]。国内外研究表明,NAC可抑制甲醛诱导的单核细胞还原型/氧化型谷胱甘肽(GSH/GSSG)比率减少,拮抗其p38 MAPK磷酸化[35]。NAC对甲醛诱导的NIH3T3细胞[27]、成骨细胞[28]损伤也具有保护作用。NAC预处理能显著逆转甲醛引起的T细胞γ-干扰素减少和DNA损伤诱导基因45α和糖皮质激素亮氨酸拉链基因mRNA表达增加[36]。冯丫娟等[30-31]研究发现NAC对甲醛引起的小鼠学习记忆能力下降也有保护作用。因此,推测NAC可能对甲醛诱导的支气管上皮细胞损伤也具有保护作用。我们首先通过倒置显微镜观察发现,200 μmol·L-1甲醛处理24 h 可引起BEAS-2B细胞大量细胞死亡,加入1 mmol·L-1NAC预处理1 h可显著减少甲醛诱导的BEAS-2B细胞死亡,说明NAC对甲醛诱导的BEAS-2B细胞损伤具有保护效应。接着,通过CCK-8检测不同浓度NAC预处理或不同时间NAC处理对甲醛致BEAS-2B细胞存活率的影响,结果显示NAC可以剂量依赖性方式对甲醛引起的BEAS-2B细胞损伤具有保护效应,预先3、1 h、同时加入及200 μmol·L-1甲醛处理1、3 h后再加入NAC均可拮抗甲醛引起的BEAS-2B细胞存活率下降(虽然NAC不同时间处理组间细胞存活率未见明显差异),为NAC可能在将来作为一种具有临床开发前景的治疗甲醛诱导呼吸道上皮损伤的药物提供了实验基础,下一步将研究NAC对甲醛致支气管上皮细胞损伤保护效应的分子机制,为甲醛对呼吸道上皮损伤的评价及制订有效防治措施提供参考。
[1] Kim K H, Jahan S A, Lee J T. Exposure to formaldehyde and its potential human health hazards [J]. Journal of Environmental Science and Health. Part C, Environmental Carcinogenesis & Ecotoxicology Reviews, 2011, 29(4): 277-299
[2] 肖存杰, 王腾蛟, 刘洪林, 等. 潜艇大气组分的研究[J]. 解放军预防医学杂志, 2003, 21(1): 16-18
Xiao C J, Wang T J, Liu H L, et al. Study on air composition of submarine chambers [J]. Journal of Preventive Medicine of Chinese People's Liberation Army, 2003, 21(1): 16-18 (in Chinese)
[3] 李崇磊, 王凡, 刘薇, 等. 甲醛及苯系物混合暴露对小鼠肺脏的氧化损伤作用[J]. 生态毒理学报, 2012, 7(1): 87-92
Li C L, Wang F, Liu W, et al. Oxidative damage induced by formaldehyde and benzene series inhalation on mice lung [J]. Asian Journal of Ecotoxicology, 2012, 7(1): 87-92 (in Chinese)
[4] 问华肖, 魏晨曦, 陈绍恢, 等. 苯和甲醛联合染毒对小鼠脾脏的损伤[J]. 生态毒理学报, 2013, 8(4): 571-576
Wen H X, Wei C X, Chen S H, et al. Spleen tissue damage in mice from combined exposure of benzene and formaldehyde [J]. Asian Journal of Ecotoxicology, 2013, 8(4): 571-576 (in Chinese)
[5] Tang X, Bai Y, Duong A, et al. Formaldehyde in China: Production, consumption, exposure levels, and health effects [J]. Environment International, 2009, 35(8): 1210-1224
[6] 欧超燕, 孔璐, 赵进顺. 苯、甲醛对原代大鼠肺成纤维细胞联合毒性作用的初步探讨[J]. 中国职业医学, 2009, 36(4): 338-339
Ou C Y, Kong L, Zhao J S. Joint action for cytotoxicity of benzene and formaldehyde on cultured rat lung fibroblast cells [J]. China Occupational Medicine, 2009, 36(4): 338-339 (in Chinese)
[7] 于光艳, 宋祥福, 栗学军. 甲醛对小鼠肺组织形态及肺泡灌洗液成分的影响[J]. 中国工业医学杂志, 2007, 20(6): 404-405
Yu G Y, Song X F, Li X J. Effects of formaldehyde on lung histomorphology and BALF components of mice [J]. Chinese Journal of Industrial Medicine, 2007, 20(6): 404-405 (in Chinese)
[8] 赵晖, 王地, 于萍, 等. 既有建筑环境中甲醛浓度对小鼠肺组织及炎性细胞因子的作用[J]. 建筑科学, 2012, 28(1): 37-41
Zhao H, Wang D, Yu P, et al. Effects of the existing building environment of formaldehyde on the histopathology and expression of inflammatory cytokines in the lung tissue of mice [J]. Building Science, 2012, 28(1): 37-41 (in Chinese)
[9] 杨玉花, 袭著革, 晁福寰, 等. 气态甲醛对大鼠肺组织影响的病理学观察[J]. 生态毒理学报, 2007, 2(3): 310-314
Yang Y H, Xi Z G, Chao F H, et al. Pathological effects of formaldehyde inhalation on lung of rats[J]. Asian Journal of Ecotoxicology, 2007, 2(3): 310-314 (in Chinese)
[10] 金美花, 苏立明, 池永学, 等. 甲醛暴露对哮喘大鼠气道反应性及肺组织病理学改变影响[J]. 中国职业医学, 2011, 38(4): 306-308
Jin M H, Su L M, Chi Y X, et al. Effects of formaldehyde exposure on airway hyperresponsiveness and lung pathological changes in rat model of asthma [J]. China Occupational Medicine, 2011, 38(4): 306-308 (in Chinese)
[11] 梁志锋, 林军, 武黎黄英, 等. 甲醛吸入急性肺水肿大鼠心、肺、脑、肝和血清蛋白浓度及一氧化氮合酶活力变化[J]. 环境与健康杂志, 2009, 26(12): 1094-1096, 1145
Liang Z F, Lin J, Vule H A, et al. Changes of protein concentration (Cpro) and nitric oxide synthase (NOS) of serum, heart, lungs, brain and liver in acute pulmonary edema rats model induced by formaldehyde inhalation [J]. Journal of Environment and Health, 2009, 26(12): 1094-1096, 1145 (in Chinese)
[12] 洪志强, 童智敏, 施健. 甲醛对作业工人呼吸系统及肺功能影响[J]. 中国公共卫生, 2007, 23(7): 849-850
Hong Z Q, Tong Z M, Shi J. Effects of maldehyde on respiratory system and pulmonary function of workers [J]. Chinese Journal of Public Health, 2007, 23(7): 849-850 (in Chinese)
[13] Zhai L, Zhao J, Xu B, et al. Influence of indoor formaldehyde pollution on respiratory system health in the urban area of Shenyang, China [J]. African Health Sciences, 2013, 13(1): 137-143
[14] Mahboubi A, Koushik A, Siemiatycki J, et al. Assessment of the effect of occupational exposure to formaldehyde on the risk of lung cancer in two Canadian population-based case-control studies [J]. Scandinavian Journal of Work, Environment & Health, 2013, 39(4): 401-410
[15] 冯丫娟, 翟金霞. 甲醛对机体氧化损伤效应影响的研究进展[J]. 环境与健康杂志, 2008, 25(4): 364-366
Feng Y J, Zhai J X. Research advance on oxidation damage induced by formaldehyde[J]. Journal of Environment and Health, 2008, 25(4): 364-366 (in Chinese)
[16] 樊冬梅, 谢华. 甲醛对呼吸系统毒性作用的研究现状[J]. 广东医学院学报, 2009, 27(5): 584-586, 591
Fan D M, Xie H. Current status of research on toxic effects of formaldehyde on the respiratory system [J]. Journal of Guangdong Medical College, 2009, 27(5): 584-586, 591 (in Chinese)
[17] Rager J E, Smeester L, Jaspers I, et al. Epigenetic changes induced by air toxics: formaldehyde exposure alters miRNA expression profiles in human lung cells [J]. Environmental Health Perspectives, 2011, 119(4): 494-500
[18] 杨淋清, 吴德生, 刘庆成, 等. 长期低剂量甲醛染毒对永生化人支气管上皮细胞株细胞 16HBE部分癌症相关基因启动子区甲基化的影响[J]. 中国药理学与毒理学杂志, 2013, 27(3): 335-340
Yang L Q, Wu D S, Liu Q C, et al. Effect of long term contamination of low dose formaldehyde on methylation pattern of promoter of cancer related genes in 16HBE cells [J]. Chinese Journal of Pharmacology and Toxicology, 2013, 27(3): 32-37 (in Chinese)
[19] Millea P J. N-acetylcysteine: Multiple clinical applications [J]. American Family Physician, 2009, 80(3): 265-269
[20] Kelly G S. Clinical applications of N-acetylcysteine [J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 1998, 3(2): 114-127
[21] 魏琳琳, 段钟平. N-乙酰半胱氨酸药物作用机制实验研究进展[J]. 中国药学杂志, 2008, 43(12): 887-889
Wei L L, Duan Z P. Progress in experimental research on mechanisms of drug action of N-acetylcysteine [J]. Chinese Pharmaceutical Journal, 2008, 43(12): 887-889 (in Chinese)
[22] Zafarullah M, Li W Q, Sylvester J, et al. Molecular mechanisms of N-acetylcysteine actions [J]. Cellular and Molecular Life Sciences : CMLS, 2003, 60(1): 6-20
[23] Wu Y J, Muldoon L L, Neuwelt E A. The chemoprotective agent N-acetylcysteine blocks cisplatin-induced apoptosis through caspase signaling pathway [J]. The Journal of Pharmacology and Experimental Therapeutics, 2005, 312(2): 424-431
[24] Demiralay R, Gursan N, Erdem H. The effects of erdosteine, N-acetylcysteine, and vitamin E on nicotine-induced apoptosis of pulmonary cells [J]. Toxicology, 2006, 219(1-3): 197-207
[25] Demiralay R, Gursan N, Ozbilim G, et al. Comparison of the effects of erdosteine and N-acetylcysteine on apoptosis regulation in endotoxin-induced acute lung injury [J]. Journal of Applied Toxicology: JAT, 2006, 26(4): 301-308
[26] Hoshino Y, Mio T, Nagai S, et al. Cytotoxic effects of cigarette smoke extract on an alveolar type II cell-derived cell line [J]. American Journal of Physiology: Lung Cellular and Molecular Physiology, 2001, 281(2): L509-516
[27] Ayaki H, Lee M J, Sumino K, et al. Different cytoprotective effect of antioxidants and change in the iron regulatory system in rodent cells exposed to paraquat or formaldehyde [J]. Toxicology, 2005, 208(1): 73-79
[28] Huang F M, Chou L S, Chou M Y, et al. Protective effect of NAC on formaldehyde-containing-ZOE-based root-canal-sealers-induced cyclooxygenase-2 expression and cytotoxicity in human osteoblastic cells [J]. Journal of Biomedical Materials Research. Part B, Applied Biomaterials, 2005, 74(2): 768-773
[29] Bruchhausen S, Zahn S, Valk E, et al. Thiol antioxidants block the activation of antigen-presenting cells by contact sensitizers [J]. The Journal of Investigative Dermatology, 2003, 121(5): 1039-1044
[30] 冯丫娟, 丁书姝, 翟金霞. N-乙酰半胱氨酸对甲醛致小鼠学习记忆能力下降的拮抗作用[J]. 环境与健康杂志, 2008, 25(8): 680-683
Feng Y J, Ding S S, Zhai J X. Learning and memory damage induced by formaldehyde and protective efect of N-acetyl-cysteine in mice [J]. Journal of Environment and Health, 2008, 25(8): 680-683 (in Chinese)
[31] 翟金霞, 冯丫娟, 丁书姝. 维生素E和N-乙酰半胱氨酸对甲醛所致小鼠学习记忆能力改变的影响[J]. 中国职业医学, 2008, 35(6): 471-474
Zhai J X, Feng Y J, Ding S S. Effects of vitamin E and N-acetyl-cysteine on learning and memory ability impairment induced by formaldehyde in mice [J]. China Occupational Medicine, 2008, 35(6): 471-474 (in Chinese)
[32] Persoz C, Achard S, Momas I, et al. Inflammatory response modulation of airway epithelial cells exposed to formaldehyde [J]. Toxicology Letters, 2012, 211(2): 159-163
[33] Lim S K, Kim J C, Moon C J, et al. Formaldehyde induces apoptosis through decreased Prx 2 via p38 MAPK in lung epithelial cells [J]. Toxicology, 2010, 271(3): 100-106
[34] Wang M K, Chen S H, Ba J B, et al. Multiple mechanisms of N-acetylcysteine against formaldehyde-induced lung injury [J]. Medical Hypotheses, 2013, 81(1): 146-147
[35] Mizuashi M, Ohtani T, Nakagawa S, et al. Redox imbalance induced by contact sensitizers triggers the maturation of dendritic cells [J]. The Journal of Investigative Dermatology, 2005, 124(3): 579-586
[36] Sasaki Y, Ohtani T, Ito Y, et al. Molecular events in human T cells treated with diesel exhaust particles or formaldehyde that underlie their diminished interferon-gamma and interleukin-10 production [J]. International Archives of Allergy and Immunology, 2009, 148(3): 239-250
◆
ProtectiveEffectofN-acetylcysteineonFormaldehyde-inducedDamageinHumanBronchialEpithelialCells
Wang Mingke1,2, Chen Shuanghong1, Pan Huxiang1, Ba Jianbo1, Tao Yonghua1,*
1. Naval Medical Research Institute, Shanghai 200433, China 2. No. 441 Hospital of PLA, Fuding 355200, China
22 July 2013accepted18 September 2013PublisheddateonCNKIdatabases:28 November 2013
To investigate the effect of formaldehyde on the cell viability of human bronchial epithelial cells (BEAS-2B),and examine the protective effect of N-acetylcysteine(NAC), BEAS-2B cells were treated for 24 h by different concentrations (0, 50, 100, 150,200,300 and 400 μmol·L-1) of formaldehyde in different times(0, 6, 24 and 48 h) by 200 μmol·L-1formaldehyde. In order to study the effect of NAC on the formaldehyde-induced cell damage, BEAS-2B cells were pretreated with different concentrations (0, 0.1, 1 and 10 mmol L-1) of NAC for 1 h or treated for different times (pretreated with 3 and 1 h, simultaneous treated, posttreated with 1 and 3 h) by 1 mmol L-1NAC, and exposed to 200 μmol·L-1formaldehyde (all group treated by formaldehyde for 24 h). Cell viability was detected by cell counting kit-8(CCK-8) or under an inverted phase-contrast microscope. Results showed that formaldehyde can induce BEAS-2B cells death in a dose-dependent manner. After treated with 200 μmol·L-1formaldehyde for 6 h,the cell survival rate was significantly lower than that of the control group (p <0.05), and a time-dependent decline in survival of formaldehyde-treated cells was detected. NAC attenuated the decline in survival rate of BEAS-2B cells induced by formaldehyde at different concentrations in a dose-dependent manner, and had an antagonistic action on formaldehyde-induced cell damage at different times. Moreover, in our experiment no significant differences of cell viability were observed between the NAC groups at different times. Therefore, it is demonstrated that the viability of bronchial epithelial cells exposed to formaldehyde declines in a dose and time-dependent manner, and NAC has a protective effect in a dose-dependent manner.
formaldehyde; human bronchial epithelial cells; N-acetylcysteine; protective effect
总后勤部重点科研项目(BHJ12J004);上海市卫生局科研课题计划资助项目(20124Y178);中国博士后科学基金资助项目(2013M542529)
王明科(1983-),男,博士,研究方向为环境科学及干细胞,E-mail: mingkew@gmail.com
*通讯作者(Corresponding author),E-mail: tyhsci@sina.cn
10.7524/AJE.1673-5897.20130722002 优先出版网址:www. cnki. net/kcms/detail/11.5470. x. 20131128.1458.001. html
2013-07-22录用日期:2013-09-18 < class="emphasis_bold">网络出版时间
时间:2013-11-28
1673-5897(2014)1-145-08
: X171.5
: A
陶永华(1964—),男,理学硕士,研究员,主要研究方向为环境科学。
王明科, 陈双红, 潘沪湘, 等. 甲醛对人支气管上皮细胞的毒性及N-乙酰半胱氨酸的保护作用[J]. 生态毒理学报, 2014, 9(1): 145-152
Wang M K, Chen S H, Pan H X, et al. Protective effect of N-acetylcysteine on formaldehyde-induced damage in human bronchial epithelial cells [J]. Asian Journal of Ecotoxicology, 2014, 9(1): 145-152 (in Chinese)

