人绒毛膜促性腺激素注射日血清孕酮水平升高预测体外受精-胚胎移植妊娠率降低
江胜芳,张昌军,徐鸿毅,董毅飞,李璟
(湖北医药学院附属人民医院,十堰442000)
控制性卵巢刺激(COS)对于体外受精-胚胎移植(IVF-ET)周期具有重要意义。关于COS过程中孕酮(P)水平对IVF-ET结局的影响,学术界一直存有争议。2007年Venetis等[1]的一篇系统性回顾分析指出:目前尚无充分的证据支持人绒毛膜促性腺激素(HCG)注射日P水平的升高与IVF-ET临床妊娠结局间具有相关性。2008年Bosch[2]在针对上述文章发表的评论中明确支持高P水平对妊娠结局具有不良影响的观点。Bosch等[3]运用多变量分析发现:HCG日P升高与促性腺激素(Gn)总剂量、血清中雌二醇(E2)水平升高相关。Filicori等[4]也证实:Gn给药的剂量与P水平呈正相关,其原因是:升高的卵泡刺激素(FSH)有助于更多的卵泡增加颗粒细胞的活性,结果引起E2和P水平升高。许多研究结论的不一致很可能是由于不同的方法引起的,比如治疗的剂量、P水平的测量方法、P水平的阈值的设定。其中,设定合适的P水平的阈值是关键,其阈值应当通过恰当地统计分析来确定。目前多为直接设定血清P界值作为分组的依据,存在一定的主观性。本研究采用“受试者工作特性曲线”(ROC analysis)作为研究方法,ROC曲线,又称ROC分析,通过比较一种假设的真阳性率(TPR)和假阳性率(FPR),即比较灵敏度和特异性,评估假设的准确性和预测价值。ROC常用来确定一种特殊检测的阈值,获得最佳TPR而避免FPR。本研究通过对175例病例进行回顾性分析建立了COS过程中不同时间点血清P水平的ROC曲线,探讨不同时间点P水平对IVF-ET治疗结局的预测价值,其意义在于:如果HCG注射日P水平升高对IVFET结局存在负面影响,则需要考虑将胚胎冷冻供将来进行冻融胚胎移植,或在P水平升高前就注射HCG取卵。
资料与方法
一、研究对象
收集2010年1月至2011年8月在本院生殖医学中心接受IVF-ET治疗的病例资料。为避免不同特征人群卵巢反应性差异所致的偏差,设定纳入和排除标准如下:(1)纳入标准:第1次接受IVF-ET治疗,年龄<38岁,月经第2天FSH<10U/L;采用黄体期长效促性腺激素释放激素激动剂(GnRH-a)降调节方案;卵裂期胚胎移植。根据卵裂球数目、形态和胞浆碎片等参数进行胚胎评分,均有Ⅱ级以上的优质胚胎移植。(2)排除标准:单侧卵巢;因宫腔积液、预防卵巢过度刺激综合征(OHSS)等原因致全胚冷冻者。本研究共纳入病例175例,其中132例为IVF,43例为卵胞浆内单精子注射(ICSI)周期。
二、研究方法
1.治疗方案:按本中心常规,月经周期第21天肌肉注射 GnRH-a(Diphereline,3.75mg/支,博福-益普生,法国)1.3~2.3mg降调节;降调节第12~18天开始给予Gn(果纳芬,Gonal-F,75U/支,默克雪兰诺,瑞士),起始剂量为150~450U/d;3~5d后阴道超声检查监测卵泡发育情况并调整促排卵药物剂量,同时至少测定COS前1d、COS第4天、COS第6~7天、HCG日4个时间点的血清P水平。当出现3个以上直径为18mm的卵泡时肌肉注射艾泽250μg(Ovidrel,250μg/支,默克雪兰诺,瑞士),36h后超声引导下经阴道穿刺取卵,依据当日精液情况决定受精方式(IVF/ICSI)。受精后16~18h观察受精,取卵后48~72h移植胚胎(≤3个),黄体酮80mg/d(浙江仙琚制药)肌肉注射黄体支持。移植后16d测定血、尿HCG,阳性者(血β-HCG>2.0U/L)为生化妊娠,2周后B超检查提示孕囊或流产物病理检查见绒毛者诊断为临床妊娠。
2.分组和观察指标:(1)根据IVF助孕治疗结局分为妊娠组、未妊娠组。本研究中妊娠组均指临床妊娠。(2)对COS前1d、COS第4天、第6~7天和HCG日4个时间点的P水平进行ROC分析,运用ROC分析评价以上4个时间点的P值对妊娠结局的预测价值。(3)根据P水平预测妊娠结局的灵敏度和特异性的指标设定P的临界值,将病例资料分为≥临界值组和<临界值组,观察两组的以下指标,包括年龄、不育年限、体质量指数(BMI)、基础窦卵泡数(AFC)、GnRH-a用量、Gn应用天数、Gn应用支数、HCG日子宫内膜厚度、获卵数、受精率、卵裂率、优质胚胎率(Ⅱ级以上胚胎数/总胚胎数)、妊娠率等,分析P可能通过何种途径影响妊娠结局。
三、统计学分析
应用SPSS 15.0软件进行数据录入和处理。以“1”定义状态变量的阳性事件(临床妊娠阳性),以“0”定义状态变量的阴性事件(临床妊娠阴性),假定诊断变量值(血清P水平)越小越容易出现阳性,应用SPSS 15.0软件绘制ROC曲线,计算曲线下面积。计量资料用均数±标准差(±s)表示。两组间的比较采用独立样本t检验。P<0.05为有显著性差异。
结 果
一、一般资料
175例入选对象均为移植周期。不育原因中,输卵 管 因 素 占 57.7% (101/175),男 性 因 素 占29.1%(51/175),子 宫 内 膜 异 位 症 占 4.0% (7/175),不明原因不育占2.3%(4/175),合并因素占6.9%(12/175)。临床妊娠率为48.6%(85/175)。
二、COS不同时间点的P水平对妊娠结局的预测价值
以COS前1d、COS第4天、第6~7天和HCG日4个时间点的P值分别作为检验变量,以妊娠与未妊娠作为状态变量,分别标记为妊娠“1”,未妊娠“0”,妊娠组85例,未妊娠组90例,采用SPSS 15.0软件分析了妊娠组与未妊娠组之间优质胚胎数、优质胚胎率、移植胚胎数、移植优质胚胎数情况,结果显示:妊娠组与未妊娠组之间优质胚胎数、优质胚胎率有显著性差异(P>0.05),说明两组间胚胎质量有差异,而两组间移植胚胎数、移植优质胚胎数无差异,说明两组间移植的胚胎质量没有差异。因此可以排除低质量的胚胎因素导致的妊娠失败(表1)。在此基础上,采用SPSS 15.0软件分析COS前1d、COS第4天、第6~7天和HCG日4个时间点P水平的ROC曲线下面积(表2、图1)。
表1 妊娠组与未妊娠组间胚胎参数比较(±s)
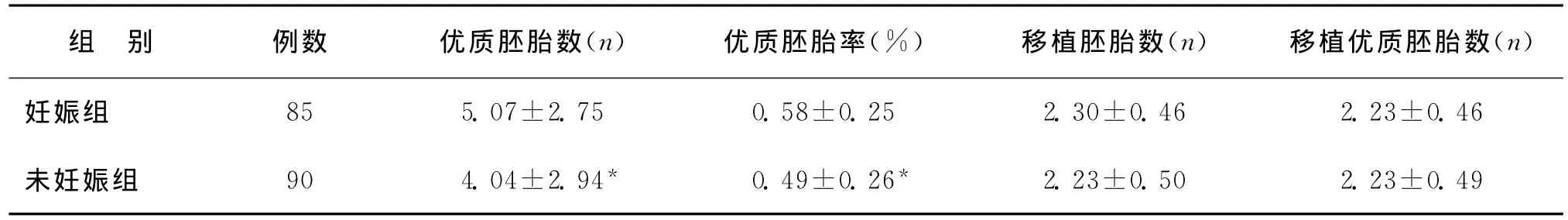
表1 妊娠组与未妊娠组间胚胎参数比较(±s)
注:与妊娠组相比,*P<0.05
组 别 例数 优质胚胎数(n) 优质胚胎率(%) 移植胚胎数(n) 移植优质胚胎数(n)妊娠组85 5.07±2.75 0.58±0.25 2.30±0.46 2.23±0.46未妊娠组 90 4.04±2.94* 0.49±0.26*2.23±0.50 2.23±0.49

表2 COS不同时间点P水平的ROC曲线下面积
在不同时间点P值对妊娠结局的预测试验中,COS前1d、COS第4天、第6~7天和HCG注射日4个时间点的P值的ROC曲线下面积分别为0.537(P=0.398)、0.540(P=0.363)、0.629(P=0.025)、0.635(P=0.002),提示 HCG 注射日的 P值对妊娠结局的预测有价值。
三、P临界值的设定
以 HCG 注射日 P 值为 4.755、6.340、7.925 nmol/L为临界值分组的妊娠组与未妊娠组例数见表3,HCG日P值分别为4.755、6.34、7.925nmol/L时,预测助孕治疗结局的灵敏度、特异度指标见表4。灵敏度=a/(a+c),特异性=d/(b+d),阳性预示值=a/(a+b),阴性预示值=d/(c+d),不同界值组的abcd取值见表3。可见水平为7.925nmol/L预测助孕治疗结局有较高的特异度,因此我们设定P临界值为7.925nmol/L分组来分析两组间的子宫内膜及胚胎因素等相关的指标,借此说明COS期间P升高通过何种途径来影响助孕治疗结局。
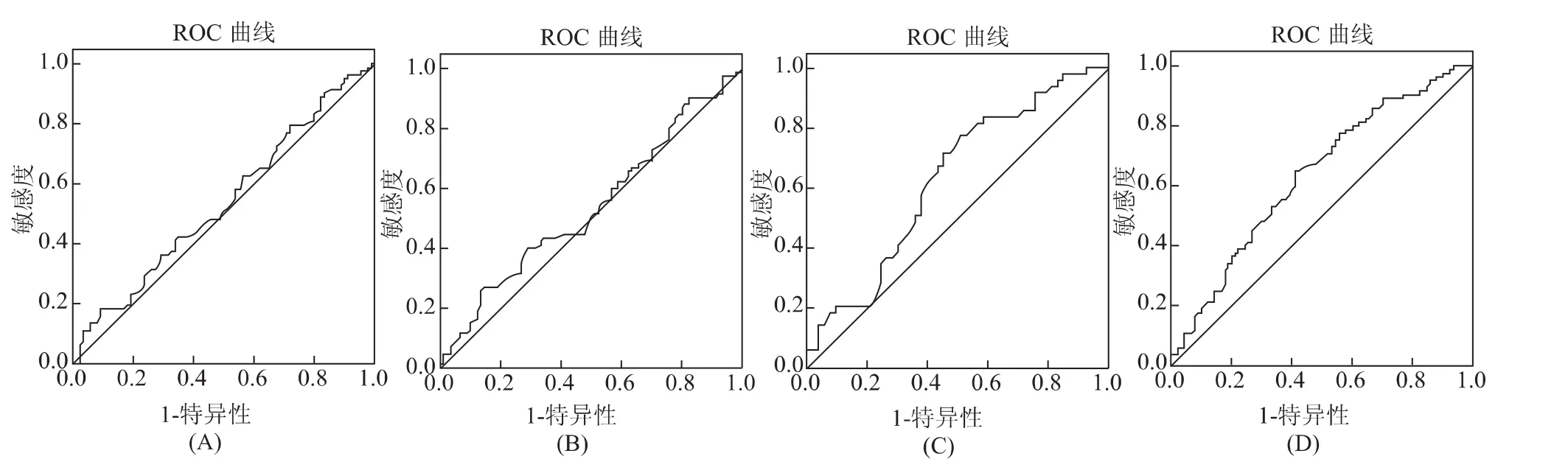
图1 P值的ROC曲线下面积

表3 HCG注射日不同P值为临界值分组的妊娠组与未妊娠组例数
四、以7.925nmol/L为P的临界值分组比较的一般临床情况和妊娠结局

表4 HCG注射日不同P值预测妊娠结局的灵敏度和特异度(%)
将病例资料分为HCG日P≥7.925nmol/L组和 HCG日P<7.925nmol/L组,两组 Gn用量、HCG日子宫内膜厚度、获卵数、妊娠率有显著性差异(P<0.05)(表5)。
表5 根据 HCG日P界值7.925nmol/L分组的一般情况和妊娠结局比较[(±s),n(%)]

表5 根据 HCG日P界值7.925nmol/L分组的一般情况和妊娠结局比较[(±s),n(%)]
注:与 HCG日P≥7.925nmol/L组相比,*P<0.05
组 别 例数 年龄(岁) 不育年限(年) BMI(kg/m2) 基础AFC HCG日P≥7.925nmol/L组 54 30.85±3.52 5.22±3.63 21.52±2.99 12.32±5.84 HCG日P<7.925nmol/L组 121 30.69±4.36 4.97±3.43 22.09±2.74 13.68±6.28组 别 GnRH-a用量(mg) Gn天数(d) Gn量(支) HCG日子宫内膜厚度(mm) 获卵数HCG日P≥7.925nmol/L组 1.46±0.26 12.04±1.26 42.65±13.71 11.28±2.56 11.30±4.17 HCG日P<7.925nmol/L组 1.46±0.24 11.73±1.26 37.94±13.51* 12.42±3.05* 9.93±3.63*组 别 受精率 卵裂率 优胚率 着床率 妊娠率HCG日P≥7.925nmol/L组 0.81±0.23 0.99±0.03 0.50±0.27 0.26±0.37 18/54(33.33)HCG日P<7.925nmol/L组 0.87±0.15 0.99±0.02 0.55±0.25 0.35±0.35 67/121(55.37)*
讨 论
评价诊断价值的两个最基本指标为灵敏度和特异度,ROC曲线就是以不同假定判断标准条件下获得一系列的灵敏度和特异度的值,以灵敏度为纵坐标,以1-特异度(误诊率)为横坐标作图所得到的曲线,并通过曲线下面积评价诊断实验的准确性,同时便于使用者结合专业知识及筛查目的选择最合适的临界值[5]。需要特别注意的是:血清P值和妊娠结局之间的关系呈非线性相关时,可能会显示非显著性的差异,ROC曲线法可能不是最合适的分析方法[6],或者解释结论时须格外注意。本研究采用ROC曲线评价COS前1d、COS第4天、第6~7天和HCG日4个时间点的P值对妊娠结局的预测价值,结果显示COS前1d、COS第4天、第6~7天和HCG日4个时间点的ROC曲线下面积分别为0.537(P=0.398)、0.540(P=0.363)、0.629(P=0.025)、0.635(P=0.002),根据Swets[7]的判断标准,面积在0.5~0.7之间有较低的准确性,COS第6~7天和HCG日2个时间点的面积的95%可 信 区 间 分 别 是 0.520~0.737、0.553~0.717,不包括0.5,且P<0.05,提示 COS第6~7天和HCG日的P值对妊娠结局有一定的预测价值。本 研 究 与 Huirne 等[8]、Bosch 等[3]、Younis等[9]的研究结论类似。Bosch等[6]最近对4 032个病例的研究发现:HCG日的P值大于1.5ng/ml(4.755nmol/L)与降低的妊娠率有显著的相关性。本研究结果与其相似,即HCG日的P值升高导致妊娠率降低,不同之处是P值阈值与其不一致,可能是由于研究方法的差异而造成的。持相反的观点者通过临床试验分析:HCG注射日即给予黄体酮支持治疗,并没有给临床妊娠带来负面影响,因此得出HCC注射日P水平升高对妊娠结果无不利影响的结论[10-12]。然而本研究的结果显示:随着超排过程的继续,血清P水平对助孕治疗结局的预测价值逐渐增大,考虑超排过程中血清P水平对IVF-ET结局的影响可能存在逐渐累加的效应,本研究结果提示不能单凭HCG注射日开始给予黄体酮支持治疗并没有给临床妊娠带来负面影响就确定HCC注射日P水平升高对妊娠结果无不利影响。
进行卵巢刺激前,大部分妇女经末期发生功能性溶黄体(functional luteolysis),导致黄体产生P的能力丧失,所以P水平在经期达到低谷。在使用长方案的IVF患者中,由于Gn生成抑制比较彻底,早卵泡期的P水平通常正常。不过因为黄体溶解不彻底,在早卵泡期仍然会出现P水平升高的情况[13]。Kolibianakis 等[14]、Pyrzak 等[15]的 研 究 结论:早卵泡期P水平的升高降低妊娠率,并建议对于P水平升高的患者,应取消周期或推迟至P水平低于0.7μg/L(2.219nmol/L)时开始进行卵巢刺激。本研究的结果显示COS前1dP值的ROC曲线下面积为0.537(P=0.398),提示COS前1d的P值对助孕治疗结局无预测价值,出现这样的结果可能是因为我中心在超促排卵治疗中对于降调后P>3.17nmol/L的患者一般认为降调未达标而取消该周期,纳入本研究的病例COS前1dP均是<3.17nmol/L。
生理状态下,LH峰启动卵母细胞的减数分裂,触发卵泡细胞黄素化,促使卵细胞壁改变导致卵泡破裂,诱发排卵。在超排卵过程中,通过GnRH-a对垂体降调节,抑制内源性LH峰,避免卵泡黄素化从而提高卵母细胞质量。依据卵巢甾体激素合成的“两种细胞两种促性腺激素”学说认为P的合成是在卵巢的卵泡膜细胞与颗粒细胞及FSH与LH的共同作用下完成的。因此,Bosch 等[3]、Huirne等[8]、Younis等[16]认为,P水平升高代表“过早黄素化”(premature luteinization)发生,会降低卵母细胞质量,影响IVF结局。“过早黄素化”的P水平标准为>1.2μg/L(3.804nmol/L),因为发现当 HCG日血清P水平>1.2μg/L(3.804nmol/L)时,妊娠率和种植率下降。为了探讨HCG日P水平影响助孕治疗结局的机制,我们根据临床经验,选择HCG日P水平4.755、6.340、7.925nmol/L作为三个分界值,计算三个分界值预测助孕治疗结局的灵敏度和特异度。P=4.755nmol/L时,预测助孕治疗结局的灵敏度是83.3%,特异度是24.7%;P=6.34 nmol/L时,预测助孕治疗结局的灵敏度是65.6%,特异度是52.9%,P=7.925nmol/L时,预测助孕治疗结局的灵敏度是40.0%,特异度是78.8%。因此我们选择具有较高特异度而灵敏度也不太低的P=7.925nmol/L作为界值来探讨HCG日P水平通过何种途径影响助孕治疗结局。
P≥7.925nmol/L组 Gn应用天数、Gn应用支数、获卵数均大于P<7.925nmol/L组,后两项有显著性差异(P>0.05),说明超排卵过程中Gn用量大、时间长、获卵数多者HCG日P更高。分析Gn用量大的原因有两种可能性:(1)超排卵巢反应差;(2)起始Gn量偏大导致过多卵泡募集,较多的小卵泡发育未达标准而延长了超排时间、增加了Gn用量。而如果Gn用量大同时合并获卵数多,超排卵巢反应差的可能性就不大了,而第二种原因的可能性更大。在临床工作中我们观察到,超排过程中雌激素水平上升过快、HCG日雌激素水平高的患者P水平更容易升高,因此推测超排起始Gn量偏大导致过多卵泡募集,较多的小卵泡发育不达标而延长了超排时间、增加了Gn用量,同时由于过多卵泡募集而导致雌激素水平上升过快、HCG日雌激素水平过高,最终导致P水平升高。以上关于雌激素与P的关系,只是我们观察到的一种现象,是否是由于雌激素升高过快导致HCG日P升高还有待于进一步研究分析。众 多 的 研 究[1,3,17-19]已 经 得 出 了 类 似 的结论:在控制性排卵周期卵泡后期,P水平的升高是由一簇发育成熟的卵泡共同分泌所致,HCG日E2水平与P水平的升高存在相关性。
我们在临床工作中还观察到超排过程中P升高的患者更容易获卵。本研究结果也提示P升高的一组获卵数更多,分析其原因除了与该组募集的卵泡数更多有关外,可能还与P升高的患者更容易获卵有关。本研究与Segal等[20]的研究认为HCG日血清P水平升高者有更高的获卵率和成熟卵母细胞数的结论相似。
P≥7.925nmol/L组与 P<7.925nmol/L组比较,受精率、卵裂率、优质胚胎率均无显著差异,说明HCG日P水平对卵母细胞质量、胚胎质量没有影响,并不是通过影响卵母细胞质量、胚胎质量来影响妊娠结局。此结论与 Ozcakir等[21]、Younis等[9]的研究相似。究竟P水平通过何种途径影响妊娠结局,本研究结果显示P≥7.925nmol/L组 HCG日子宫内膜厚度小于P<7.925nmol/L组,推测HCG日的P升高可能通过影响子宫内膜的厚度而影响其容受性,因为超排过程中P过早升高使子宫内膜减缓增殖速度而过早地向分泌期转化,从而导致子宫内膜变薄。但是HCG日的P升高是否同时影响子宫内膜的组织形态而影响其容受性还有待于进一步的实验研究。
本研究中HCG日P水平升高患者的助孕治疗妊娠率明显降低,P>6.34nmol/L预测助孕治疗结局的灵敏度是65.6%,说明我们在临床超排过程中要力求控制 HCG日P值在6.34nmol/L以下。P>7.925nmol/L预测助孕治疗结局的特异度是78.8%,说明 HCG日P>7.925nmol/lL则IVF助孕成功的可能性就很低了。至于P水平升高是受何种因素影响,怎样控制超排过程中P水平则是下一步研究的方向。
[1] Venetis CA,Kolibianakis EM,Papanikolaou E,et al.Is progesterone elevation on the day of human chorionic gonadotrophin administration associated with the probability of pregnancy in in vitro fertilization?A systematic review and meta-analysis[J].Hum Reprod Update,2007,13:343-355.
[2] Bosch E.Comment on:is progesterone elevation on the day of human chorionic gonadotrophin administration associated with the probability of pregnancy in in vitro fertilization?A systematic review and meta-analysis.By Venetis et al(2007)[J].Hum Reprod Update,2008,14:194-195
[3] Bosch E,Valencia I,Escudero E,et al.Premature luteinization during gonadotropin-releasing hormone antagonist cycles and its relationship with in vitro fertilization outcome[J].Fertil Steril,2003,80:1444-1449.
[4] Filicori M,Cognigni GE,Pocognolip,et al.Modulation of folliculogenesis and steroidogenesis in women by graded menotrophin administration [J].Hum Reprod,2002,17:2009-2015.
[5] Bewick V,Cheek L,Ball J.Statistics review 13:receiver operating characteristic curves [J].Crit Care,2004,8:508-512.
[6] Bosch E,Labarta E,Crespo J,et al.Circulating progesterone levels and ongoing pregnancy rates in controlled ovarian stimulation cycles for in vitro fertilization:analysis of over 4000cycles[J].Hum Reprod,2010,25:2092-2100.
[7] Swets JA.Measuring the accuracy of diagnostic systems[J].Science,1988,240:1285-1293.
[8] Huirne JA,van Loenen AC,Schats R,et al.Dose-finding study of daily GnRH antagonist for the prevention of premature LH surges in IVF/ICSI patients:optimal changes in LH and progesterone for clinical pregnancy [J].Hum Reprod,2005,20:359-367.
[9] Younis JS,Matilsky M,Radin O,et al.Increased progesterone/estradiol ratio in the late follicular phase could be related to low ovarian reserve in in vitro fertilizationembryo transfer cycles with a long gonadotropin-releasing hormone agonist[J].Fertil Steril,2001,76:294-299.
[10] Howles CM,Macnamee MC,Edwards RG.Progesterone supplementation in the late follicular phase of an in-vitro fertilization cycle:a“natural”way to time oocyte recovery?[J].Hum Reprod,1988,3:409-412.
[11] Ben-Nun I,Ghetler Y,Jaffe R,et al.Effect of preovulatory progesterone administration on the endometrial maturation and implantation rate after in vitro fertilization and embryo transfer[J].Fertil Steril,1990,53:276-281.
[12] Hassiakos D,Toner JP,Muasher SJ,et al.Implantation and pregnancy rates in relation to oestradiol and progesterone profiles in cycles with and without the use of gonadotrophinreleasing hormone agonist suppression [J].Hum Reprod,1990,5:1004-1008.
[13] Keck C,Neulen J,Breig-Lauel S,et al.Elevated serum progesterone concentrations during the early follicular phase of the menstrual cycle:clinical significance and therapeutic implications[J].1999,13:161-165.
[14] Kolibianakis EM,Zikopoulos K,Smitz J,et al.Elevated progesterone at initiation of stimulation is associated with a lower ongoing pregnancy rate after IVF using GnRH antagonists[J].Hum Reprod,2004,19:1525-1529.
[15] Pyrzak R,Dickey RP,Taylor SN,et al.Pregnancy outcome and embryo quality depends on the serum progesterone levels on the first day of ovarian stimulation following in vitro fertilization[J].Fertil Steril,2002,78:S243.
[16] Younis JS, Ben-Shlomo I, Ben-Ami M . Premature luteinization defined by an increased progesterone/estradiol ratio on day of human chorionic gonadotropin administration is a manifestation of diminished ovarian responsiveness to controlled ovarian hyperstimulation[J].Fertil Steril,2010,93:e29.
[17] Li R,Qiao J,Wang L,et al.Serum progesterone concentration on day of HCG administration and IVF outcome[J/OL].Reprod Biomed Online,2008,16:627-631.
[18] Givens CR,Schriock ED,Dandekar PV,et al.Elevated serum progesterone levels on the day of human chorionic gonadotropin administration do not predict outcome in assisted reproduction cycles [J].Fertil Steril,1994,62:1011-1017.
[19] Legro RS,Ary BA,Paulson RJ,et al.Premature luteinization as detected by elevated serum progesterone is associated with a higher pregnancy rate in donor oocyte in-vitro fertilization[J].Hum Reprod,1993,8:1506-1511.
[20] Segal S,Glatstein I,McShane P,et al.Premature luteinization and in vitro fertilization outcome in gonadotropin/gonadotropin-releasing hormone antagonist cycles in women with polycystic ovary syndrome[J].Fertil Steril,2009,91:1755-1759.
[21] Ozcakir HT,Levi R,Tavmergen E,et al.Premature luteinization defined as progesterone estradiol ratio>1on hCG administration day seems to adversely affect clinical outcome in long gonadotropin-releasing hormone agonist cycles[J].J Obste Gynaecol Res,2004,30:100-104.

