米非司酮调控乳腺癌细胞增殖的研究
郭永,何森,2,苏晨,,张瑶楠,王乾兴,邹检平*
(1.国家人口计生委科学技术研究所,北京100081;2.沈阳药科大学生命科学与生物制药学院,沈阳110016;3.遵义医学院细胞生物学与遗传学教研室,遵义563000)
乳腺癌患者中约有2/3的病人使用激素疗法,但临床疗效仍不够理想,目前各国科学家都在寻找新型抗乳腺癌药物。已有研究报道证实米非司酮具有抗妇科肿瘤作用,但其机制尚不明晰,从而制约了其进一步的临床应用。本研究通过四甲基偶氮唑盐法(MTT)测定不同浓度下米非司酮对乳腺癌MCF-7和T47D两种细胞系增殖的抑制率,从而分别计算出两种细胞的半数抑制浓度(IC50)。本实验研究可为后期开展米非司酮抗乳腺癌分子机制研究奠定实验基础。
材料与方法
一、研究对象
1.细胞系:乳腺癌细胞系 MCF-7和T47D购自于中国医学科学院基础医学研究所基础医学细胞中心。MCF-7和T47D分别用含10%胎牛血清(FBS)的DMEM 培养基和RPMI 1640培养基,37℃、5%CO2、饱和湿度的细胞培养箱中培养。
2.主要试剂:米非司酮(Sigma,美国),DMEM培养基、RPMI 1640培养基、FBS、0.25%胰蛋白酶(GIBCO,美国),MTT、二甲基亚砜(DMSO)(Amerosco,美国)。
二、实验方法
1.MTT法检测细胞IC50:取对数生长期的MCF-7和T47D细胞,用0.25%胰蛋白酶消化成单细胞悬液,分别以DMEM和RPMI 1640培养基(含10%FBS)调整细胞悬液浓度为4×104/ml接种于96孔板,每孔100μl,放入37℃、5%CO2、饱和湿度的细胞培养箱中培养4h后,加入米非司酮试剂,使其终浓度分别为0.01、0.1、0.5、1、2.5、10、25、50和100μmol/L,并设立空白组(不接种细胞)、对照组(接种细胞,但不加米非司酮)。每个浓度设置6个复孔。将培养板放置细胞培养箱中培养48h,各孔均 加 入 20 μl MTT 溶 液 (5mg/ml,即 0.5%MTT),继续培养4h。小心吸去孔内培养液,每孔加入150μl DMSO,置摇床上低速振荡10min,使结晶物充分溶解。在酶联免疫检测仪OD490nm处测量各孔的吸光值。取6个孔的吸光值均数,按公式计算细胞抑制率(IR):IR=[对照组光吸收值(OD)值-实验组OD值]/对照组OD值×100%。以平均抑制率为Y轴,米非司酮浓度为X轴分别绘制米非司酮浓度对两种细胞抑制率的散点图。通过直线回归分别计算米非司酮对 MCF-7和T47D细胞的IC50。
2.细胞处理方法及实验分组:根据细胞IC50实验结果,分别用浓度为0.25、2.5、25和50μmol/L米非司酮处理人乳腺癌细胞系MCF-7和T47D细胞,处理1、2和3d后分别收集不同处理组细胞。根据米非司酮的浓度分为:对照组(control,以空白溶剂代替米非司酮)、0.25μmol/L组、2.5μmol/L组、25μmol/L组、50μmol/L组。
3.细胞形态学观察:分别在米非司酮处理细胞1、2和3d后,用倒置相差显微镜观察细胞的形态学变化和生长情况。
4.米非司酮处理后乳腺癌细胞增殖实验:根据米非司酮处理乳腺癌细胞系MCF-7和T47D的细胞IC50结果,选取4个浓度梯度进行细胞增殖实验。待细胞贴壁后,去上清,加含不同浓度米非司酮(0.25、2.5、25和50μmol/L)的培养基继续培养;每24h取出一板培养板弃去培养液,每孔加入新培养液90μl以及5mg/ml的MTT 10μl,继续37℃培养4h;将培养板弃去上清,加入200μl DMSO溶解颗粒物,准备检测。检测前摇晃培养板10s,混匀颜色。在酶联检测仪上,波长570nm处检测各孔的OD;根据各孔吸光度值,绘制细胞增殖抑制曲线。
三、统计学分析
实验结果采用SPSS 17.0软件进行分析,数据结果均以(±s)表示,采用单因素方差分析,IR值采用直线回归分析,以P<0.05为显著性差异。
结 果
一、米非司酮对MCF-7和T47D细胞IC50检测结果
米非司酮对乳腺癌MCF-7和T47D细胞均有抑制作用,米非司酮作用48h后,其抑制率均随着米非司酮浓度的增加而变化,存在明显的量效关系。米非司酮作用 MCF-7细胞48h后,1、2.5、10、25、50和100μmol/L组的OD值与对照组比较,均有显著性差异(P<0.05);而作用于T47D细胞48h后,2.5、10、25、50和100μmol/L组的 OD 值与对照组比较,均有显著性差异(P<0.05)。通过对两种细胞IR值直线回归分析,米非司酮对MCF-7细胞的IC50为51.21μmol/L,对T47D细胞的IC50为54.29μmol/L(表1,图1)。
表1 不同浓度米非司酮处理MCF-7和T47D细胞OD值和IR值(±s)

表1 不同浓度米非司酮处理MCF-7和T47D细胞OD值和IR值(±s)
注:与对照组比较,*P<0.05
组 别MCF-7 T47D OD值 IR值 OD值 IR值0.57±0.04 0.00±0.00 0.54±0.03 0.00±0.00 0.01μmol/L 0.56±0.02 0.93±0.92 0.52±0.02 4.17±0.97 0.1μmol/L 0.55±0.03 4.00±1.03 0.52±0.04 4.04±1.74 0.5μmol/L 0.54±0.07 4.99±1.45 0.51±0.01 6.14±1.99 1.0μmol/L 0.53±0.07* 7.74±1.29* 0.50±0.02 6.98±2.03 2.5μmol/L 0.52±0.04* 9.56±2.18* 0.48±0.02* 11.82±3.04*10μmol/L 0.51±0.03* 11.35±2.85* 0.46±0.06* 14.19±4.68*25μmol/L 0.48±0.05* 16.16±3.44* 0.43±0.08* 19.63±3.23*50μmol/L 0.18±0.03* 68.53±5.68* 0.20±0.09* 63.36±7.10*100μmol/L 0.06±0.01* 89.41±2.17* 0.09±0.09* 83.47±4.69对照组*

图1 米非司酮对乳腺癌MCF-7和T47D细胞的生长抑制作用
二、米非司酮作用乳腺癌细胞后形态学变化
米非司酮作用乳腺癌MCF-7和T47D细胞后,在倒置显微镜下观察发现,各组细胞体积变小,细胞间的链接消失,细胞内明显有黑色小颗粒聚集。25和50μmol/L浓度米非司酮对 MCF-7乳腺癌细胞株生长抑制作用明显,特别是50μmol/L干预24h后即可观察到贴壁细胞生长速度减慢,细胞内出现小颗粒,在高倍镜下可见明显的核质浓缩。上述现象随时间的延长和剂量的增加更加明显。对MCF-7和T47D细胞,低剂量0.25μmol/L组米非司酮处理后细胞形态变化均不明显;但高剂量米非司酮,特别是50μmol/L组干预3d后,细胞形态变化明显,由贴壁状态变化为悬浮状态,说明有细胞死亡(图2、3)。
三、米非司酮处理乳腺癌细胞后细胞增殖能力检测
不同浓度的米非司酮对乳腺癌细胞系MCF-7和T47D的增殖均有抑制作用,且呈浓度依赖性。随着米非司酮浓度的增加,增殖抑制作用越显著(图4、5)。
讨 论

图2 米非司酮处理后MCF-7形态学观察(100×)
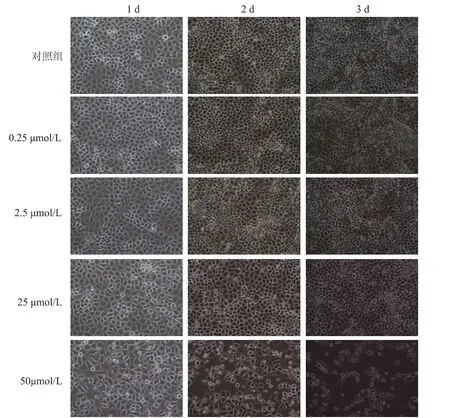
图3 米非司酮处理后T47D形态学观察(100×)
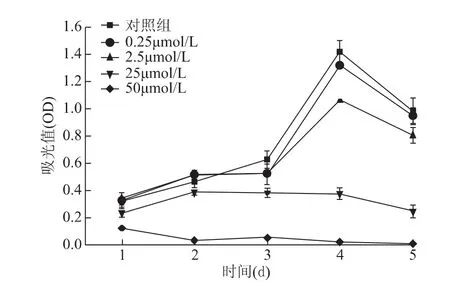
图4 米非司酮处理后乳腺癌细胞系MCF-7生长曲线

图5 米非司酮处理后乳腺癌细胞系T47D生长曲线
乳腺癌发病率已经占据全球女性恶性肿瘤的首位,是世界上五大恶性肿瘤之一。据世界卫生组织(WHO)发布的数据,全世界乳腺癌年发病人数高达120万人,年死亡人数约为50万。目前临床上治疗乳腺癌的常规药物有希罗达(卡培他滨片)、芙瑞(来曲唑片)、速莱(依西美坦片)、赫赛汀(注射用曲妥珠单抗)等,但各自有不同的临床适应症。乳腺癌患者多使用激素疗法[1],主要药物有三苯氧胺、甲孕酮、甲地孕酮等,这类药物的作用机理都是阻断人雌激素来源,目前有效率仅为30%~50%,临床疗效仍不够理想[2-4]。现在科学家们都在寻找新型内分泌治疗乳腺癌的药物。米非司酮是孕酮受体拮抗剂,米非司酮分子式为C29H35NO2,化学结构为17β羟-11β[4-二甲基苯胺]-17-丙炔基-4,9双烯-3酮,在上个世纪由法国Roussel-Uclaf公司合成,原代号RU-486。作为一种人工合成的炔诺酮衍生物,它的化学结构与孕酮相似,具有甾体结构,能与孕酮受体结合,产生较强的抗孕酮作用,主要应用于终止早孕,同时也有抗着床、诱导月经及促进宫颈成熟等作用[5]。自1993年 Murphy等人[6]首次发表了米非司酮能缩小子宫肌瘤的临床报道以来,大量的研究报道已经证实米非司酮具有抗肿瘤作用,包括乳腺癌、卵巢癌、子宫内膜癌、子宫平滑肌瘤等妇产科肿瘤[7-11]。
在新型抗乳腺癌药物的筛选过程中,各种乳腺癌细胞系的应用起了不可忽视的作用,这些来自于不同遗传背景的、具有不同激素受体表型的乳腺癌细胞系为体内外研究乳腺癌的生物学特性、治疗提供了有形的载体,涉及到新型药物发现的基础和临床前研究等各个方面。在细胞生物学方面,本研究选用的两个乳腺癌细胞系各有其代表性:MCF-7为人乳腺癌上皮细胞系,雌激素受体(ER)和孕酮受体(PR)为阳性[12];T47D 为人乳腺导管癌上皮细胞系,ER阴性,PR虽然为阳性[13],但不受雌二醇调控。这两种细胞在病理分型、激素受体亚型上均不相同,因此本研究选用这两种细胞系对米非司酮进行研究具有较好的代表性。在药理学研究方面,IC50,是指“生物学反应”被抑制一半时抑制剂的浓度。在细胞增殖方面,可以理解为一定浓度的某种药物抑制肿瘤细胞的50%停止增殖,该浓度称为50%抑制浓度,即不增殖细胞与全部细胞数之比等于50%时所对应的浓度,IC50值可以用来衡量药物抑制增殖的能力,即抑制能力越强,该数值越低,也可以反向说明某种细胞对药物的耐受程度。该指标是抗肿瘤药物筛选及临床前研究中得重要方法,对于后续药物功能和机制得研究至关重要。
本研究结果表明:经过3d5组不同浓度的米非司酮处理,米非司酮对乳腺癌细胞增殖的抑制作用具有时间和剂量依赖性,随剂量的增加和时间的延长,米非司酮对乳腺癌的抑制作用越强。在低剂量处理组(0.25μmol/L和2.5μmol/L)中以抑制细胞增殖为主,在高剂量组(25μmol/L和50μmol/L)中可能同时以抑制细胞增殖和促进细胞凋亡为主,不同剂量对乳腺癌细胞抑制作用的分子机制及其与临床应用上的相关性将是我们下一步深入研究的内容。
[1] Chlebowski RT,Kim JS,Haque R.Adherence to endocrine therapy in breast cancer adjuvant and prevention settings[J].Cancer Prev Res(Phila),2014,[Epub ahead of print].
[2] Yip CH,Smith RA,Anderson BO,et al.Guideline implementation for breast healthcare in low-and middleincome countries:early detection resource allocation [J].Cancer,2008,113(8supple):2244-2256.
[3] Ziller V,Kalder M,Albert US,et al.Adherence to adjuvant endocrine therapy in postmenopausal women with breast cancer[J].Ann Oncol,2009,20:431-436.
[4] Lin JH,Zhang SM,Manson JE.Predicting adherence to tamoxifen for breast cancer adjuvant therapy and prevention[J].Cancer Prev Res(Phila),2011,4:1360-1365.
[5] 裴开颜,肖碧莲 .每周一次口服米非司酮用于避孕的机理研究 [J].生殖医学杂志,2008,17:6-10.
[6] Murphy AA,Kettel LM,Morales AJ,et al.Regression of uterine leiomyomata in response to the antiprogesterone RU 486 [J].J Clin Endocrinol Metab,1993,76:513-517.
[7] Benagiano G,Bastianelli C,Farris M.Selective progesterone receptor modulators 3:use in oncology,endocrinology and psychiatry [J].Expert Opin Pharmacother,2008,9:2487-2496.
[8] Ramondetta LM,Johnson AJ,Sun CC,et al.Phase 2trial of mifepristone(RU-486)in advanced or recurrent endometrioid adenocarcinoma or low-grade endometrial stromal sarcoma[J].Cancer,2009,115:1867-1874.
[9] Rocereto TF,Brady WE,Shahin MS,et al.A phase II evaluation of mifepristone in the treatment of recurrent or persistent epithelial ovarian,fallopian or primary peritoneal cancer:agynecologic oncology group study [J].Gynecol Oncol,2010,116:332-334.
[10] Chabbert-Buffet N, Ouzounian S, Kairis AP, et al.Contraceptive applications of progesterone receptor modulators[J].Eur J Contracept Reprod Health Care,2008,13:222-230.
[11] Benad P,Rauner M,Rachner TD,et al.The anti-progestin RU-486inhibits viability of MCF-7breast cancer cells by suppressing WNT1 [J].Cancer Lett,2011,312:101-108.
[12] Harrell JC,Dye WW,Allred DC,et al.Estrogen Receptor Positive Breast Cancer Metastasis:Altered Hormonal Sensitivity and Tumor Aggressiveness in Lymphatic Vessels and Lymph Nodes[J].Cancer Res,2006,66:9308-9315.
[13] Horwitz KB,Mockus MB,Lessey BA.Variant T47Dhuman breast cancer cells with high progesterone-receptor levels despite estrogen and antiestrogen resistance[J].Cell,1982,28:633-642.

