抗菌肽Maximin衍生物的体外杀精效果研究
张尉,侯丽,周越,辛玲,杜江,郭颖,高娜娜,赖仞,王慧萍*,于和鸣*
(1.北京协和医学院研究生院,北京100730;2.国家人口计生委科学技术研究所,北京100081;3.中国科学院昆明动物研究所,昆明650223)
壬苯醇醚-9(Nonoxinol-9,N-9)因其具有强大的杀精效果成为广泛接受的表面活性剂类杀精剂[1],已经在美国和其他一些国家使用超过了30年[2]。作为一种有效的杀精避孕阴道外用生物制剂,除了拥有快速有效的杀精避孕性质之外,安全低毒也非常重要。但近年来有研究表明,N-9存在安全隐患,长期反复使用可能会对子宫内膜上皮细胞造成损伤[3-4],所以尽快研制新型安全的杀精避孕剂已迫在眉睫。抗菌肽(Antimicrobial peptides)是广泛存在于生物体内的一类抵抗外源性病原微生物致病作用的防御性小分子多肽(分子质量<10ku),是宿主固有免疫系统的重要组成部分[5]。每种抗菌肽都有其特定的抗菌谱,部分抗菌肽还兼具杀精子作用(如 Magainin)[6-7]。因此,抗菌肽成为近年来国内外杀微生物剂研发的热点。其中线性阳离子多肽Maximin是赖仞课题组最早从中国大蹼铃蟾(Bombina maxima)皮肤中分离提取的具有自主知识产权的先导化合物[8](专利号:ZL 00122415.8),该化合物具有广谱抗菌、抗肿瘤细胞、抗HIV等特点,并与同浓度的国外Magainin具有相似的精子制动活性[9],故成为本实验杀精分析首选抗菌肽。为了优化Maximin的杀精活性,在原有的结构基础上,赖仞课题组对其结构进行了一系列改良。本文通过对19种抗菌肽Maximin衍生物(M1~M19)进行体外杀精和细胞毒性作用的评价,筛选出有望成为安全、有效的新型体外杀精剂的候选物。
材料与方法
一、研究对象
1.精液采集及分析:精液样品来源于北京市人类精子库(注册登记号:006184110108171012)。选择育龄、健康和有正常生育史的男性志愿者48例,年龄为25~35岁,取精前禁欲72h,手淫法获取精液(精液量>2ml),于37℃保温液化30min。液化后进行常规分析,严格按照《WHO人类精液检查与处理实验室手册》第五版[10]推荐的标准执行,其中精子总数60×106~100×106/ml,精液浓度>20×106/ml,精子活动率>60%。本实验经过国家人口计生委科学技术研究所生殖医学伦理委员会批准,征得志愿者知情同意。
2.药品:19种抗菌肽 Maximin衍生物(M1~M19)由吉尔生化(上海)有限公司合成,液相色谱(HPLC)分析进行纯度鉴定,纯度≥95%。用生理盐水将Maximin衍生物配制成4×105mg/L的储备液,4℃贮存,临用前生理盐水稀释成相应浓度。
3.细胞株:人宫颈癌细胞株 Hela-229由山东省肿瘤防治研究院韩建军副主任医师惠赠,采用含10% 胎牛血清的DMEM(pH 7.4)完全培养基,在37℃、5%CO2条件下常规培养。
4.试剂:N-9(Igepal CO630,Sigma,美国)、DMEM 培养基(GIBCO,美国)、胎牛血清(GIBCO)、0.25% 胰 蛋 白 酶 (GIBCO)、PBS(Hyclone,美国)、CCK-8(日本同仁化学研究所)、伊红-苯胺黑(深圳华康生物医学工程有限公司)。其他试剂均为国产分析纯。
5.主要仪器:光学显微镜(LW100B,中国上海),血细胞分类计数器[XK06-9J,普赛德(北京)仪器设备有限公司],净工作台(北京半导体设备一厂),CO2细胞培养箱(Thermo,美国),酶联免疫检测仪(Multiskan MK3,Thermo,美国)。
二、研究方法
1.体外杀精实验:按照 WHO推荐的Sander-Cramer方法[11],将工作浓度均为2 000mg/L 的Maximin衍生物(M1~M19)分别与精液以5∶1的比例混合,在尽可能短的时间内用移液管反复吹打5次,使之充分混匀,37℃水浴孵育。药物与精液混合后开始计时,20s后立即取20μl混合液置载玻片上,高倍显微镜(×400)下观察计数。随机观察5个高倍镜视野,若有活动精子,计数200个精子,活动率=(活动精子数/精子总数)×100%。每组用3位供精者的精液,每份标本重复测2次,以生理盐水作为阴性对照,临用前测定生理盐水的原始pH值。
2.测定精子存活率实验:伊红-苯胺黑染色技术用以观察精子的存活率[10,12]。将混合液与等量的伊红-苯胺黑染料充分混合,静置30s,吸少许染液在载玻片上制成涂片,空气中干燥后,油镜下观察计数,被染色的精子记为死精子,未被染色的精子记为活精子。
3.EC100的测定:瞬间杀精效果可以用EC100来表示,即20s能够100%制动精子的最低浓度[13]。将初筛具有明显杀精效果的抗菌肽分别配制成500、1 000、1 500和2 000mg/L四种浓度梯度的溶液,采用Sander-Cramer方法,作用时间20s,同上显微镜下计数活精子,每份标本重复测定3次,绘制出EC100曲线图。
4.抗菌肽细胞毒性研究:本实验采用CCK-8试剂盒检测抗菌肽和 N-9对 Hela-229的细胞毒性[14]。将具有较强杀精作用的五种抗菌肽 M1、M7、M11、M15和M17用DMEM完全培养基稀释分别成125、250、500和1 000mg/L 4种浓度梯度。首先以125mg/L 24h的细胞毒性作为标准,初步观察细胞毒性大小,然后对毒性较小的抗菌肽用以上四种浓度观察毒性效果。
将指数生长期的Hela-229细胞经PBS清洗、0.25%胰蛋白酶消化、离心后,用DMEM完全培养基制成单细胞悬液,调整浓度至1×105细胞/ml,接种于96孔板,每孔100μl,每个浓度组设5个平行孔,并置于37℃、5%CO2的培养箱中培养24h;次日更换新鲜的含药完全培养液100μl,同时以不含药的培养液作为阴性对照,含N-9的培养液作为阳性对照。继续培养24h后,快速加入10μl的CCK-8,并使之均匀分布于孔内,继续培养2h后,在酶标仪上测定各孔的OD值,采用双波长方法,测定波长为450nm,参比波长为650nm。按照如下公式计算细胞的存活率:细胞存活率(%Cell viability)=[(AS-Ab)/(AC-Ab)]×100%,其中 AS为实验孔平均值(含有细胞的培养基、CCK-8、毒性物质),AC为对照孔平均值(含有细胞的培养基、CCK-8、没有毒性物质),Ab为空白孔平均值(不含细胞和毒性物质的培养基、CCK-8)。
N-9用 DMEM 完全培养基稀释成1.25、2.5、5和10mg/L 4种浓度梯度作为实验组,以不加N-9的培养基作为阴性对照组,测定N-9对Hela-229的24h细胞毒性和半数抑制量(I C50),同上酶标法检测计算细胞存活率。
5.抗菌肽杀精作用的时间-浓度依赖性测定:将抗菌肽配制成1 000、500、250和125mg/L的实验液,应用Sander-Cramer方法,分别测定20、40、60和120s时的精子活力,以生理盐水作为阴性对照,N-9(100mg/L)作为阳性对照。测定完毕之后,绘制出抗菌肽的时间-浓度依赖性曲线。
三、统计学分析
所有数据用SPSS 17.0软件进行分析,采用方差检验法对数据进行分析。
结 果
一、抗菌肽的体外杀精效果
利用Sander-Cramer方法对收集到的符合条件的精液进行20s杀精处理,结果显示(表1),19种抗菌肽衍生物(M1~M19)中 M1、M7、M11、M15、M17在浓度为2,000mg/L时均能完全制动精子。阴性对照为生理盐水(pH7.4)。用伊红-苯胺黑染色观察的精子存活率实验,结果表明2,000mg/L时5种抗菌肽作用之后精子无一存活。

表1 Maximin衍生物(M1~M19)杀精作用初筛(n=3)
二、EC100测定结果
将5种具有明显杀精效果的抗菌肽 M1、M7、M11、M15和M17分别进行EC100的测定。结果显示(图1),五种抗菌肽的EC100分别是:M7=M11=2 000mg/L,M1=M15=M17=1 500mg/L,说明M1、M15和 M17的瞬间杀精效果(20s)优于 M7和M11。
三、N-9对Hela-229的细胞毒性分析结果
利用1.25、2.5、5和10mg/L 4种浓度梯度分析N-9对Hela-229的细胞毒性。结果如图2所示,N-9表现出较强的细胞毒性作用,毒性随浓度的增长而增大,并有显著性差异(P<0.05)。据此数据算得 N-9的半抑制率IC50=3.01mg/L。
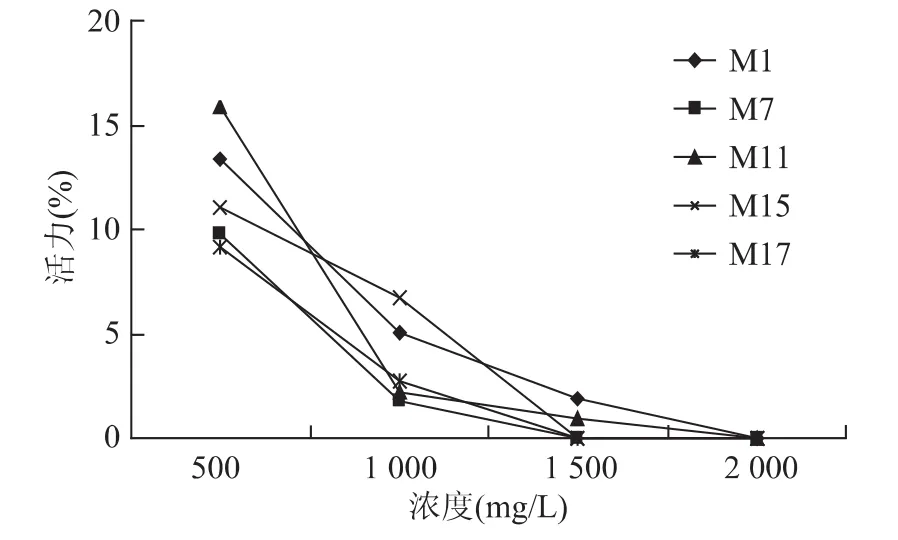
图1 五种抗菌肽的EC100曲线图
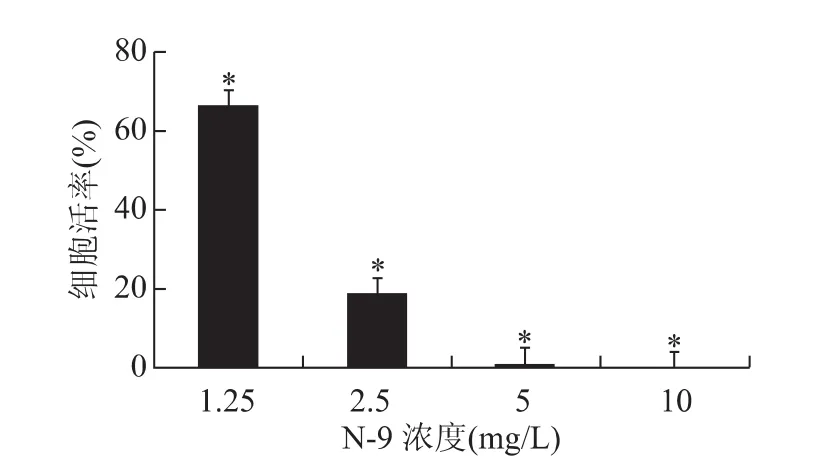
图2 N-9对 Hela-229的细胞毒性作用(n=5)
四、Maximin衍生物细胞毒性初筛
将5种具有明显杀精效果的抗菌肽M1、M7、M11、M15和M17分别进行细胞毒性初筛,实验结果如表2所示,5种抗菌肽在125mg/L时,对Hela-229细胞的24h毒性分别是M11<M15<M17<M7<M1。
表2 5种Maximin衍生物对Hela-229细胞毒性作用初筛[(n=5),(±s)]

表2 5种Maximin衍生物对Hela-229细胞毒性作用初筛[(n=5),(±s)]
药物浓度125mg/L 细胞存活率(%)M1 8.27± 0.47 M7 13.58± 1.76 M11 102.84± 3.76 M15 94.41±10.48 M17 43.38± 5.74
五、M11、M15和M17对Hela-229的细胞毒性分析结果
经过细胞毒性初筛分析,M11、M15和M17三种抗菌肽的细胞毒性较小。将三种抗菌肽配制125、250、500和1 000mg/L 4种浓度梯度,进一步分析其细胞毒性情况。结果显示,M11的细胞毒性最小,M15和M17的细胞毒性相对较强,毒性随浓度的增大而增大,并具有显著性差异(P<0.05)(图3)。
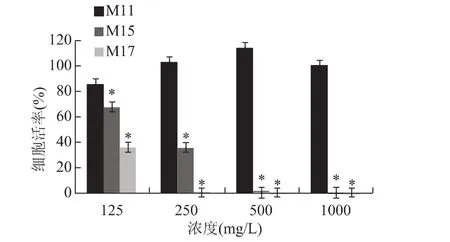
图3 M11、M15和M17对Hela-229的细胞毒性作用(n=5)
六、抗菌肽M11杀精作用的时间-浓度依赖性测定
将具有较强杀精效果和低细胞毒性的抗菌肽M11与精液以不同浓度梯度(125,250,500和1 000 mg/L)在不同时间点(20、40、60和120s)下分析其杀精效果。结果表明M11的杀精效果具有时间依赖性和浓度依赖性(图4)。
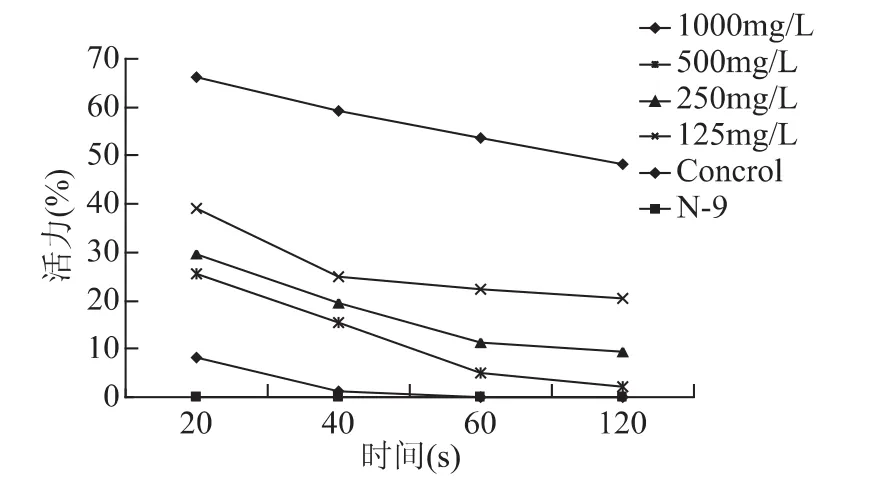
图4 M11杀精作用的时间-浓度依赖性曲线
讨 论
在近几十年间,许多抗菌肽分子已经从各种生物体中分离得到,已有部分抗菌肽应用于畜牧养殖业、生物医药业以及临床治疗等领域[15],但有关抗菌肽杀精避孕方面的研究却相对较少,国外也仅有为数不多的抗菌肽如 Magainin[7]、Dermasptins[16]等被报道。
本实验通过对19种抗菌肽Maximin衍生物(M1~M19)在2 000mg/L浓度下进行杀精作用初选,结果显示,M1、M7、M11、M15和 M17这5种衍生物具有较强的杀精效果。进一步EC100分析显示,2 000mg/L时,M7和M11作用20s时均能完全制动精子,而M1、M15和M17在1 500mg/L时即可达到同样的效果,说明M1、M15和M17的瞬间杀精效果强于M7和M11。
利用Hela-229细胞对初选出的5种具有较强杀精作用的抗菌肽做细胞毒性研究时发现,125mg/L细胞毒性大小:M11<M15<M17<M7<M1。后续通过深入的浓度梯度毒性研究时发现,仅有M11表现出几乎无细胞毒性的特点,其他4种抗菌肽分子都具有较明显的细胞毒性。因此,我们认为,低毒且有较强杀精效果的M11可作为研制安全杀精避孕阴道外用生物制剂的候选物,为进一步体外实验、动物在体研究提供了参考依据。
国际上常用的N-9虽然有强大的杀精作用效果(EC100=100mg/L),但相对 于它的 IC50=3.01mg/L而言,N-9的细胞毒性非常大,这也印证了相关文献报道。而M11则表现出几乎无细胞毒性的特点,安全性明显高于N-9。本实验仅分析了M11的体外杀精作用和对Hela-229的单一细胞毒性作用,尚不全面,在以后的工作中还将对M11对红细胞细胞毒性、杀精机制、抗阴道常见病菌作用等方面进行分析,同时开展动物体内实验,以期获得更为全面的数据。
[1] Anuja MM,Nithya RS,Swathy SS,et al.Spermicidal action of a protein isolated from ethanolic root extracts of Achyranthes aspera:an in vitro study [J].Phytomedicine,2011,18:776-782.
[2] Fichorova RN,Tucker LD,Anderson DJ The molecular basis of nonoxynol-9 – induced vaginal inflammation and its possible relevance to human immunodeficiency virus type 1 transmission[J].J Infect Dis,2001,184:418-428.
[3] Jain RK,Maikhuri JP,kiran Kumar ST,et al.Novel disulphide esters of carbothioic acid as potent,non-detergent spermicides with low toxicity to Lactobacillus and HeLa cells in vitro[J].Hum Reprod,2007,22:708-716.
[4] Zairi A,Tangy F,Bouassida K,et al.Dermaseptins and magainins:antimicrobial peptides from frogs'skin-new sources for a promising spermicides microbicides-a mini review [J].J Biomed Biotechnol,2009,2009:452567.
[5] Fox MA,Thwaite JE,Ulaeto DO,et al.Design and charaterization of novel hybrid antimicrobial peptides based on cecropin A,LL-37and magaininⅡ [J].Peptides,2012,33:197-205.
[6] Amiche M,Galanth C.Dermaseptins as models for the elucidation of membrane-acting helical amphipathic antimicrobial peptides[J].Curr pharm Biotechnol,2011,12:1184-1193.
[7] Clara A,Manjramkar DD,Reddy VK.Preclinical evaluation of magainin-A as a contraceptive antimicrobial agent [J].Fertil Steril,2004,81:1357-1365.
[8] Lai R,Zheng YT,Shen JH,et al.Antimicrobial peptides from skin secretions of Chinese red belly toad Bombina maxima[J].Peptides,2002,23:427-435.
[9] 赖仞,梁建国,张云 .两栖类皮肤抗菌多肽及其应用 [J].动物学研究,2004,25:465-468.
[10] Cooper TG.WHO laboratory manual for the examination and processing of human semen [M].5thed.World Health Organization,2010.
[11] Sutyak KE,Anderson RA,Dover SE,et al.Spermicidal activity of the safe natural antimicrobial peptide subtilosin[J].Infect Dis Obstet Gynecol,2008,540-758.
[12] Aranha C,Gupta S,Reddy KV.Contraceptive efficacy of antimicrobial peptide Nisin:in vitro and in vivo studies[J].Contraception,2004,69:333-338.
[13] Zairi A,Belaïd A,Gahbiche A,et al.Spermicidal activity of dermaseptins[J].Contraception,2005,72:447-453.
[14] Kunz C,Focke F,Saito Y,et al.Base excision by thymine DNA glycosylase mediates DNA-directed cytotoxicity of 5-fluorouracil[J].PLoS Biol,2009,7:e91.
[15] 林承德,彭鸿娟,王衍海 .抗菌肽的应用及存在的问题 [J].科学论坛,2007,7:86-90.
[16] Zairi A,Serres C,Tangy F,et al.In vitro spermicidal activity of peptides from amphibian skin:demaseptin S4and derivatives[J].Bioorg Med Chem,2008,16:266-275.

