EUCAST和CLSI微量稀释法检测曲霉体外药物敏感试验差异比较
张 明, 陈 菲, 孙文逵, 吴 婷, 颜文杰, 苏 欣, 施 毅
EUCAST和CLSI微量稀释法检测曲霉体外药物敏感试验差异比较
张 明, 陈 菲, 孙文逵, 吴 婷, 颜文杰, 苏 欣, 施 毅
目的 比较欧洲抗菌药物敏感试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)和美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)微量稀释法检测曲霉体外药物敏感性的差异。方法 分别用EUCAST方法和CLSI方法检测116株曲霉对两性霉素B、伏立康唑、伊曲康唑、卡泊芬净和米卡芬净的敏感性,比较两种方法的基本符合率、药敏符合率、极重大误差率和重大误差率。结果 EUCAST方法和CLSI方法对116株曲霉药敏检测的基本符合率为96.3%~100%。两方法检测烟曲霉对伏立康唑的药敏符合率98.8%,重大误差为1.2%,极重大误差率为0。烟曲霉和黑曲霉对两性霉素B以及烟曲霉和黄曲霉对伊曲康唑的药敏符合率均为100%,重大误差率和极重大误差率均为0。结论 EUCAST方法和CLSI方法对检测曲霉体外药物敏感性具有良好的一致性。
曲霉; EUCAST; CLSI; 最低抑菌浓度; 最低有效浓度
近年来,随着免疫抑制治疗、化疗、骨髓移植及实体器官移植等增加,侵袭性曲霉病的发病率也随之上升。目前,治疗侵袭性曲霉病的主要抗真菌药物有三唑类和棘白菌素类。然而,自1999年以来,不断有曲霉对抗真菌药物耐药的报道,甚至有报道称曲霉对伊曲康唑的耐药率高达8.14%[1]。
目前,曲霉体外药敏试验方法主要有稀释法、纸片扩散法和E试验法,其中稀释法准确度高、重复性好。欧洲抗菌药物敏感试验委员会(European Committee on Antimicrobial Susceptibility Testing,EUCAST)和美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)均发布了最新微量稀释法检测霉菌体外药敏试验方法。然而,两种方法存在一定的差异。EUCAST方法(E.DEF 9.1)要求曲霉孢子浓度为(2~5)×105CFU/m L,用血细胞计数器计数,培养基为添加2%葡萄糖的RPMI 1640,微孔板要求平底[2];CLSI方法(M38-A2)则要求曲霉孢子浓度为(0.4~5)×104CFU/m L,用分光光度计计数,培养基为RPMI 1640,微孔板要求U型底[3]。两方法对曲霉体外药敏试验的结果有无差异,国内鲜有报道;国外仅有对两性霉素B或唑类抗真菌药物两方法学的比较[4-6],而无对棘白菌素类抗真菌药物的比较。本研究分别采用EUCAST和CLSI微量稀释法检测曲霉株对两性霉素B、伏立康唑、伊曲康唑、卡泊芬净和米卡芬净的体外敏感性,比较两种检测方法的结果是否存在差异。
材料与方法
一、材料
(一)试验菌株 116株受试曲霉(烟曲霉81株、黄曲霉28株、黑曲霉7株)均为临床分离株,分离自痰液和支气管肺泡灌洗液。所有曲霉株均经菌落形态、镜下特征及分子生物学鉴定,10%甘油-80℃冰冻保存。近平滑念珠菌ATCC 22019为药敏试验质控菌株。
(二)抗真菌药物 伏立康唑由辉瑞公司提供,伊曲康唑由杨森制药有限公司提供,两性霉素由华北制药股份有限公司提供,卡泊芬净由默沙东公司提供,米卡芬净由安斯泰来制药有限公司提供。两性霉素B、伏立康唑和伊曲康唑用DMSO溶解,卡泊芬净和米卡芬净用蒸馏水溶解,分装后-80℃保存备用。
(三)器材 比浊仪(法国生物梅里埃公司产品),96孔细胞培养板(美国Costar公司产品)。
(四)主要试剂 RPMI 1640粉(美国Sigma-Aldrich公司);无水葡萄糖(美国AMRESCO公司进口分装),MOPS(北京索莱宝科技有限公司),DMSO(美国AMRESCO公司进口分装),含0.1%吐温20的生理盐水(自制)。
二、方法
(一)曲霉悬液制备 10%甘油-80℃冰冻保存的曲霉株,快速融解后,用接种环挑取少量,以三点式接种于沙保弱培养基(SDA),并用封口膜封住。置于35℃培养3~4 d。吸取5 m L含有0.1%吐温20的生理盐水于生长曲霉菌落的SDA上,用无菌棉棒轻轻擦拭菌落使之形成悬液。用无菌吸管将曲霉悬液转移至试管中,通过8层无菌纱布过滤以去除菌丝及培养基残渣,旋涡振荡15 s混均,适当稀释。
EUCAST方法[2]在光学显微镜下用血球计数板计数孢子,调整孢子浓度为(2~5)×106CFU/m L,再用生理盐水1∶10稀释至2倍终浓度接种悬液[(2~5)×105CFU/m L];CLSI方法[3]则用比浊仪(法国生物梅里埃公司产品)调整菌悬液浓度至0.5麦氏浊度单位,悬液浓度为(1~5)×106CFU/m L,再用RPMI1640培养基作1∶100稀释,得到2倍终浓度接种悬液[(1~5)×104CFU/m L]。
(二)抗真菌药物浓度配制 根据EUCAST文献[2],配制含2%葡萄糖RPMI1640培养基,并将抗真菌药物稀释至2倍于最终试验浓度(两性霉素B、卡泊芬净和米卡芬净:0.031 2~16 mg/L,伏立康唑和伊曲康唑:0.015 6~8 mg/L);CLSI方法则直接用RPMI1640将抗真菌药物稀释至上述药物浓度。
(三)曲霉药敏试验 各稀释浓度的药物100μL依次加入96孔板1~10孔中(EUCAST用平底板,CLSI用U型底板),然后每孔加入100μL曲霉悬液。11孔为单纯曲霉生长对照(100μL无药物培养基+100μL孢子悬液),12孔为空白对照(100μL无药物培养基+100μL无孢子盐水)。所有试验重复2次。
(四)终点判读 35℃孵育48 h后判读结果。对于两性霉素B、伏立康唑和伊曲康唑,观察其最低抑菌浓度(MIC),即肉眼直接观察到的无曲霉生长的最小药物浓度;而卡泊芬净和米卡芬净则读取其最低有效浓度(minimum effective concentration,MEC),即与单纯曲霉生长对照孔的菌丝相比,显微镜下开始观察到菌丝变短、变粗和高度分叉改变的最低药物浓度。判读结果超出MIC/MEC试验范围的按最高试验浓度2倍记录,而低于MIC/MEC试验范围的则按最低试验浓度记录[5,7]。
(五)两种方法的一致性分析 比较两种方法的基本符合率(essential agreement,EA)、药敏符合率(categorical agreement,CA)、极重大误差率(very major errors,VME)和重大误差率(major errors,ME)[5,7]。以及比较两种方法检测MIC或MEC的几何平均数。EA指EUCAST和CLSI两方法试验结果相差不超过2个浓度梯度的曲霉株数占受试曲霉株数的百分比;CA指EUCAST和CLSI两方法试验药敏程度(耐药/中介/敏感)相同的曲霉株数占受试曲霉株数的百分比;VME指EUCAST和CLSI两方法试验结果有一方为耐药或敏感,而另一方为敏感或耐药;ME指EUCAST和CLSI两方法试验结果有一方为中介,而另一方为敏感或耐药。如果比较两种方法结果EA≥90%、CA≥95%、VME≤1.5%以及ME≤3%,认为两方法检测结果具有一致性[8-9]。
结 果
用EUCAST和CLSI两方法分别对116株曲霉检测,观察发现所有曲霉株在U型底和平底96孔板中均生长良好。在烟曲霉敏感性试验中,采用EUCAST方法,两性霉素B的MIC均≤1 mg/L,且检测出1株烟曲霉,伏立康唑对其MIC=2 mg/L,而CLSI方法检测到1株烟曲霉,两性霉素B对其MIC=2 mg/L,伏立康唑对其MIC均≤1 mg/L;两方法均检测到3株烟曲霉,伊曲康唑对其的MIC≥4 mg/L;两方法结果显示,卡泊芬净和米卡芬净的MEC均≤1 mg/L。在黄曲霉和黑曲霉的敏感性试验中,两性霉素B、伏立康唑和伊曲康唑对所有曲霉株的MIC≤1 mg/L,卡泊芬净和米卡芬净的MEC≤1 mg/L。两性霉素B对曲霉的MIC和卡泊芬净的MEC的几何平均数,EUCAST方法低于CLSI方法;而伏立康唑和伊曲康唑的MIC以及米卡芬净的MEC的几何平均数,EUCAST方法高于CLSI方法。对两性霉素B、伏立康唑、伊曲康唑、卡泊芬净和米卡芬净的敏感性结果两方法学具有较高的EA,其中相差1个浓度范围的EA烟曲霉组分别为:97.5%、98.8%、96.3%、97.5%和100%;黄曲霉组分别为:100%、96.4%、100%、100%和96.4%;黑曲霉组分别为:100%、100%、100%、100%和100%。而相差2个浓度范围的EA各曲霉株对各抗真菌药物均为100%。见表1。
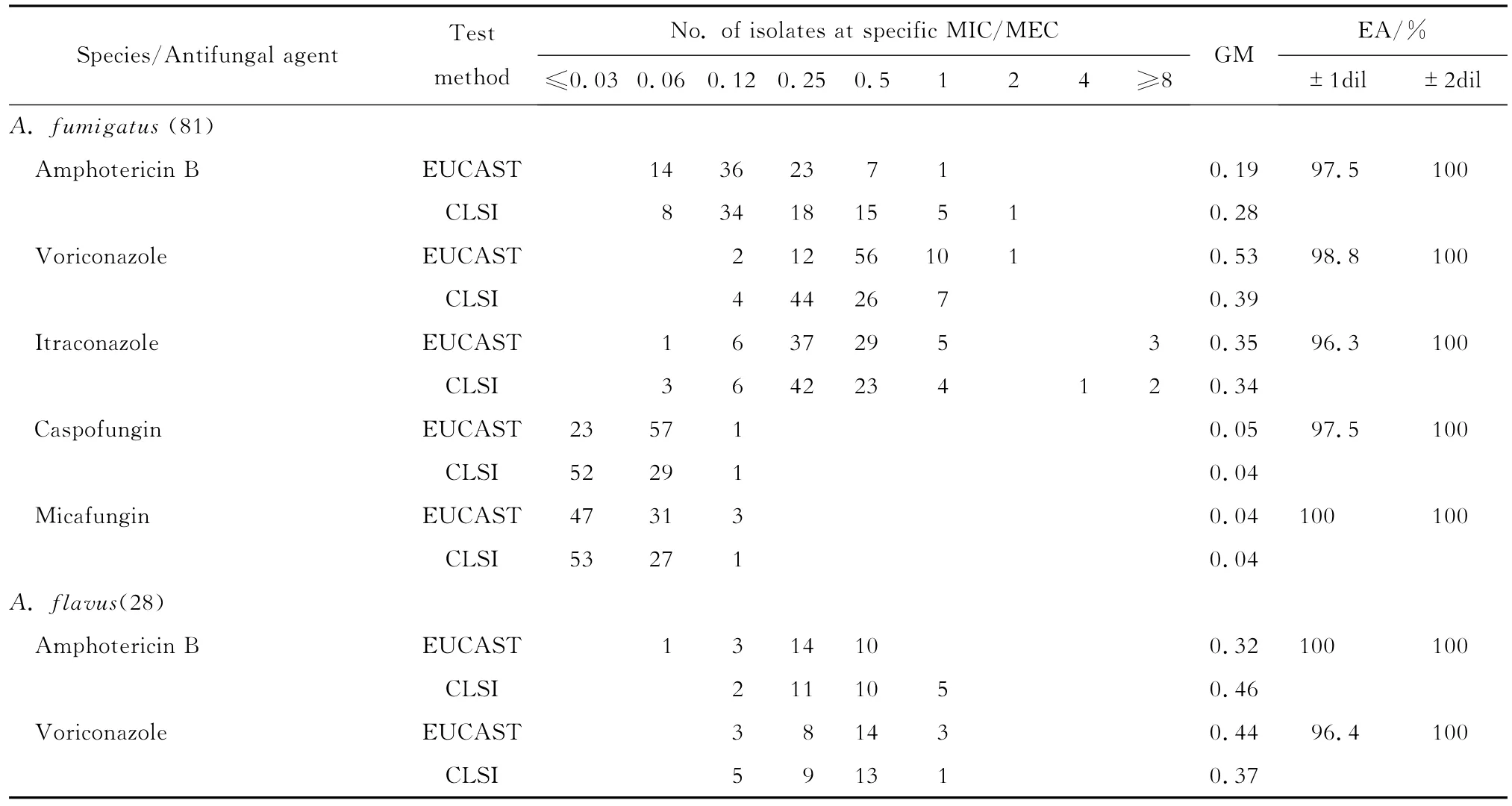
表1 CLSI和EUCAST方法检测两性霉素B、伏立康唑、伊曲康唑、卡泊芬净和米卡芬净对曲霉株的体外敏感性Table 1In vitrosusceptibilities ofAspergillusisolates to amphotericin B,voriconazole,itraconazole,caspofungin and micafungin as determined by CLSI and EUCAST broth microdilution methods
GM,geometric mean.EA,essential agreement.±1dil,%of results within plus/minus 1 log2 dilution;±2dil,%of results within plus/minus 2 log2 dilutions.
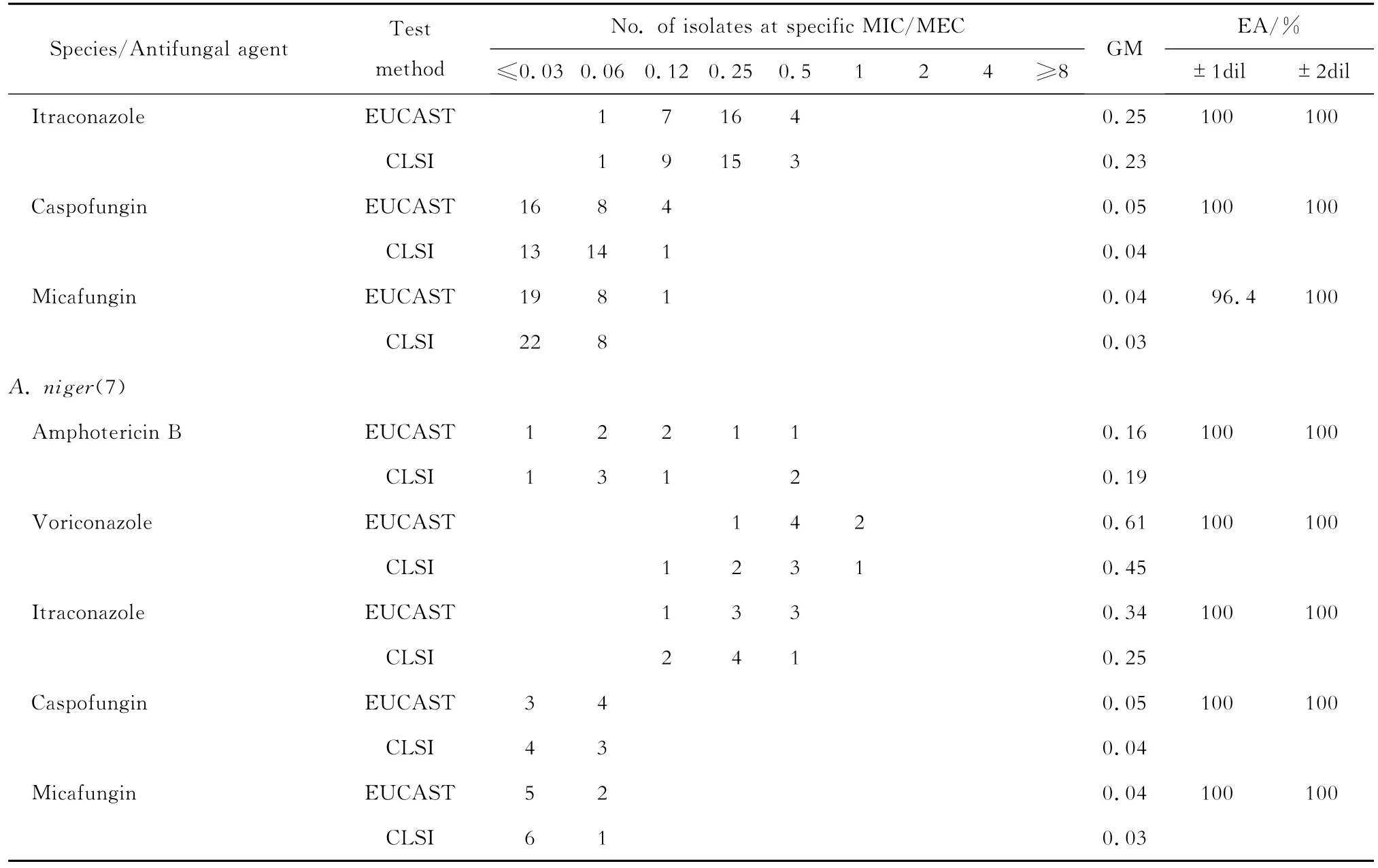
EUCAST公布的曲霉对抗真菌药物的折点见表2。由于CLSI尚无折点公布,我们根据经CLSI检测的大样本曲霉对抗真菌药物的流行病学临界值(ECVs)进行敏感性评估,见表3。采用EUCAST方法测得伏立康唑对1株烟曲霉的MIC=2 mg/L,根据EUCAST折点判定为中介;而其在CLSI方法中MIC=1 mg/L,根据ECVs值判定为敏感。另外两方法均检测到伊曲康唑对3株烟曲霉的MIC≥2 mg/L,根据EUCAST的折点及CLSI的ECVs值均判定为耐药,占受试烟曲霉株3.7%。
两方法检测烟曲霉对伏立康唑的敏感性试验CA为98.8%,ME为1.2%,VME为0;烟曲霉和黑曲霉对两性霉素B以及烟曲霉和黄曲霉对伊曲康唑的CA均为100%,ME和VME均为0。见表4。

表2 EUCAST发布的曲霉对抗真菌药物的折点(mg/L)Table 2 European Committee on Antimicrobial Susceptibility Testing(EUCAST)clinical breakpoint of antifungal agents(mg/L)
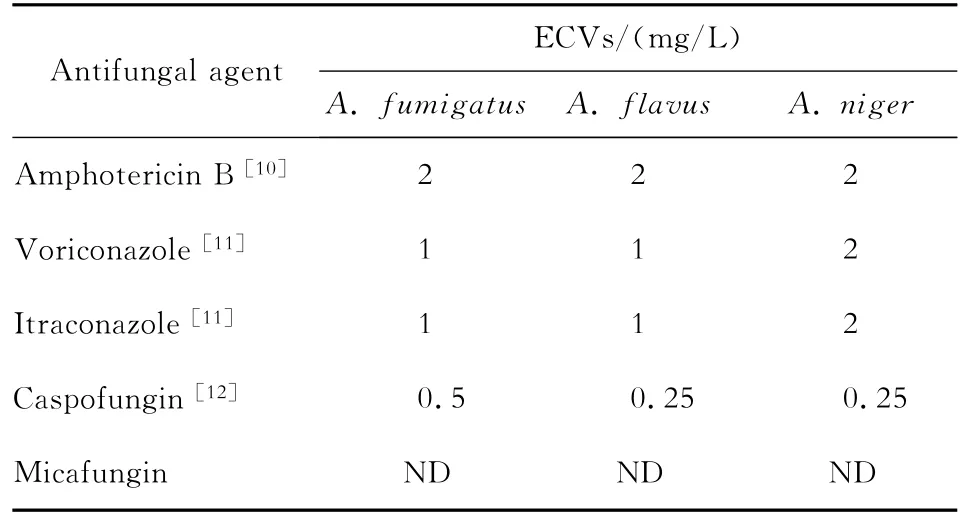
表3 CLSI方法检测获得的曲霉对抗真菌药物的临界值Table 3 Clinical and Laboratory Standards Institute antifungal epidemiologic cutoff values(ECVs)
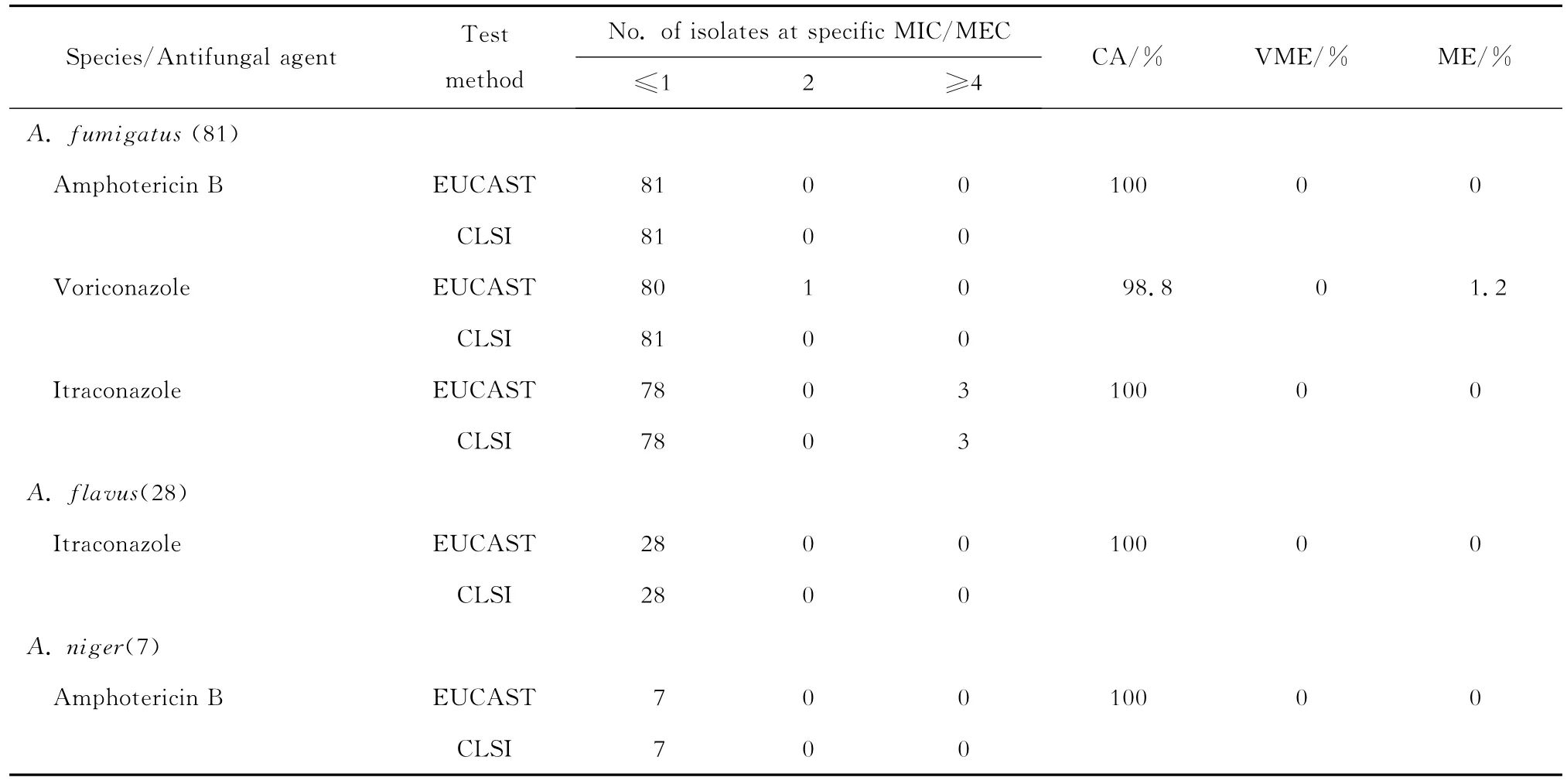
表4 EUCAST和CLSI两方法检测曲霉对两性霉素B、伏立康唑和伊曲康唑的药敏符合率Table 4 Categorical agreement between the results of EUCAST and CLSI broth microdilution methods for amphotericin B,voriconazole and itraconazole
讨 论
本研究分别采用EUCAST和CLSI方法检测116株曲霉对抗真菌药物的体外敏感性,结果显示两方法具有较高的一致性:EA为96.3%~100%、CA 100%、VME 0和ME 0~1.2%。Chryssanthou等[4]分别用EUCAST和CLSI方法检测40株曲霉的体外药物敏感性,发现两方法对伏立康唑敏感性的EA为98.8%。同样,Pfaller等[7]用两方法检测245株曲霉对伏立康唑和伊曲康唑的体外敏感性,结果显示EA分别为99.6%和96.3%。Pfaller等[5]随后研究发现,两方法检测22株烟曲霉、20株黄曲霉和13株黑曲霉对伏立康唑、伊曲康唑、卡泊芬净和阿尼芬净敏感性的EA均为100%。
本研究中,两方法均检测到伊曲康唑对3株烟曲霉的MIC≥2 mg/L,根据EUCAST折点和CLSI的ECVs值均判定为耐药,占所检测烟曲霉菌株的3.7%。Pfaller等[13]2005年检测445株曲霉对伊曲康唑的体外敏感性未发现耐药株;而Pfaller等[6]2009年再次检测伊曲康唑对637株曲霉的体外敏感性,发现对43株烟曲霉MIC≥2 mg/L,占检测曲霉的6.75%。可见,曲霉对伊曲康唑的耐药率呈现上升趋势。
尽管EUCAST未发布卡泊芬净的折点,但CLSI方法测得的ECVs值为0.5 mg/L[12]。我们所检测的116株曲霉,卡泊芬净对其的MEC均≤0.5 mg/L。Pfaller等[6]用CLSI方法检测526株曲霉对卡泊芬净、米卡芬净和阿尼芬净的体外敏感性,发现这3种棘白菌素类抗真菌药物对超过99%曲霉株的MEC≤0.06 mg/L。同样,Lockhart等[14]用CLSI方法检测288株曲霉药物敏感性发现,卡泊芬净、米卡芬净和阿尼芬净对超过90%的曲霉株的MEC≤0.06 mg/L。我们应用CLSI方法和EUCAST对116株曲霉检测均发现,卡泊芬净和米卡芬净对曲霉株同样具有较高的抑菌活性,MEC≤0.06 mg/L的曲霉株占试验菌株的94.8%。
EUCAST方法检测两性霉素B对曲霉MIC的几何平均数较CLSI方法的低。Espinel-Ingroff等[10]用CLSI方法检测8个中心的3 988株烟曲霉对两性霉素B的敏感性发现,MIC≥2 mg/L和MIC≥4 mg/L曲霉株分别为214株(5.36%)和9株(0.23%),而应用EUCAST方法检测1个中心的833株烟曲霉对两性霉素B的敏感性试验发现,MIC≥2 mg/L和MIC≥4 mg/L曲霉株分别为7株(0.84%)和1株(0.12%)。我们还发现,伏立康唑对曲霉MIC的几何平均数EUCAST方法高于CLSI方法,且应用EUCAST方法检测到伏立康唑对1株烟曲霉的MIC=2 mg/L,而CLSI方法检测对该曲霉株MIC=1 mg/L。Chryssanthou等[4]同样发现,伏立康唑对曲霉 MIC几何平均数EUCAST方法较CLSI方法的高。
总之,尽管EUCAST方法和CLSI方法对曲霉孢子浓度、孢子计数方式、培养基成分及微孔板类型的要求有所区别,但本研究显示两方法对曲霉体外药物敏感性试验具有良好的一致性,对临床有同样的参考意义。
[1] Rodriguez-Tudela JL,Alcazar-Fuoli L,Mellado E,et al.Epidemiological cutoffs and cross-resistance to azole drugs inAspergillus fumigatus[J].Antimicrob Agents Chemother,2008,52(7):2468-2472.
[2] Subcommittee on Antifungal Susceptibility Testing of the ESCMID European Committee for Antimicrobial Susceptiotibility Testing.EUCAST Technical Note on the method for the determination of broth dilution minimum inhibitory concentrations of antifungal agents for conidia-forming moulds[J].Clin Microbiol Infect,2008,14(10):982-984.
[3] Rex JH.Reference method for broth dilution antifungal susceptibility testing of filamentous fungi[M].United States:Clinical and Laboratory Standards Institute,2008:1-35.
[4] Chryssanthou E,Cuenca-Estrella M.Comparison of the EUCAST-AFST broth dilution method with the CLSI reference broth dilution method(M38-A)for susceptibility testing of posaconazole and voriconazole againstAspergillusspp[J].Clin Microbiol Infect,2006,12(9):901-904.
[5] Pfaller MA,Duncanson F,Messer SA,et al.In vitroactivity of a novel broad-spectrum antifungal,E1210,tested againstAspergillusspp.determined by CLSI and EUCAST broth microdilution methods[J].Antimicrob Agents Chemother,2011,55(11):5155-5158.
[6] Pfaller M,Diekema DJ,Ghannoum MA,et al.Wild-type MIC distribution and epidemiological cutoff values forAspergillus fumigatusand three triazoles as determined by the Clinical and Laboratory Standards Institute broth microdilution methods[J].J Clin Microbiol,2009,47(10):3142-3146.
[7] Pfaller MA,Castanheira M,Diekema DJ,et al.Comparison of European Committee on Antimicrobial Susceptibility Testing(EUCAST)and Etest methods with the CLSI broth microdilution method for echinocandin susceptibility testing of Candida species[J].J Clin Microbiol,2010,48(5):1592-1599.
[8] Alexander BD,Byrne TC,Smith KL,et al.Comparative evaluation of Etest and Sensititre Yeastone panels against the Clinical and Laboratory Standards Institute M27-A2 reference broth microdilution method for testing Candida susceptibility to seven antifungal agents[J].J Clin Microbiol,2007,45(3):698-706.
[9] Steward CD,Mohammed JM,Swenson JM,et al.Antimicrobial susceptibility testing of carbapenems:multicenter validity testing and accuracy levels of five antimicrobial test methods for detecting resistance inEnterobacteriaceaeandPseudomonas aeruginosaisolates[J].J Clin Microbiol,2003,41(1):351-358.
[10] Espinel-Ingroff A,Cuenca-Estrella M,Fothergill A,et al.Wild-type MIC distributions and epidemiological cutoff values for amphotericin B andAspergillusspp.for the CLSI broth microdilution method(M38-A2 document)[J].Antimicrob Agents Chemother,2011,55(11):5150-5154.
[11] Espinel-Ingroff A,Diekema DJ,Fothergill A,et al.Wildtype MIC distributions and epidemiological cutoff values for the triazoles and sixAspergillusspp.for the CLSI broth microdilution method(M38-A2 document)[J].J Clin Microbiol,2010,48(9):3251-3257.
[12] Espinel-Ingroff A,Cuence-Estrella M,Fothergill A,et al.Wild-type MIC distributions and epidemiological cutoff values for amphotericin B andAspergillusspp.for the CLSI broth microdilution method(M38-A2 document)[J].Antimicrob Agents Chemother,2011,55(11):5140-5154.
[13] Pfaller MA,Boyken L,Hollis RJ,et al.In vitrosusceptibilities of clinical isolates ofCandidaspecies,Cryptococcusneoformans,andAspergillusspecies to itraconazole:global survey of 9,359 isolates tested by clinical and laboratory standards institute broth microdilution methods[J].J Clin Microbiol,2005,43(8):3807-3810.
[14] Lockhart SR,Zimbeck AJ,Baddley JW,et al.In vitroechinocandin susceptibility ofAspergillusisolates from patients enrolled in the Transplant-Associated Infection Surveillance Network[J].Antimicrob Agents Chemother,2011,55(8):3944-3946.
Comparison of susceptibility testing by EUCAST and CLSI broth microdilution methods againstAspergillusisolates
ZHANG Ming,CHEN Fei,SUN Wenkui,WU Ting,YAN Wenjie,SU Xin,SHI Yi.
(Department of Respiratory and Critical Care Medicine,Nanjing University,Clinical School of Medicine,Nanjing General Hospital of Nanjing Military Command,Nanjing210002,China)
Objective To compare the results of susceptibility testing by European Committee on Antimicrobial Susceptibility Testing(EUCAST)and Clinical and Laboratory Standards Institute(CLSI)broth microdilution methods againstAspergillusisolates.Methods The susceptibilities of 116Aspergillusisolates were determined for amphotericin B,voriconazole,itraconazole,caspofungin and micafungin according to EUCAST(E.DEF 9.1)and CLSI(M38-A2)methods.The essential agreement(EA),categorical agreement(CA),very major errors(VME)and major errors(ME)of the two methods were compared.Results The EA was 96.3%-100%between the two methods.The CA,ME,and VME were 98.8%,0-1.2%and 0 respectively for the susceptibility ofAspergillus fumigatusto voriconazole.The CA,ME and VME was 100%,0 and 0 respectively for the susceptibility ofAspergillus fumigatusandAspergillus nigerto amphotericin B,or the susceptibility ofAspergillus fumigatusandAspergillus flavusto itraconazole.Conclusions The results of susceptibility testing by EUCAST and CLSI broth microdilution methods are well consistent againstAspergillusisolates.
Aspergillus;European Committee on Antimicrobial Susceptibility Testing;Clinical and Laboratory Standards Institute;minimum inhibitory concentration;minimum effective concentration
R378
A
1009-7708(2014)04-0338-06
2013-11-07
国家自然科学基金面上项目(81270064)。
南京大学医学院临床学院(南京军区南京总医院)呼吸与危重症医学科,南京 210002。
张明(1982—),男,硕士研究生在读,主要从事呼吸内科疾病诊治工作。
施毅,E-mail:shiyi56@126.com。

