巨噬细胞极化介导闭塞性细支气管炎发生的机制研究
刘 杰,王建刚,孟庆姝,李 静,范慧敏,,周晓慧
(1.同济大学附属东方医院心外科,上海 200120;2.同济大学附属东方医院心力衰竭研究所,上海 200120)
肺移植是延长终末期肺病患者生存时间的唯一有效方法。肺移植术后面临的最大问题是闭塞性细支气管炎(obliterative bronchiolitis,OB)或者细支气管炎综合征(bronchiolitis obliterans syndrome,BOS)。OB是肺移植术后患者存活率低的主要原因,肺移植术后5年OB的发生率可达49%,术后10年则高达75%[1-2]。最近的研究认为,肺移植术后固有免疫和适应性免疫反应被激活,其相互作用导致长期持续的慢性炎症反应是形成OB的根本原因。巨噬细胞是参与机体固有免疫反应的重要成分,研究[3]发现,巨噬细胞在OB的发生和发展过程中起重要作用。IL-17是介导固有免疫和适应性免疫的桥梁。IL-17主要由新发现的Th17细胞亚群产生,gamma-delta T细胞和巨噬细胞等多种免疫细胞也可产生IL-17。已经证实Th17细胞及其产生的细胞因子IL-17参与多种自身免疫性疾病、炎症和移植排斥的发生和发展[4-5]。研究发现肺移植术后患者如出现急性排斥(OB的起始危险因素),则其支气管肺泡灌洗液中IL-17蛋白及mRNA表达水平明显升高,且升高程度与急性排斥反应的严重程度密切相关[6],后续研究证实IL-23/IL-17轴促进肺移植后OB的发生[7]。根据以上研究基础,本实验就OB不同阶段巨噬细胞的分化,以及IL-17在其中的作用进行探讨,对OB发生机制进行深入的研究,为理解OB的发生机制,提高移植患者的生存质量,延长生存期提供重要的实验依据。
1 材料与方法
1.1 实验动物
清洁级 C57BL/6,雄性,20只;BALB/c,雄性,10只,体质量20~25 g,购于上海斯莱克实验动物有限公司[许可证号SCXK(沪)2007-0005];IL-17基因敲除C57BL/6小鼠,雄性,10只,受赠于美国MD Anderson肿瘤中心董晨教授。小鼠饲养于同济大学实验动物中心,SPF级动物房。所有实验操作按照同济大学实验动物操作指南进行。
1.2 主要试剂与仪器
戊巴比妥钠粉剂购自美国Sigma公司;硫酸阿托品注射液购自上海和丰有限公司;RPMI 1640(含10%胎牛血清、100 U/ml青霉素、100 mg/ml链霉素、2 mmol/L谷氨酰胺)购自美国Gibco公司;荧光标记的抗小鼠 CD14,抗小鼠 CD80,购自美国 BD Pharmingen公司;红细胞裂解液购自美国R&D公司;Elisa试剂盒(431307)购自美国 BioLegend公司。
眼科手术显微镜(SM-2000L)购自上海轶德医疗设备有限公司;MPA生物信号采集分析系统购自上海奥尔科特生物有限公司;显微外科手术器械购自苏州医疗器械厂;4-0和9-0尼龙缝线购自上海精仪医疗器械厂;流式细胞仪为美国 BD公司FACScalibur。
1.3 动物分组及模型建立
20~25 g清洁级的 C57BL/6,雄性,20只;IL-17基因敲除 C57BL/6,雄性,10只;BALB/c雄性,10只,按体质量随机配对分为三组。实验组A为正常C57BL/6(n=10)无手术对照组;实验组B为BALB/c(n=5)→C57BL/6(n=10)组;实验组C为BALB/c(n=5)→IL-17基因敲除C57BL/6(n=10)组。建立小鼠原位气管移植,即供体小鼠麻醉后正中颈部切口,取出10个气管环分为两段,采用端端吻合技术分别植入到两只受体小鼠。术后注意保暖。
1.4 组织病理学
分离、切除移植气管,固定于10%中性甲醛溶液,常规石蜡包埋,制成3 μm厚切片,行H-E染色,观察切片。(1)移植气管内膜变化:观察内膜水肿程度,纤毛柱状上皮细胞生长和纤维组织增生情况;(2)移植气管炎症细胞浸润情况:观察炎症细胞浸润程度和细胞类型;(3)计算管腔闭塞情况:首先描出气管软骨内表面的轮廓,首尾相连,代表气管内膜线,然后描出气管实际剩余内腔面的曲线,计算二者近似面积,闭塞程度(%)=(软骨环内面积-实际剩余管腔面积)/软骨环内面积。
1.5 流式细胞术检测
研磨脾脏,收集细胞后首先进行表面标志染色,即100 μl PBS重悬细胞,加入 FITC-ANTI-CD14,PE-ANTI-CD86染色,避光4℃孵育30 min,PBS洗2次。然后300 μl PBS重悬后用流式细胞仪进行检测。数据用Cell Quest软件(BD Bioscience)分析。
1.6 统计学处理
所得所有数据均采用SPSS 13.0统计软件包处理。数据以x±s表示,采用独立样本t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 各组总体效果评价
在各组标本采集前,小鼠均存活。移植后实验组小鼠精神状态较正常对照小鼠差,但进食、活动均无异常,亦无感染。
2.2 小鼠脾脏中巨噬细胞的表型检测
流式细胞仪检查未接受气管移植的正常对照组、IL-17基因敲除组(BALB/c→IL-17基因敲除C57BL/6)小鼠脾脏巨噬细胞的表型,流式细胞仪检测实验组(BALB/c→C57BL/6)接受气管移植后7 d脾脏中单核巨噬细胞表面CD14和CD86的表达水平。结果显示,接受气管移植的小鼠中,M1型巨噬细胞的标记CD86随移植后时间的延长,逐渐下调(图1),提示巨噬细胞的极化方向与OB的进程密切相关。巨噬细胞M1方向的极化主要发生于移植后早期(7 d)并介导急性炎症反应。与正常对照组相比,IL-17基因敲除明显下调巨噬细胞表面CD86的表达水平(图2)。
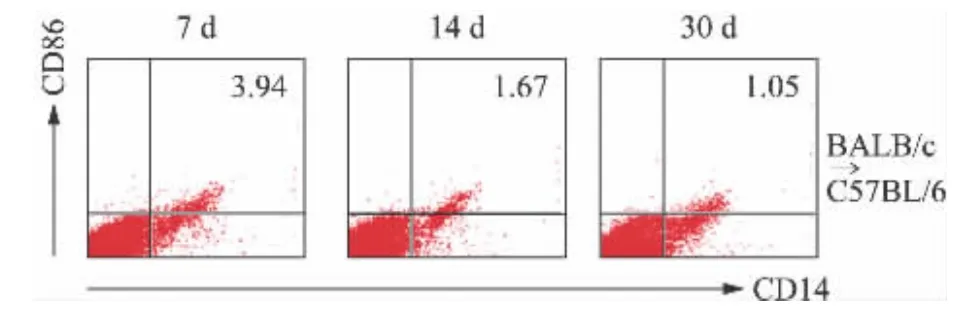
图1 BALB/c→C57BL/6移植后不同时间点巨噬细胞表型的检测Fig.1 Phenotype of spleen macrophages at different time points after transplantation
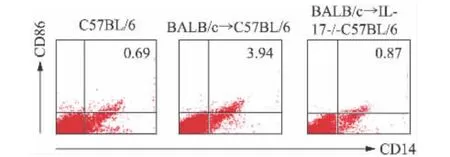
图2 正常对照组以及实验组移植后7 d巨噬细胞表型的改变Fig.2 Phenotype of spleen macrophages on 7th day after transplantation in control and experimental group
2.3 术后各组小鼠病理组织学检测
气管移植术后14、30 d取移植物进行病理学检测。与正常对照组相比,移植后7 d,异系移植组气管内膜严重水肿,内膜无纤毛柱状上皮细胞生长,无纤维组织增生,可见内膜有大量中性粒细胞、淋巴细胞浸润。术后30 d,水肿消退,气管内膜以淋巴细胞浸润为主,基质沉积、纤维增生致管腔狭窄(图3)。各组管腔的闭塞程度:对照组 10% ±2.4%,BALB/c→C57BL/6 组52% ±7.4%,BALB/c→IL-17基因敲除26% ±3.8%,组间相比,差异有统计学意义(P<0.05)。BALB/c→C57BL/6组较对照组管腔明显狭窄,BALB/c→IL-17基因敲除组较BALB/c→C57BL/6组管腔狭窄明显减轻,差异有统计学差异(P<0.05)。
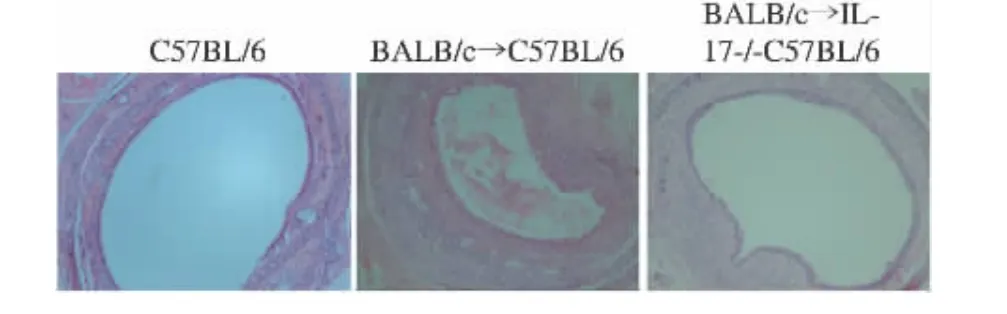
图3 气管移植物H-E染色结果Fig.3 H-E staining of representative graft sections(×100)
3 讨 论
国际心肺移植协会2011年数据显示,肺移植后5年存活率为53%,10年存活率为30%[1]。OB是肺移植术后患者存活率低的主要原因。近年发现,巨噬细胞的浸润程度与移植后急性排斥反应高低明显相关。大鼠肺移植急性排斥期可见大量巨噬细胞浸润,可增加至正常状态时的25倍[8]。巨噬细胞极化是近年来提出的一个复杂概念,包括经典激活的巨噬细胞(classical activated macrophage,M1型)和替代激活的巨噬细胞(altern-ative activated macrophage,M2型)两型[9-10]。M1 型细胞产生大量促炎症因子,如 TNFα、IL-1β、IL-6等,同时,本身作为参与免疫应答的效应细胞,促进炎症反应。M2型细胞与M1型不同,其功能表现为抑制炎症反应,参与肉芽肿的形成,最终达到组织修复的目的。本研究发现,移植后不同时相巨噬细胞的表型不同,移植后初期(7 d),巨噬细胞CD86的表达水平明显高于移植后14、30 d。前期的研究也发现,M1型巨噬细胞相关的炎症因子IL-6在移植后7 d明显升高,提示除了巨噬细胞数量的改变外,其不同的极化状态与移植排斥的发生密切相关。
IL-17是介导固有免疫和适应性免疫的桥梁。IL-17自1995年被发现以来,其在诱导炎症方面的强大功能越来越被重视。已经证实Th17细胞及其产生的细胞因子IL-17参与多种自身免疫性疾病、炎症和移植排斥的发生和发展。研究[7]发现,肺移植术后患者如出现急性排斥,其支气管肺泡灌洗液中IL-17蛋白及mRNA表达水平明显升高,且升高程度与急性排斥反应的严重程度密切相关,后续研究证实IL-23/IL-17轴促进肺移植后OB的发生。肺移植术后发生OB的小鼠血清或脾脏中IL-17A蛋白或mRNA的表达水平较未发生OB组显著上升,采用IL-17受体融合蛋白阻断IL-17与其受体结合能够降低急性排斥反应,抑制肺组织纤维化,减轻OB 的病理改变[11]。研究[12]发现,抗 IL-23 抗体能阻断Th17存活的重要细胞因子IL-23,降低体内IL-17的水平,并减轻OB的病理改变。因此,IL-17可能是促进肺移植术后OB发生的关键因素。但IL-17促进OB发生的机制研究尚处于探索阶段,深入研究IL-17介导OB发生的机制可能有利于发现新的靶点来治疗和预防OB。
有关狼疮性肾炎的研究发现,巨噬细胞极化与IL-17下游信号分子 ERK的激活有关[13]。Basha等[14]发现IL-17敲除小鼠在支气管内给予抗MHCI后,CD4阳性 T细胞较野生型小鼠减少36.8% ,CD11b阳性的巨噬细胞则减少62.7%。但是,IL-17是否调节巨噬细胞的极化过程,目前尚不清楚。
在移植肺,巨噬细胞表达TLRs,通过病原相关分子模式(pathogen associated molecular pattern,PAMP)识别病原体成分(LPS等),以及表达DDRs等受体通过损伤相关的分子模式(damage assciated molecular pattern,DAMP)识别机体自身暴露的因子(如胶原等),激活固有免疫系统诱导炎症反应。激活的DC、巨噬细胞等固有免疫细胞能提呈同种异体抗原,激活T细胞免疫介导排斥反应,另外,巨噬细胞激活固有免疫介导的炎症环境能促进效应性T细胞亚群分化,产生促炎因子,进一步加重炎症。因此,巨噬细胞是OB进程的关键因素,在介导固有免疫与适应性免疫反应以及两者相互作用方面发挥至关重要的作用。因此,抑制巨噬细胞分化及其介导的炎症反应,维持固有免疫与适应性免疫反应平衡,可能成为有效干预OB的重要方法。本研究表明,IL-17基因敲除明显下调气管移植后小鼠脾脏中CD14/CD86双阳性M1型巨噬细胞的水平,且IL-17基因敲除组病理改变明显较野生型减轻,提示IL-17可能介导巨噬细胞的极化过程并影响OB的进程。对该调节作用更为精准的阐明以及对OB发生机制的深入研究可能为OB防治开启新的希望。
[1] Christie JD,Edwards LB,Kucheryavaya AY,et al.The Registry of the International Society for Heart and Lung Transplantation:Twenty-eighth Adult Lung and Heart-Lung Transplant Report—2011[J].J Heart Lung Transplant,2011,30(10):1104-1122.
[2] Kastelijn EA,van Moorsel CH,Ruven HJ,et al.Genetic polymorphismsand bronchiolitis obliterans syndrome after lung transplantation:promising results and recommendations for the future[J].Transplantation,2012,93(2):127-135.
[3] Yao Z,Fanslow WC,Seldin MF,et al.Herpesvirus Saimiri encodes a new cytokine,IL-17,which binds to a novel cytokine receptor[J].Immunity,1995,3(6):811-821.
[4] Vanaudenaerde BM,Dupont LJ,Wuyts WA,et al.The role of interleukin-17 during acute rejection after lung transplantation[J].Eur Respir J,2006,27(4):779-787.
[5] Lee Y,Awasthi A,Yosef N,et al.Induction and molecular signature of pathogenic TH17 cells[J].Nat Immunol,2012,13(10):991-999.
[6] Liu Z,Fan H,Jiang S.CD4(+)T-cell subsets in transplantation[J].Immunol Rev,2013,252(1):183-191.
[7] Vanaudenaerde BM,De Vleeschauwer SI,Vos R,et al.The role of the IL-23/IL-17 axis in bronchiolitis obliterans syndrome after lung transplantation[J].Am J Transplant,2008,8(9):1911-1920.
[8] Gordon S,Taylor PR.Monocyte and macrophage heterogeneity[J].Nat Rev Immunol,2005,5(12):953-964.
[9] Nicod LP.Mechanisms of airway obliteration after lung transplantation[J].Proceedings Am Thoracic Soci,2006,3:444-449.
[10] MantovaniA,Sica A,Locati M.Macrophage polarization comes of age[J].Immunity,2005,23(4):344-346.
[11] Fan L,Benson HL,Vittal R,et al.Neutralizing IL-17 prevents obliterative bronchiolitis in murine orthotopic lung transplantation[J].Am J Transplant,2011,11(5):911-922.
[12] Cao H,Lan Q,Shi Q,et al.Anti-IL-23 antibody blockade of IL-23/IL-17 pathway attenuates airway obliteration in rat orthotopic tracheal transplantation[J].Int Immunopharmacol,2011,11(5):569-575.
[13] Zhang W,Xu W,Xiong S.Macrophage differentiation and polarization via phosphatidylinositol 3-kinase/Akt-ERK signaling pathway conferred by serum amyloid P component[J].J Immunol,2011,187(4):1764-1777.
[14] Basha HI,Ramachandran S,Tiriveedhi V,et al.Critical role for IL-17A/F in the immunopathogenesis of obliterative airway disease induced by Anti-MHC I antibodies[J].Transplantation,2013,95(2):293-300.

