-80℃冰箱长期冻存外周血造血干细胞研究
陆紫敏,郑伟萍,丁 懿,纪黎明,方 琦,孙向华
(1.同济大学附属同济医院输血科,上海 200065;2.同济大学附属同济医院检验科,上海 200065;3.同济大学附属同济医院血液科,上海 200065;4.同济大学附属同济医院中心实验室,上海 200065)
外周血造血干细胞移植(peripheral blood stem cells transplantation,PBSCT)是治疗难治复发白血病、恶性淋巴瘤及骨髓瘤患者、实体肿瘤等疾病有效方法之一。而保存采集的造血干细胞活力是PBSCT技术成功关键技术之一。其中以10%二甲基亚砜(dimethyl sulfoxide,DMSO)保护剂在-196℃液氮中保存细胞是经典长期保存方法,但因其操作复杂性在临床应用受到一定的限制。同济大学附属同济医院自2007年1月至2013年1月对45份采集冻存的外周血造血干细胞(peripheral blood stem cell,PBSC)进行-196℃的液氮和-80℃低温冰箱冻存研究,旨在评价外周血造血干细胞在-80℃低温冰箱中长期冻存的效果,现报告如下。
1 材料与方法
1.1 仪器与试剂
MCS+血细胞分离机购自美国血液技术公司;-80℃低温冰箱购自日本三洋公司;液氮罐购自上海五钢气体有限责任公司;XS-800i全自动血细胞分析仪购自日本Sysmex公司;EPICS XL-II流式细胞仪购自美国Coulter公司;低温保存血袋购自美国Baxter公司。
DMSO购自美国Sigma公司;胎盼蓝购自上海试剂三厂;RPMI 1640培养液购自美国Gibco公司;CD34单抗购自美国BD公司。
1.2 标本来源
外周血造血干细胞(peripheral blood stem cell,PBSC)来自于同济大学附属同济医院2007年1月至2013年1月不同病种行自体造血干细胞移植患者及患者同胞干细胞捐献者共30例,每例采集PBSC为1~2次。需要冻存PBSC共有45份(袋)。所有入组PBSC均由MCS+血细胞分离机采集,每袋采集的干细胞总量在75~150 ml间,采集前均使用重组集落刺激因子300 μg/d,皮下注射4~5 d。男21例,女9例,年龄17~61岁,中位年龄31.8岁。
1.3 分组冻存及复温
采用终浓度为10%DMSO、≥5%人血白蛋白作为细胞冷冻保存液,用RPMI 1640培养液稀释调整至每份干细胞终浓度在(1~3)×106/ml至(1~3)×108/ml范围[1]。按上述比例配置混匀后置4℃冰箱备用。在超净台中将冷冻保存液缓慢注入外周血干细胞采集袋中,同时轻轻晃动采集袋使冷冻保存液与干细胞充分混合。再将混合后采集袋的干细胞分装到200 ml低温保存血袋中,每袋装入量不超过70 ml,4℃冰箱置平衡2 h后立即置于-80℃低温冰箱。同时取1混合液于灭菌的低温保护管中,每袋留取7管其中6管入-80℃低温冰箱中保存(简称冰箱组);不采用程控降温仪,24 h后再取其中3管移到-196℃液氮罐中保存(简称液氮组)[2],1管做冻存前相关检测。由专人负责定期补充液氮。冻存标本自冰箱或液氮中取出后,直接投入40℃水浴箱中快速复温,待溶化后立即取出使用。
1.4 细胞计数检测
在冻存前、解冻后应用全自动血细胞分析仪进行单个核细胞(mononuclear cell,MNC)计数,计算单个核细胞回收率=解冻后MNC/冻存前MNC×100%。台盼蓝拒染(typeran blue resistance,TBR)法显微镜下计数细胞存活,细胞存活率=解冻后活细胞数/冻存前活细胞数×100%。在冻存前、解冻后应用流式细胞仪进行检测CD34+细胞计数,计算CD34+细胞回收率=解冻后CD34+细胞数/冻存前CD34+细胞数×100%。
1.5 统计学处理
2 结 果
2.1 外周血干细胞不同冻存方法的效果比较
液氮组冻存干细胞1、2、3年后的MNC、CD34+细胞计数及台盼蓝拒染率(细胞活性)与冻存前比较差异均无统计学意义,冰箱组冻存干细胞1、2、3年后的MNC、CD34+细胞计数与液氮组比较差异无统计学意义,(P>0.05),见表1。
表1 外周血干细胞不同冻存方法的效果比较Tab.1 Comparison of different cryopreservation methods For peripheral blood stem cells ±s)
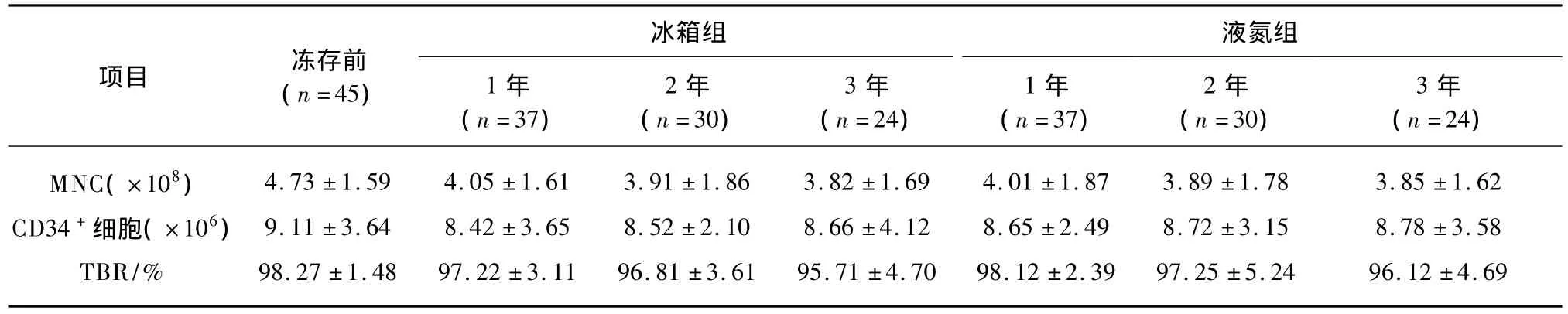
表1 外周血干细胞不同冻存方法的效果比较Tab.1 Comparison of different cryopreservation methods For peripheral blood stem cells ±s)
项目 冻存前(n=45)液氮组1年(n=37)冰箱组2年(n=30)3年1年2年3年(n=24)(n=37)(n=30)(n=24)MNC(×108) 4.73 ±1.59 4.05 ±1.61 3.91 ±1.86 3.82 ±1.69 4.01 ±1.87 3.89 ±1.78 3.85 ±1.62 CD34+细胞(×106) 9.11 ±3.64 8.42 ±3.65 8.52 ±2.10 8.66 ±4.12 8.65 ±2.49 8.72 ±3.15 8.78 ±3.58 TBR/% 98.27 ±1.48 97.22 ±3.11 96.81 ±3.61 95.71 ±4.70 98.12 ±2.39 97.25 ±5.24 96.12 ±4.69
2.2 冰箱组和液氮组不同时间冻存后细胞回收率比较
冰箱组冻存干细胞2、3年后单个核细胞回收率与冻存1年后比较差异无统计学意义(P>0.01),冰箱组冻存1、2、3年后单个核细胞回收率与液氮组比较差异均无统计学意义(P>0.01),与冻存1年后比较,2组冻存干细胞3年后的CD34+细胞回收率增高差异均有统计学意义(P<0.01),见表2。
表2 冰箱组和液氮组不同时间冻存后细胞回收率比较Tab.2 Comparison of cell recovery rate after cryopreservation between two groups at different time points(±s)
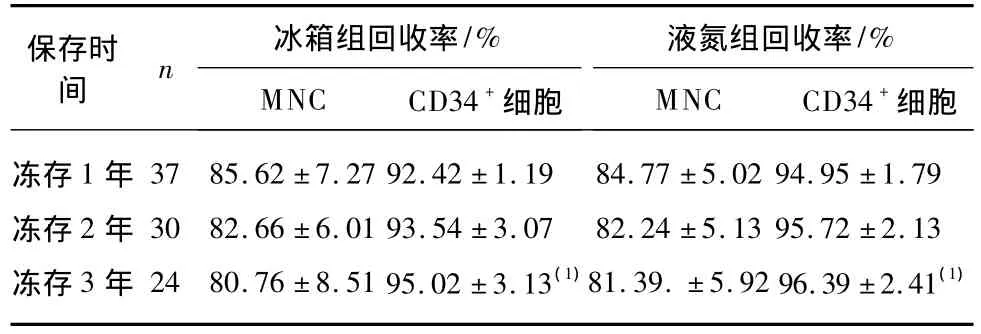
表2 冰箱组和液氮组不同时间冻存后细胞回收率比较Tab.2 Comparison of cell recovery rate after cryopreservation between two groups at different time points(±s)
与冻存1年比较,(1)P<0.01
保存时间 n 冰箱组回收率 液氮组回收率/%MNC CD34+细胞冻存1 年 37 85.62 ±7.27 92.42 ±1.19 84.77 ±5.02 94.95 ±1.79冻存2 年 30 82.66 ±6.01 93.54 ±3.07 82.24 ±5.13 95.72 ±2.13冻存 3 年 24 80.76 ±8.51 95.02 ±3.13(1)81.39.±5.92 96.39 ±2.41(1)细胞/%MNC CD34+
3 讨 论
随着造血干细胞(hematopoietic stem cell,HSC)移植技术临床广泛的应用,最初的骨髓干细胞移植发展为外周血造血干细胞移植。在移植过程中如何经济、高效地体外保存外周血造血干细胞活力,直接关系到移植成败[3-4],一直是临床医师需要解决的问题。目前HSC的体外保存方法有3种,即4℃非冷冻保存、-196℃液氮和-80℃冰箱冷冻保存。4℃非冷冻保存简便易行,但保存时间仅为3~5 d。-196℃液氮和-80℃冰箱均为冷冻保存,前者能够长期有效地冻存干细胞已是国内外学者达成共识,但由于-196℃的液氮保存法设备要求高、操作复杂、并需专人负责定期补充液氮,费用昂贵,使得临床常规开展受限。后者冻存HSC在临床上已逐步得到应用[5],而关于 -80℃长期有效冻存 HSC的报道甚少。本研究对45份采集冻存的外周血造血干细胞分别进行-196℃的液氮和-80℃低温冰箱的3年冻存,两组所采用的每份冻存液是一致的,均以终浓度为10%二甲亚砜(DMSO)、≥5%人血白蛋白作为细胞冷冻保存液,用RPMI1640培养液稀释调整至每份干细胞浓度在(1~3)×106/ml至(1~3)×108/ml范围。研究结果显示:冰箱组干细胞冻存3年后MNC和CD34+细胞计数、台盼蓝拒染率与冻存前比较,差异均无统计学意义,冰箱组干细胞冻存3年后单个核细胞回收率与冻存1年后比较差异无统计学意义(P>0.01)。这说明采用-80℃作为贮存温度是具有较高的干细胞回收率及存活率,并且也显示了-80℃低温冰箱保存法能够较长时间保存干细胞的活性。本研究结果还发现冰箱组干细胞冻存1、2、3年后的MNC、CD34+细胞计数与液氮组比较差异均无统计学意义,冰箱组1年、2年、3年细胞台盼蓝拒染率分别为97.22%、96.81%、95.71%,与液氮组比较差异无显著意义。这表明在3年内,采用-80℃低温冰箱保存法和采用-196℃的液氮保存法对造血干细胞的影响差异无统计学意义,其冻存效果基本一致,也体现了这2组细胞生物代谢在低温中近乎完全停止的特点是基本一致的;同时表明了本研究所采用的细胞冷冻保存液方案无论是在冰箱组还是在液氮组均可有效应用于PBSC的保存。-80℃低温保存法以操作简便、设备简单、安全有效、冷冻费用低廉为特点优于-196℃液氮保存法,其3年冻存时间又能保持高效的干细胞活性,值得临床推广使用。
临床上评价HSC保存效果主要是用体外方法检测干细胞样本的MNC、CD34+细胞计数及台盼蓝拒染率(细胞活性)。许多研究发现MNC计数、台盼蓝拒染率及CD34+细胞计数是临床上常用的预测重建造血的重要指标[6],尤其是外周血CD34+细胞可以对造血/祖细胞采集量有很好的预测[7]。在本研究中,冰箱组和液氮组的HSC随着冷冻时间的延长,CD34+细胞检测的相对数逐渐增高,2组冻存的HSC3年后CD34+细胞回收率增高与冻存1年后CD34+细胞回收率比较差异有统计学意义(P<0.01),这可能与本研究加入人血白蛋白及采用干细胞冻存终浓度有关,人血白蛋白能使细胞脱水,减少冷冻过程中胞内冰晶形成,阻止复温时细胞凝集,维持细胞膜的稳定性,提示本研究所采用的细胞冷冻保存液方案具有理想效果。但这结论与Xu等[6]的报道有些不同,需要进一步研究探讨其中原因,这也反映了CD34+表达作为预测造血干细胞活性标记的复杂性,CD34+表达是否能完全代表造血干细胞活力还有待进一步大样本研究。
[1] Kudo Y,Minegishi M,Itoh T,et al.Evaluation of hematological reconstitution potentialofautologous peripheral blood progenitor cells cryopreserved by a simple controlled-rate freezing method[J].Tohoku J Exp Med,2005,205(1):37-43.
[2] Almici C,Ferremi P,Lanfranchi A,et al.Uncontrolledrate freezing of peripheral blood progenitor cells allows successful engraftment by sparing primitive and committed hematopoietic progenitors[J].Haematologica,2003,88(12):1390-1395.
[3] 徐长根,朱阳泉,李浩,等.-80℃下不同冻存时间对脐血造血干细胞保存效果的影响[J].临床输血与检验,2010,12(2):104-106.
[4] 覃春捷,陈宏.-80℃简易冻存外周造血干细胞临床应用观察[J].吉林医学,2011,32(16):3187-3188.
[5] Rowley SD,Feng Z,Chen L,et al.A randomized phase III clinical trial of autologous blood stem cell transplantation comparing cryopreservation using dimethylsulfoxide vs dimethylsulfoxide with hydroxyethylstarch [J].Bone Marrow Transplant,2003,31(11):1043-1051.
[6] 许利民,王劲,洪淋,等.脐血造血干细胞不同温度长期冻存效果的实验研究[J].中国现代医学杂志,2007,17(24):3034-3039.
[7] 刘暖,吴丽娟,刘毓刚,等.流式细胞术/祖细胞分类计数在自体干细胞移植治疗恶性血液系统疾病中的应用[J].国际检验医学杂志,2011,32(20):2310-2312.

