COPD急性加重期患者血清IL-6、CRP水平变化及意义
张 璐,李 秀
(安徽医科大学第三附属医院,合肥230061)
慢性阻塞性肺疾病(COPD)是一种常见的慢性呼吸系统疾病。研究证实,COPD主要累及肺脏,但也可引起全身性病理改变,如全身性炎症反应、营养不良、骨骼肌功能不良等,严重影响COPD的转归及患者的生活质量[1]。COPD急性加重是COPD患者死亡的重要因素[2]。血清IL-6、CRP是临床常用于检测炎症反应的指标。2013年4~9月,我们对COPD急性加重期(AECOPD)患者血清 IL-6、CRP水平进行了检测,探讨血清 IL-6、CRP在AECOPD发生发展过程中的变化及临床意义。
1 资料与方法
1.1 临床资料 选取在我科住院的AECOPD患者78例作为观察组,男60例、女18例,年龄(77.2±9.4)岁。诊断均符合中华医学会制定的2013年修订版《慢性阻塞性肺疾病诊治指南》中AECOPD诊断标准[1]。根据FEV1水平、病情加重的时间及神志变化等将入选患者分为轻度28例、中度26例、重度24例。排除标准:①合并严重心、脑、肾、肝脏等其他疾病;②合并精神疾病;③应用免疫抑制剂;④合并气胸、肺栓塞、肺肿瘤等其他呼吸系统疾病;⑤近期曾服用激素类药物。选取同期来我院进行健康体检的健康者64例作为对照组,其中男34例、女30例,年龄(72.1±7.6)岁。两组年龄、性别比例差异无统计学意义。以上研究对象均签署知情同意书。
1.2 治疗方法 观察组入院后2 h内予相应治疗(需入住ICU患者在入院10 min内立即给予所需治疗),包括氧疗、无创机械通气、静脉应用支气管扩张剂及糖皮质激素、雾化吸入支气管扩张剂及糖皮质激素、抗凝治疗等。
1.3 观察指标 观察组于入院当日或次日及出院前清晨抽静脉血3 mL(对照组于体检当日抽血),2 000 r/min离心15 min,分离血清。采用电发光免疫分析法检测两组血清IL-6水平,采用免疫比浊法检测CRP水平。
2 结果
2.1 两组血清IL-6、CRP水平比较 观察组治疗前后血清IL-6、CRP水平均高于对照组(P<0.05);观察组治疗后血清IL-6、CRP水平均低于治疗前(P<0.05),见表1。
2.2 不同病情程度 AECOPD患者血清IL-6、CRP水平比较 治疗前,重度AECOPD患者血清IL-6、CRP水平均高于轻度及中度患者(P<0.05);治疗后,重度AECOPD患者血清IL-6、CRP水平均高于轻度及中度患者(P<0.05)。同程度患者治疗后血清IL-6、CRP水平均低于治疗前(P<0.05)。见表2。
表1 两组血清IL-6、CRP水平比较(±s)

表1 两组血清IL-6、CRP水平比较(±s)
注:与对照组比较,*P <0.05;与治疗前比较,#P <0.05
组别 n IL-6(pg/mL) CRP(mg/L)78治疗前 76.05 ±26.54* 46.34 ±12.32*治疗后 12.54 ± 4.98*# 8.63 ± 2.53*#对照组观察组64 5.68 ± 2.17 6.46 ± 1.15
表2 不同病情程度AECOPD患者血清IL-6、CRP 水平比较(±s)
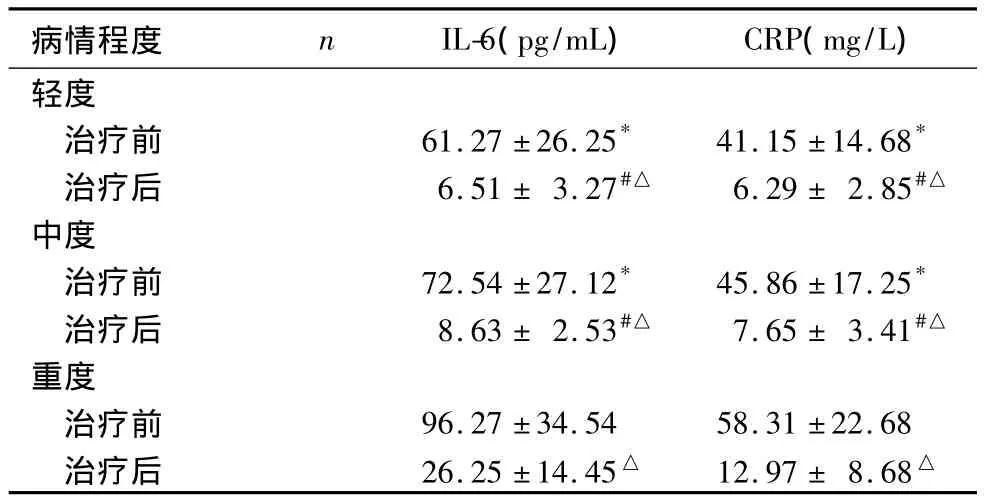
表2 不同病情程度AECOPD患者血清IL-6、CRP 水平比较(±s)
注:与重度者治疗前比较,*P<0.05;与重度者治疗后比较,#P<0.05;与同程度者治疗前比较,△P <0.05
病情程度 n IL-6(pg/mL) CRP(mg/L)轻度治疗前 61.27 ±26.25* 41.15 ±14.68*治疗后 6.51 ± 3.27#△ 6.29 ± 2.85#△中度治疗前 72.54 ±27.12* 45.86 ±17.25*治疗后 8.63 ± 2.53#△ 7.65 ± 3.41#△重度治疗前 96.27 ±34.54 58.31 ±22.68治疗后 26.25 ±14.45△ 12.97 ± 8.68△
3 讨论
COPD患者从疾病初期到出现心肺等重要脏器严重损伤是一个缓慢的发展过程。AECOPD是指COPD患者以呼吸道症状加重为特征的临床事件[1]。据统计,COPD 患者每年可发生0.5~3.5次的急性加重;而急性加重可导致肺功能恶化,降低患者的生活质量,是COPD患者死亡的重要因素。临床上,寻找简单易测的炎性指标,有利于判断AECOPD的发生,从而对COPD患者进行早期诊断、早期治疗、早期干预,以阻止或延缓AECOPD的发生。
IL-6是一种具有多种生物活性的细胞因子,当炎症与应激反应发生时,可诱导肝脏产生多种急性期蛋白,是急性期反应合成的重要炎症介质,在COPD气道炎症发生发展以及气流受限中起着至关重要的作用,参与COPD的气道炎症反应和气道重塑[3]。胡蓉[4]研究发现,AECOPD 患者血清IL-6水平明显高于正常对照组,提示IL-6参与了 AECOPD的炎症反应。Barczyk等[3]发现,AECOPD患者痰液、血液及支气管肺泡灌洗液中IL-6水平明显高于健康对照组,其机制可能是IL-6诱导T淋巴细胞释放IL-17,最终导致炎症加剧和气道重塑。Attaran等[5]也发现,AECOPD患者的血浆IL-6水平高于正常对照组,并与肺功能气流受限指标FEV1呈负相关,提示IL-6不仅参与了AECOPD的炎症过程,还可反映病情的严重程度。
CRP是反映全身炎症反应的客观指标,其在健康人血清中呈低水平表达,当机体存在炎症或损伤时,CRP升高,当病变消退时又迅速降至正常水平,且不受抗炎药物、免疫抑制剂、激素等影响,可作为急性炎症损伤程度及评价治疗效果的客观指标[6]。CRP在心血管疾病中的作用已被证实,但在AECOPD中的作用尚待研究证实。研究发现,AECOPD患者气道炎症越重,CRP升高越明显,CRP与AECOPD 病情严重程度呈正相关[7,8]。王燕冰等[9]用胶乳增强免疫比浊法测定AECOPD患者血清hs-CRP,结果显示AECOPD患者血清hs-CRP高于正常对照组,且AECOPD患者血清hs-CRP水平与肺功能损伤的严重程度呈正相关;治疗后病情好转,血清hs-CRP水平也降低。因此,CRP可作为早期判断AECOPD患者病情严重程度和治疗疗效的观察,是判断炎症转归的客观指标。
本研究发现,AECOPD患者血清 IL-6、CRP水平高于对照组,提示AECOPD患者存在全身性炎症反应,这与目前大多的临床研究相符[9~12]。导致AECOPD患者出现全身性炎症反应的原因尚不清楚,目前主要倾向于以下两种学说:①溢出论:COPD患者肺内炎症是全身性炎症反应的根源,即肺内的炎症细胞及其释放的炎症介质溢出到血液循环导致全身性炎症反应[13,14];②系统性炎症论:COPD全身性炎症反应并非仅仅是肺部局部炎症反应的肺外效应,而是既受局部炎症反应的影响又独立存在的一个病理生理过程[15],且可增加COPD患者全身并发症的发生风险,同时加剧肺部病变[16]。
本研究发现,AECOPD患者治疗后血清IL-6、CRP水平低于治疗前,且重度AECOPD患者血清IL-6、CRP水平高于轻、中度患者,提示 IL-6、CRP参与了AECOPD的炎症发生、发展过程,可作为判断AECOPD病情及预后的良好指标[10~12]。
目前已有证据表明肺部炎症与系统性炎症存在相关性,但这些研究大多来自体外实验或动物实验,本研究样本量较小,AECOPD全身性炎症反应的产生机制仍需进行更多的深入研究。
[1]中华医学会呼吸病学.慢性阻塞性肺疾病诊治指南(2013年修订版)[J].中华结核和呼吸杂志,2013,36(4):255-264.
[2]Vestbo J,Hurd SS,Agustí AG,et al.Global strategy for the diagnosis,management,and prevention of chronic obstructive pulmonary disease:GOLD executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[3]Barczyk A,Pierzchala W,Kon OM.Cytokine production by bronchoalveolar lavage T lymphocytes in chronic obstructive pulmonary disease[J].J Allergy Clin Immunol,2006,117(6):1487-92.
[4]胡蓉.COPD 患者治疗前后血清 hs-CRP、TNF-α、IL-6、IL-8 检测的临床意义[J].放射免疫学杂志,2007,20(6):503-505.
[5]Attaran D,Lasi SM,Towhidi M,et al.Interleukin-6 and airflow limitation in chemical warfare patients with chronic obstructive pulmonary disease[J].Chron Obstruct Pulmon Dis,2010,5(5):335-340.
[6]Ramamoorthy RD,Nallasamy V,Reddy R,et al.A review of C-reactive protein:a diagnostic indicator in periodontal medicine[J].J Pharm Bioallied Sci,2012,4(2):422-426.
[7]Pinto-Plata VM,Mullerova H,Toso JF,et al.C-reactive protein in patients with COPD,control smokers and non-smokes[J].Thorax,2006,61(1):23-28.
[8]de Torres JP,Cordoba-Lanus E,López-Augilar C,et al.CRP levels and clinically important p redictive outcomes in stable COPD patients[J].Eur Respir J,2006,27(5):902-907.
[9]王燕冰.超敏C反应蛋白在COPD病程中的检测及其临床意义探讨[J].辽宁医学院学报,2013,34(1):26-27.
[10]龙仕居,陈忠仁.慢性阻塞性肺疾病患者急性加重期与缓解期痰液及血清IL-6、IL-8、TNF-a表达水平的差异机其临床意义[J].重庆医学,2012,41(19):1970-1972.
[11]周晓峰,刘醙,李宏飞,等.COPD急性加重期CRP、WBC、中性粒细胞比例检测的意义及比较[J].中国现代医生,2009,47(16):106-107.
[12]Lee TM,Lin MS,Chang NC.Usefulness of C-reactive protein and interleukin-6 as predictors of outcomes in patients with obstructive pulmonary disease receiving pravastatin[J].Am J Cardiol,2008,101(4):530-535.
[13]Pinto-Plata VM,Livnat G,Girish M,et al.Systemic cytokines,clinical and physiological changes in patients hospitalized for exacerbation of COPD[J].Chest,2007,131(1):37-43.
[14]Sin DD,Leung R,Gan WQ,et al.Circulating surfactant protein D as a potential lungspecific biomarker of health outcomes in COPD:a pilot study[J].BMC Pulm Med,2007,7:13.
[15]Donaldso GC,TA S,IS P,et al.Airway and systemic inflammation and decline in lung function in patients with COPD[J].Chest,2005,128(4):1995-2004.
[16]Groenewegen KH,Postma DS,Hop Wc,et al.Increased systemic inflammation is a risk factor for COPD exacerbations[J].Chest,2008,133(2):350-357.

