雷公藤甲素对高糖刺激足细胞转分化的影响
赵小丽,徐建伟,刘丽秋
(1青岛大学医学院,山东青岛266021;2青岛市第八人民医院;3青岛大学附属医院)
糖尿病肾病是终末期肾脏病的常见原因。近年研究显示,高糖环境可诱导足细胞发生上皮细胞—间充质细胞转分化,可能在糖尿病肾病发生发展中发挥重要作用[1,2]。足细胞转分化的机制尚未明确,研究发现转化生长因子(TGF)/Smad通路是介导转分化的重要信号转导通路。雷公藤甲素(TP)能明显减少糖尿病鼠蛋白尿,减轻肾小球肥大及足细胞损伤,可以通过调节Smad信号途径减轻肾脏纤维化程度[3]。2012年3月~2013年4月,我们观察了TP对高糖刺激小鼠足细胞转分化及Smad信号表达的影响,探讨TP的肾脏保护作用及可能机制。现报告如下。
1 材料与方法
1.1 材料 小鼠永生化足细胞系MPC5由山东大学药理实验室培养,山东大学中心实验室转赠。TP由上海融禾医药科技发展有限公司提供,纯度>99%。RPMI-1640培养基、胰蛋白酶和胎牛血清购自Hyclone公司,重组小鼠γ-干扰素购自Peprotech公司,Trizol试剂购自Invitrogen公司,引物由上海生工公司合成,RT-PCR试剂盒与SYBR Premix Ex Taq购自大连宝生物工程有限公司,兔抗Smad3、Smad7多克隆抗体购自Abcam公司,兔抗结蛋白(Desmin)抗体购自Santa Cruz公司,兔抗突触极蛋白(Synaptopodin)抗体、兔抗GAPDH抗体和HRP标记山羊抗兔IgG购自北京博奥森公司。
1.2 足细胞培养与干预 参照文献[4]方法培养足细胞。细胞复苏后置于含10%胎牛血清、10 U/mL γ-干扰素、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640培养液中,33℃、5%CO2细胞培养箱中培养,隔天换液。3 d后转入不含γ-干扰素的10%胎牛血清1640培养液中,37℃培养10~14 d,待细胞分化成熟后使用。将成熟的细胞以5×105/mL的密度接种于25 cm2的培养瓶中,待细胞融合至70% ~80%时,于无血清的培养液中饥饿24 h使细胞同步化。细胞分为五组,分别加入下列试剂:正常组加入D-葡萄糖5.5 mmol/L,高糖组加入D-葡萄糖30 mmol/L,TP低剂量组加入D-葡萄糖30mmol/L+TP 3 ng/mL,TP高剂量组加入D-葡萄糖30 mmol/L+TP 10 ng/mL,甘露醇组加入D-葡萄糖5.5 mmol/L+甘露醇24.5 mmol/L。各组干预时间均为48 h。
1.3 观察指标
1.3.1 Smad3、Smad7、Synaptopodin、Desmin mRNA表达 采用荧光定量PCR法。按照Trizol试剂说明书提取各组细胞总RNA,然后利用260 nm的吸光度测定OD值和RNA浓度,按照RT-PCR试剂盒说明书进行逆转录合成cDNA。逆转录条件:37℃ 15 min,85℃ 5 s。按照 SYBR Premix Ex Taq说明书Light Cycler Real Time PCR扩增仪上进行SYBR GreenⅠ实时定量PCR反应,反应条件为:95℃ 30 s预变性,然后95℃ 5 s,60℃ 30 s重复40个循环。每个样品设2个复孔,同时设无模板阴性对照。Smad3引物序列F:5'-GTCAACAAGTGGTGGCGTGTG-3',R:5'-GCAGCAAAGGCTTCTGGGATAA-3',扩增产物长度150 bp。Smad7引物序列F:5'-TCCTGCTGTGCAAAGTGTTC-3',R:5'-AGTAAGGAGGAGGGGGAGAC-3',扩增产物长度165 bp。Synaptopodin引物序列 F:5'-AGACGACAGTTTGGAGAGAAGG-3',R:5'-GCTGGGATACAGAGTGGAGTAA-3',扩增产物长度255 bp。Desmin引物序列 F:5'-TGCAGCCACTCTAGCTCGTA-3',R:5'-GACATGTCCATCTCCACCTG-3',扩增产物长度150 bp。GAPDH引物序列F:5'-CTCATGACCACAGTCCATGC-3',R:5'-CACATTGGGGGTAGGAACAC-3',扩增产物长度201 bp。PCR产物进行1%琼脂糖凝胶电泳,确定产物特异性。以GAPDH为内参基因,以正常组为对照,采用2-△△CT法测定 Smad3、Smad7、Synaptopodin、DesminmRNA 相 对 表 达 量,ΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)正常组。以上实验均重复3次。
1.3.2 Smad3、Smad7、Synaptopodin、Desmin 蛋白表达 采用Western blot法。收集各组细胞,提取蛋白于95℃变性5 min。取上清,各组蛋白和Marker分别上样,10%SDS-聚内烯酰胺凝胶电泳分离后转移至硝酸纤维素膜上,用含5%脱脂奶粉封闭后以兔抗 Smad3、Smad7、Synaptopodin、Desmin、GAPDH 多克隆抗体分别4℃孵育过夜(分别按1∶600、1∶600、1∶200、1∶500、1∶1 000 稀释)。洗膜后用辣根过氧化物酶标记的二抗(1∶8 000)室温孵育1 h,ECL显影,凝胶成像系统分析,Quantity One4.6.2扫描各组光密度值,以 Smad3、Smad7、Synaptopodin、Desmin 条带与内参GAPDH条带的光密度值比值代表各蛋白的相对表达量。以上实验均重复3次。
1.4 统计学方法 采用SPSS17.0统计软件,数据以±s表示,多组间比较采用单因素方差分析,两两比较用q检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组 Smad3、Smad7、Synaptopodin、Desmin mRNA表达 TP低剂量组、TP高剂量组 Smad3、Desmin mRNA表达低于高糖组(P<0.05),Smad7、Synaptopodin mRNA表达高于高糖组(P<0.05),正常组与甘露醇组相比,各因子表达量差异无统计学意义。见表1。
2.2 各组 Smad3、Smad7、Synaptopodin、Desmin 蛋白表达 与正常组比较,高糖组足细胞Smad3、Desmin表达增多、Smad7、Synaptopodin表达减少(P<0.05)。TP低剂量组、TP高剂量组、甘露醇组足细胞Smad3、Desmin蛋白表达低于高糖组(P<0.05),Smad7、Synaptopodin蛋白表达高于高糖组(P<0.05),正常组与甘露醇组相比,各因子表达量差异无统计学意义。见图1、表2。
3 讨论
蛋白尿不仅是糖尿病肾病的重要临床特征,其持续存在也是加速糖尿病肾病进展的危险因素之一。足细胞作为肾脏滤过屏障的重要组成部分,其结构和功能异常是蛋白尿发生的重要原因。近年研究显示,肾小球滤过屏障结构和功能的改变,尤其是足细胞及其相关蛋白的改变与蛋白尿的产生和发展密切相关,可能在糖尿病肾病的发生与进展过程中起重要作用。研究发现,足细胞在许多病理状态下可以发生转分化,出现间充质标志物α-平滑肌肌动蛋白(α-SMA)、Desmin、纤连蛋白(FN)等表达上调,发生转分化的足细胞易于从基底膜上脱落,造成滤过屏障的不完整,导致蛋白尿的形成[5]。
表1 各组Smad3、Smad7、Synaptopodin及Desmin mRNA相对表达量比较(±s)

表1 各组Smad3、Smad7、Synaptopodin及Desmin mRNA相对表达量比较(±s)
注:与正常组比较,*P <0.05,△P >0.05;与高糖组比较,﹟ P <0.05
Smad3 Smad7 Synaptopodin Desmin正常组组别1.01 ±0.21 1.01 ±0.19 1.01 ±0.18 1.00 ±0.04高糖组 4.45 ±0.26* 0.28 ±0.06* 0.32 ±0.05* 4.27 ±0.16*TP低剂量组 3.14±0.14*﹟ 0.59±0.11*﹟ 0.45±0.11* 3.27±0.01*﹟TP高剂量组 1.73±0.15*﹟ 0.80±0.14*﹟ 0.67±0.17*﹟ 1.68±0.13*﹟甘露醇组 0.96±0.14△﹟ 1.03±0.15△﹟ 0.94 ±0.18△﹟ 1.07±0.05△﹟
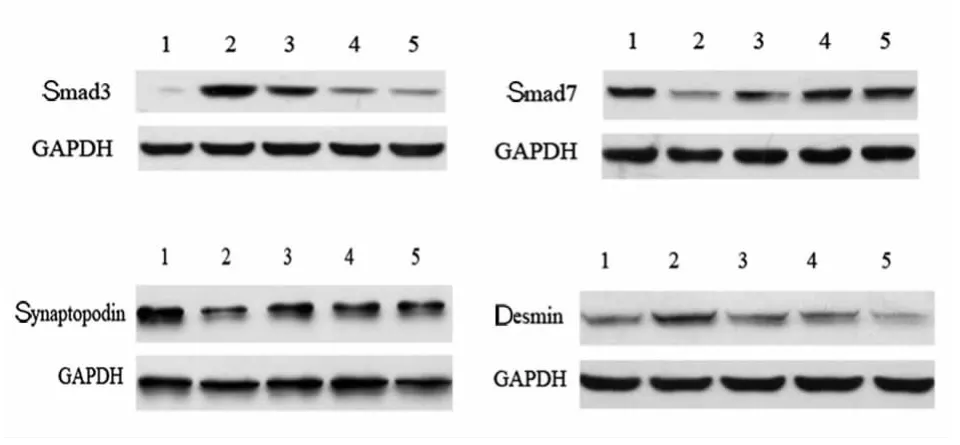
图1 各组足细胞Smad3、Smad7、Synaptopodin、Desmin蛋白表达
表2 各组Smad3、Smad7、Synaptopodin及Desmin蛋白表达比较(相对表达量,±s)

表2 各组Smad3、Smad7、Synaptopodin及Desmin蛋白表达比较(相对表达量,±s)
注:与正常组比较,*P <0.05,△P >0.05;与高糖组比较,﹟ P <0.05
Smad3 Smad7 Synaptopodin Desmin正常组组别0.20 ±0.02 0.79 ±0.07 0.78 ±0.09 0.35 ±0.03高糖组 0.77 ±0.10* 0.29±0.05﹡ 0.38±0.03﹡ 0.65±0.03﹡TP 低剂量组 0.57±0.02*﹟ 0.59±0.04*﹟ 0.49±0.02* 0.56±0.02*﹟TP 高剂量组 0.36±0.02*﹟ 0.64±0.05*﹟ 0.60±0.02*﹟ 0.47±0.06*﹟甘露醇组 0.23 ±0.04△﹟ 0.80±0.05△﹟ 0.83±0.07△﹟ 0.33±0.02△﹟
目前足细胞转分化的机制尚未明确。TGFβ/Smad信号通路是介导肾脏纤维化最重要的信号转导途径,TGFβ1通过结合并激活具有丝氨酸/苏氨酸激酶活性的跨膜受体,进而催化其下游信号分子Smads磷酸化而发挥生物学作用[6,7]。糖尿病肾病时TGFβ1表达增加并激活其下游Smad2、Smad3,介导肾小管上皮转分化及肾脏纤维化发展[8]。Samd7是TGFβ/Smad信号通路重要的负反馈抑制因子,可以通过拮抗 TGFβ/Smad通路而发挥肾脏保护作用[9]。研究证实下调 Smad3的表达及上调Smad7的表达可以抑制肾小管上皮细胞转分化[10,11]。我们前期研究发现,体外给予高糖刺激可下调足细胞Smad7表达,促进足细胞转分化,提示Smad蛋白表达异常可能是足细胞发生转分化的重要机制[12]。Synaptopodin是一种富含脯氨酸的肌动蛋白结合蛋白,表达于分化成熟的足细胞。Desmin是O-唾液酸糖蛋白家族成员,其大量表达提示足细胞发生转分化。本研究发现,与正常组比较,高糖组足细胞Smad3、Synaptopodin mRNA及蛋白表达增多,Smad7、Desmin mRNA及蛋白表达减少,提示高糖刺激可以在转录水平和蛋白水平上调节足细胞Smad3表达,下调Smad7表达,并且使成熟足细胞标志物Synaptopodin表达减少,而间充质标志物Desmin表达增多;正常组与甘露醇组相比,足细胞 Smad3、Smad7、Desmin、Synaptopodin表达量的差异无统计学意义,提示高糖刺激而非高渗刺激可以影响足细胞Smad蛋白表达,诱导足细胞转分化。
雷公藤具有免疫抑制、抗炎及抗肿瘤的作用,在多种肾小球疾病,如微小病变、局灶节段性肾小球硬化和膜性肾病的治疗中显示了独特的功效。TP是雷公藤有效成分之一,对Heymann肾炎具有显著的治疗作用,能有效减少蛋白尿,减轻肾组织免疫损伤,促进足细胞病变和裂孔膜蛋白结构的修复[13]。研究表明TP可以通过抑制系膜细胞Smad3的表达及核转位,上调Smad7,抑制TGFβ1诱导的肾小球系膜细胞的增殖,减轻肾脏纤维化,还可以通过上调Ski,抑制 TGFβ1、Smad3 的表达,改善单侧输尿管梗阻大鼠肾脏纤维化,提示TP可以通过调节Smad蛋白的表达抑制肾脏纤维化过程。本研究发现,TP低剂量组、TP高剂量组足细胞Smad3、Desmin mRNA及蛋白表达均低于高糖组,Smad7、Synaptopodin mRNA及蛋白表达均高于高糖组,提示TP干预可以抑制高糖刺激诱导的Smad3、Smad7表达异常,部分恢复Synaptopodin表达,减少Desmin表达,从而调节足细胞TGFβ/Smad信号通路而抑制足细胞转分化。
综上所述,TP可以在转录水平和蛋白水平抑制高糖刺激的足细胞Smad3表达,上调Smad7表达,并抑制足细胞转分化,为TP应用于临床治疗糖尿病肾病提供了理论依据。
[1]Yamaguehi Y,Iwano M,Suzuki D,et al.Epithelial mesenchymal transition as a potential explanation for podocyte depletion in diabetie nephropathy[J].Am J Kidney Dis,2009,54(4):653-664.
[2]刘青娟,张玉军,李建英,等.高糖对小鼠足细胞表型转化的诱导作用及机制探讨[J].山东医药,2013,53(34):22-24.
[3]Qing G,Wenwen S,Weisong Q,et al.Treatment of db/db diabetic mice with triptolide:a novel therapy for diabetic nephropathy[J].Nephrol Dial Transplant,2010,25(11):3539-3547.
[4]Mundel P,Reiser J,Zuniga M,et al.Rearrangements of the cytoskeleton and cell contacts induce process formation during differentiation of conditionally immortalized mouse podocytes cell lines[J].Exp Cell Res,1997,236(1):248-258.
[5]Li Y,Kang YS,Dai C,et al.Epithelial-to-mesenchymal transition is a potential pathway leading to podocyte dysfunction and proteinuria[J].Am J pathol,2008,172(2):299-308.
[6]Liu Y.Epithelial to mesenchymal transition in renal fibrogenesis:pathologic signifi-cance,molecular mechanism,and therapeutic intervention[J].J Am Soc Nephrol,2004,15(1):1-12.
[7]Bottinger EP,Bitzer M.TGF-β signaling in renal disease[J].J Am Soc Nephrol,2002,13(10):2600-2610.
[8] Claire EH,Paul ES.TGFβ1-induced epithelial-to-mesenchymal transition and therapeutic intervention in diabetic nephropathy[J].Am J Nephrol,2010,31(1):68-74.
[9]SM K,YC Y,XR H,et al.Kidney-targeting Smad7 gene transfer inhibits renal TGF-β/MAD homologue(SMAD)and nuclear factor(NF-κB)signalling pathways,and improves diabetic nephropathy in mice[J].Diabetologia,2012,55(2):509-519.
[10]Yang F,Huang XR,Chung AC,et al.Essential role for Smad3 in angiotensinⅡ-induced tubular epithelial-mesenchymal transition[J].J Pathol,2010,221(4):390-401.
[11]Li JH,Zhu HJ,Huang XR,et al.Smad7 inhibits fibrotic effect of TGF-β on renal tubular epithelialcells by blocking Smad2 activation[J].J Am Soc Nephrol,2002,13(6):1464-1472.
[12]徐晶,刘丽秋,徐跃磊.高糖诱导足细胞Smad7表达改变及骨形成蛋白7的干预作用[J].中华肾脏病杂志,2013,29(3):223-224.
[13]Chen Z,Qin W,Zeng C,et al,Triptolide reduces proteinuria in experimental membranous nephropathy and protects against C5b-9-induced podocyte injury in vitro[J].Kidney Int,2010,77(11):974-988.

