单核细胞趋化蛋白-1对大鼠脑内神经干细胞的诱导作用①
张浩,丁鹏,王进昆,苏稳,牟临杰,王波,龚光辉,刘景传,王崇谦
单核细胞趋化蛋白-1对大鼠脑内神经干细胞的诱导作用①
张浩,丁鹏,王进昆,苏稳,牟临杰,王波,龚光辉,刘景传,王崇谦
目的探讨外源性单核细胞趋化蛋白-1(MCP-1)对体内神经干细胞的作用。方法成年雄性Sprague-Dawley大鼠64只分为空白组(n=4)、对照组(n=30)和实验组(n=30)。空白组不做处理,对照组大脑皮层微量定向注射PBS液,实验组注射MCP-1。注射后3 d、5 d、7 d、14 d、21 d分别取对照组和实验组大鼠各6只灌注取脑。免疫组织化学法观察脑内不同部位nestin阳性细胞的分布。结果实验组皮质区、海马区nestin阳性细胞矫正累积吸光度随时间延长而显著增加(P<0.001)。对照组和空白组之间无显著性差异(P>0.05)。结论外源性MCP-1可以促进MCP-1富集部位的nestin阳性细胞的数量增多。
单核细胞趋化因子-1;神经干细胞;趋化因子;nestin
[本文著录格式] 张浩,丁鹏,王进昆,等.单核细胞趋化蛋白-1对大鼠脑内神经干细胞的诱导作用[J].中国康复理论与实践, 2014,20(5):434-441.
20世纪90年代,Galli等从成年小鼠纹状体分离出一种能够在体外分裂增殖、具有多分化潜能的细胞群,称为神经干细胞(neural progenitor/stem cells, NPCs)[1],成年哺乳动物主要分布在大脑侧脑室壁的脑室下区(subventricular zone,SVZ)和海马齿状回的颗粒下层(subgranular zone,SGZ)。有研究表明,缺血性脑损伤能诱导体内NPCs向损伤区域迁移[2]。局部NPCs受免疫细胞分泌的多种趋化因子影响[3-4],其中单核细胞趋化蛋白-1(monocyte chemoattractant protein-1, MCP-1)可通过细胞表面趋化因子受体CCR2对海马区增殖的神经干细胞产生化学趋化作用[5-6]。MCP-1是细胞因子超家族中CC家族的成员[7],不仅具有趋化效应,还具有一系列调控单核细胞和淋巴细胞生物学活性的免疫学特性,参与调节机体的免疫应答。2004年,Widera等证实在Boyden小室中,MCP-1可诱导神经干细胞的迁移[8]。本研究探讨外源性MCP-1对内源性神经干细胞的影响。
1 材料与方法
1.1 实验试剂及仪器
大鼠MCP-1:美国ABBIOTEC公司。抗大鼠nestin多克隆抗体:北京博奥森生物技术有限公司。即用型快速免疫组化MaxVisionTM检测试剂盒:福州迈新生物技术开发有限公司。苏木精-伊红染色(HE染色)试剂盒:碧云天生物技术研究所。立体定向仪:中西远大(武汉)科技有限公司。微量注射器:美国NANOFIL公司。大鼠开颅手术及麻醉消毒设备。LEICA RM2016型转轮式切片机、LEICA DM1000型生物显微镜:德国LEICA公司。
1.2 实验动物分组与造模
成年雄性Sprague-Dawley大鼠64只,体重200~250 g,昆明医科大学动物科提供。实验过程中对动物的处置符合科技部《关于善待实验动物的指导性意见》[9]的规定。将大鼠MCP-1与PBS溶液充分混匀,制成浓度为500 ng/μl溶液。所有动物随机编号,用随机数表将其分为空白组(n=4)、对照组(n=30)和实验组(n=30)。
空白组不做任何处理。
实验组再分为3 d组、5 d组、7 d组、14 d组和21 d组,每组6只。10%水合氯醛2 ml/kg腹腔麻醉,俯卧位固定于大鼠脑立体定位仪上。备皮,常规消毒铺巾,沿头皮矢状缝切开,暴露颅骨。前囟后3.5 mm矢状线左侧2.2 mm用牙钻磨出直径为1 mm的骨窗。10 μl平头微量注射器严格消毒后吸取MCP-1 5 μl,固定于大鼠脑立体定向仪的注射架上,缓慢插入大鼠硬膜下1 mm。以1 μl/min的速度注射到大鼠皮质区。针头留置脑内5 min后,缓慢拔出。整个过程严格无菌操作。骨蜡密封骨窗,缝合头皮,肌注庆大霉素预防感染。每隔3 d重复以上操作以保证大鼠皮质的药物浓度。
对照组再分为3 d组、5 d组、7 d组、14 d组和21 d组,每组6只。将注射液体改换为PBS液。其余操作与实验组相同。
1.3 标本采集
将分组后的大鼠按规定时间取材。10%水合氯醛2 ml/kg腹腔内注射麻醉。大鼠仰卧位,四肢固定于手术台上,切开胸腔,暴露心脏。穿刺左心室,并切开右心耳,以生理盐水灌洗,至右心耳灌流出液体清亮为止。夹闭腹主动脉,多聚甲醛液灌注约30 min,待大鼠上肢僵直,快速取脑。将脑组织置于40 g/L多聚甲醛溶液中固定。
1.4 切片制备
脑组织按目标部位冠状切块,制成蜡块;石蜡切片机连续冠状位切片,厚4 μm。空白组和对照组选取相同部位进行切片。每5张脑片取1张,共取8张。相邻切片分别编号,脱蜡后置于4℃冰箱中保存备用。
1.5 HE染色
各组3 d组(除空白组)标本取同部位切片2张,行HE染色。200×光镜下观察脑组织病理变化。
1.6 nestin免疫组织化学染色
脑片3%H2O2室温孵育,蒸馏水冲洗,PBS浸泡,10%正常山羊血清(PBS稀释)封闭,室温孵育。滴加抗大鼠nestin多克隆抗体工作液,孵育1~2 h。滴加适量二抗工作液,孵育冲洗后,滴加适量辣根酶标记的链霉卵白素工作液,孵育,冲洗,显色,复染,脱水,透明,封片。室温晾干后400×显微镜下观察拍片。图片采用图像分析软件Image-Pro Plus 6.0分析计算累积光密度(IOD)。
1.7 统计学分析
2 结果
2.1 大体观察
实验组可见细微针孔及出血点,注射部位在大脑皮质内侧1 mm处,海马上方。脑内有微量出血灶。对照组大脑解剖后表观相同。
2.2 HE染色
空白组显示正常顶叶皮质:细胞胞体饱满,分布较为紧密、排列较为紧凑;细胞核呈蓝色,神经元形态及染色均正常。实验组可见神经细胞形态的细胞增多,未见梗死区及感染后炎性细胞富集区。对照组镜下与实验组差别不大,未见梗死区,无纤维素渗出和炎症细胞富集等感染灶。见图1。

图1 HE染色结果(200×)
2.3 nestin免疫组化染色
nestin免疫反应阳性产物为稍淡染的棕黄色点状或颗粒状沉积,主要在胞质内,部分呈聚集分布[10-11]。
对照组和空白组皮质区nestin少量表达,且无显著性差异(P>0.05)。实验组各时间点nestin阳性细胞均显著高于对照组(P<0.001)。见表1。
形态学观察,3 d时皮质注射部位未见明显nestin阳性细胞;5 d时皮质注射部位可见明显nestin阳性细胞,并且呈规律分布;7 d时,皮质注射部位可见大量呈规律分布的nestin染色阳性细胞;14 d时,皮质注射部位可观察到链状分布的nestin阳性细胞;21 d时,皮质注射部位可观察到大量规律分布的nestin阳性细胞。见图2~图7。
空白组和对照组海马区nestin少量表达,且无显著性差异(P>0.05)。实验组各时间点nestin阳性细胞均显著高于对照组(P<0.001)。见表2、图7~图12。
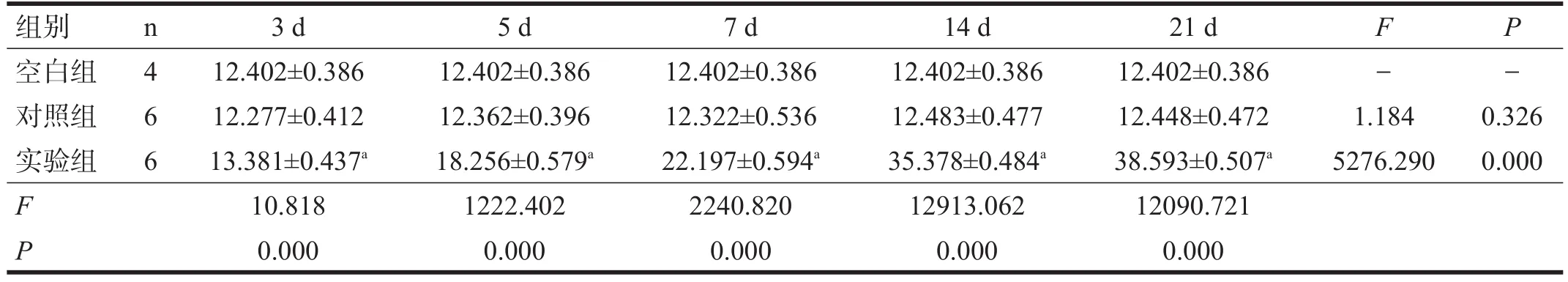
表1 各组各时间点皮质区nestin表达(IOD)

表2 各组各时间点海马区nestin表达(IOD)

图2 对照与实验3 d组皮质区nestin表达(免疫组织化学染色,400×)

图3 对照与实验5 d组皮质区nestin表达(免疫组织化学染色,400×)

图4 对照与实验7 d组皮质区nestin表达(免疫组织化学染色,400×)

图5 对照与实验14 d组皮质区nestin表达(免疫组织化学染色,400×)
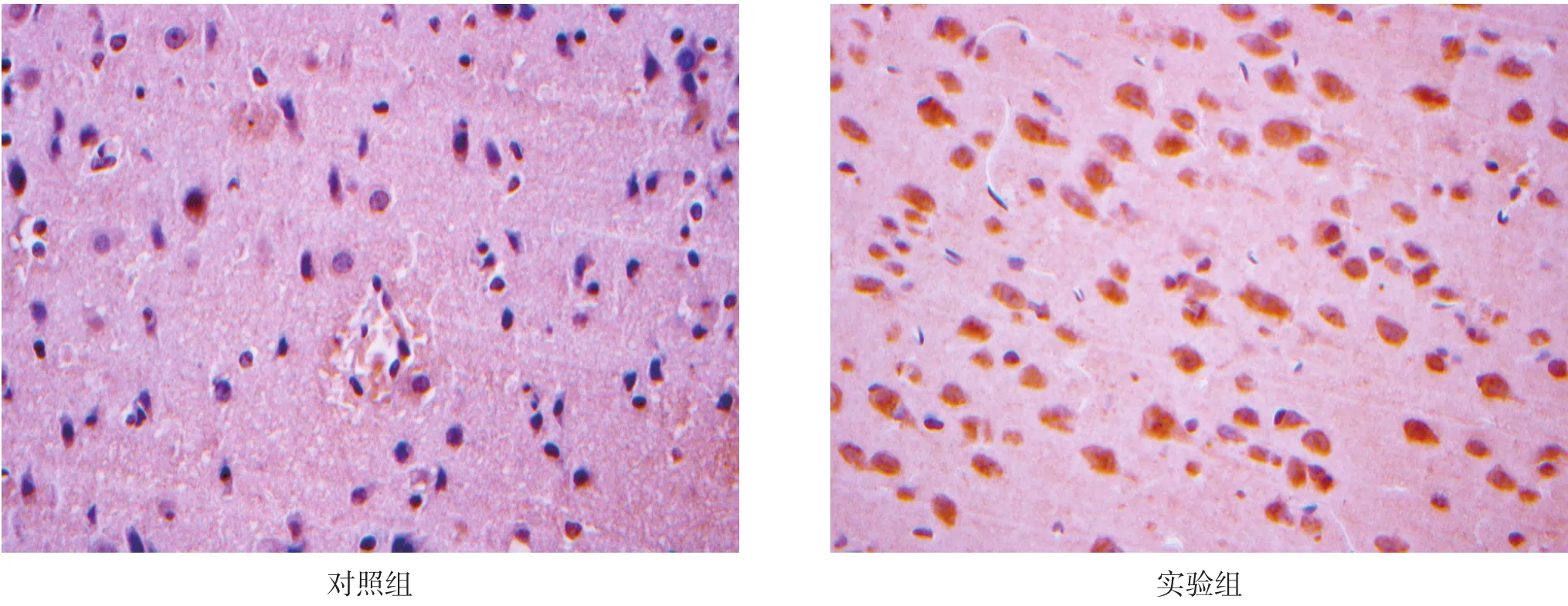
图6 对照与实验21 d组皮质区nestin表达(免疫组织化学染色,400×)

图7 空白组nestin表达(免疫组织化学染色,400×)
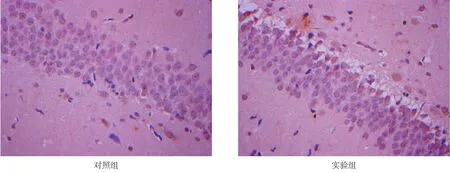
图8 对照与实验3 d组海马区nestin表达(免疫组织化学染色,400×)

图9 对照与实验5 d组海马区nestin表达(免疫组织化学染色,400×)

图10 对照与实验7 d组海马区nestin表达(免疫组织化学染色,400×)

图11 对照与实验14 d组海马区nestin表达(免疫组织化学染色,400×)

图12 对照与实验21 d组海马区nestin表达(免疫组织化学染色,400×)
3 讨论
迄今为止,研究者对于MCP-1[12]等趋化因子促进神经干细胞迁移方面的研究已经做出很大努力,并取得了一些重要进展。但在活体中,人们只在脑出血[13-14]、颅脑损伤[11,15]等病理环境下有一定研究。由于活体内损伤和缺血有着不同的微环境,所以我们不能直接将体外研究结果引入体内。对于体内趋化因子对神经干细胞的作用尚不明了。
趋化因子是指具有趋化作用的细胞因子。根据靠近分子氨基端(N端)的前两个C之间是否插入其他种类氨基酸,将它们分为4个亚类:CC、CXC、CX3C和C[16-17]。MCP-1是趋化因子CC亚家族的成员。近年来研究显示,趋化因子不仅在保护宿主、炎症反应、过敏反应,免疫细胞的发育、分化及免疫系统的自身稳定等方面起作用,而且在肿瘤的形成及转移、中枢神经系统神经网络的发育、损伤与疾病修复过程、心脑血管系统疾病的修复过程等方面都发挥重要作用[18-20]。Belmadani等观察到,将小鼠MCP-1基因敲除后,神经前体细胞向损伤处的迁移显著减少[21],说明MCP-1可诱导神经前体细胞向MCP-1富集部位迁移。近年来也有研究表明其对神经干细胞的趋化也有重要作用。
nestin是胚胎期神经干细胞的标记物[10]。McKay等在实验中发现一种表达于神经干细胞胞质内的蛋白,其在神经胚形成时开始表达,并随神经细胞分化的完成而停止表达[22]。他们将这种蛋白命名为神经元中间丝蛋白(intermediate neurofilament protein)[23],即nestin。目前很多学者将nestin作为神经干细胞的标记物[22]。
本研究通过注射MCP-1,建立SD大鼠模型。该方法比Magge等放置引流管的方法[24]降低感染和异物引起的局部炎症反应,从而降低了炎症细胞分泌MCP-1对实验的干扰。同时由于针孔所致的伤口和骨窗微小,故定位准确。我们采用立体定向仪定位,可重复性较高。
本研究显示,随着时间延长,实验组皮质区和海马区的nestin阳性细胞逐渐增多。海马区为脑内神经干细胞的富集部位,MCP-1对海马区神经干细胞有激活效应;而皮质区nestin阳性细胞的富集提示MCP-1对内源性nestin阳性细胞的趋化效应。与Belmadani等[21]结果相似。
因此,外源性MCP-1既可激活神经干细胞,也可诱导神经干细胞向目标部位富集,为应用趋化因子诱导神经干细胞修复脑损伤,改善颅脑损伤患者的康复过程,提供了基础。
但神经干细胞受趋化因子诱导后的细胞内信号转导过程还不清楚。我们将进一步研究MCP-1对于神经干细胞内信号转导过程的影响。
[1]Doetsch F,Garcı´a-Verdugo JM,Alvarez-Buylla A.Cellular composition and three-dimensional organization of the subventricular germinal zone in the adult mammalian brain[J].J Neurosci,1997,17(13):5046-5061.
[2]Kokaia Z,Lindvall O.Neurogenesis after ischaemic brain insults[J].Curr Opin Neurobiol,2003,13(1):127-132.
[3]Zhang ZG,Zhang L,Tsang W,et al.Correlation of VEGF and angiopoietin expression with disruption of blood-brain barrier and angiogenesis after focal cerebral ischemia[J].J Cereb Blood Flow Metab,2002,22(4):379-392.
[4]Petricoin EF,Ardekani AM,Hitt BA,et al.Use of proteomic patterns in serum to identify ovarian cancer[J].Lancet,2002, 359(9306):572-577.
[5]Dzenko KA,Andjelkovic AV,Kuziel WA,et al.The chemokine receptor CCR2 mediates the binding and internalization of monocyte chemoattractant protein-1 along brain microvessels[J].J Neurosci,2001,21(23):9214-9223.
[6]Wu AC,Morrison NA,Kelly WL,et al.MCP-1 expression is specifically regulated during activation of skeletal repair and remodeling[J].Calcif Tissue Int,2013,92(6):566-575.
[7]Yadav A,Saini V,Arora S.MCP-1:chemoattractant with a role beyond immunity:a review[J].Clin Chim Acta,2010,411 (21):1570-1579.
[8]Widera D,Holtkamp W,Entschladen F,et al.MCP-1 induces migration of adult neural stem cells[J].Eur J Cell Biol,2004, 83(8):381-387.
[9]科技部.关于善待实验动物的指导性意见[S].2006.
[10]孟艳,蔡青,张耀芬,等.侧脑室外侧壁室管膜下区的细胞成分及结构观察——巢蛋白能否作为神经干细胞特异性标记物[J].中国临床康复,2005,9(26):94-95.
[11]Ho L,Zhao W,Dams-O'Connor K,et al.Elevated plasma MCP-1 concentration following traumatic brain injury as a potential"predisposition"factor associated with an increased risk for subsequent development of Alzheimer's disease[J].J Alzheimer Dis,2012,31(2):301-313.
[12]McLarnon JG.Microglial chemotactic signaling factors in Alzheimer's disease[J].Am J Neurodegener Dis,2012,1(3): 199-204.
[13]Iwai M,Sato K,Kamada H,et al.Temporal profile of stem cell division,migration,and differentiation from subventricular zone to olfactory bulb after transient forebrain ischemia in gerbils[J].J Cereb Blood Flow Metab,2003,23(3):331-341.
BIM在施工过程中的质量控制的最大优点,就是提高了施工单位项目部内部班组实施质量信息的沟通效率,而且大大改善了施工单位与其他项目参与方的沟通组织及协调。基于BIM沟通,不管你在哪里,都能随时随地检查质量信息,移动端就能发出指令要求,就能要求整改并上传质量信息。坐在办公室的项目领导只需打开相关系统及软件,就能够实现查阅质量信息及发布远程管理指令,便于工程项目的远程管理、控制及组织协调。
[14]Dibajnia P,Morshead CM.Role of neural precursor cells in promoting repair following stroke[J].Acta Pharmacol Sin, 2013,34(1):78-90.
[15]Dash P,Mach S,Moore A.Enhanced neurogenesis in the rodent hippocampus following traumatic brain injury[J].J Neurosci Res,2001,63(4):313-319.
[16]Rostène W,Kitabgi P,Parsadaniantz SM.Chemokines:a new class of neuromodulator?[J].Nature Rev Neurosci,2007,8 (11):895-903.
[17]Callewaere C,Banisadr G,Rostène W,et al.Chemokines and chemokine receptors in the brain:implication in neuroendocrine regulation[J].J Mol Endocrinol,2007,38(3):355-363.
[18]Charo IF,Ransohoff RM.The many roles of chemokines and chemokine receptors in inflammation[J].N Engl J Med,2006, 354(6):610-621.
[19]Liu XS,Zhang ZG,Zhang RL,et al.Chemokine ligand 2 (CCL2)induces migration and differentiation of subventricular zone cells after stroke[J].J Neurosci Res,2007,85(10): 2120-2125.
[21]Belmadani A,Tran PB,Ren D,et al.Chemokines regulate the migration of neural progenitors to sites of neuroinflammation[J].J Neurosci,2006,26(12):3182-3191.
[22]Lendahl U,Zimmerman LB,McKay RD.CNS stem cells express a new class of intermediate filament protein[J].Cell, 1990,60(4):585-595.
[23]Wu Y,Chen Q,Peng H,et al.Directed migration of human neural progenitor cells to interleukin-1β is promoted by chemokines stromal cell-derived factor-1 and monocyte chemotactic factor-1 in mouse brains[J].Transl Neurodegener,2012,1(1): 15.
[24]Magge SN,Malik SZ,Royo NC,et al.Role of monocyte chemoattractant protein-1(MCP-1/CCL2)in migration of neural progenitor cells toward glial tumors[J].J Neurosci Res,2009, 87(7):1547-1555.
Effect of Exogenous Monocyte Chemoattractant Protein-1 on Neural Stem Cells in Brain of Rats
ZHANG Hao,DING Peng,WANG Jin-kun,et al.Department of Neurosurgery,First Affiliated Hospital of Kunming Medical University,Kunming 650032,Yunnan,China
ObjectiveTo apply the exogenous monocyte chemoattractant protein-1(MCP-1)to induce the neural stem cells in vivo.Methods64 adult male Sprague-Dawley rats were randomly divided into blank(n=4),control(n=30)and experimental(n=30)groups.The experimental group was injected with MCP-1 into the cerebra,and the control group with PBS,and the blank group with no intervention. The number of nestin positive cells in brain was observed with immunohistochemistry 3,5,7,14,21 days after injection.ResultsThe number of nestin positive cells increased with time in the cortex and hippocampus in the experimental group(P<0.001).There was no significant difference between the control group and the blank group(P>0.05).ConclusionExogenous MCP-1 may induce the increase of neural stem cells in vivo.
monocyte chemoattractant protein-1;neural stem cells;chemotactic factor;nestin
10.3969/j.issn.1006-9771.2014.05.011
R338.1
A
1006-9771(2014)05-0434-08
2013-08-27
2013-11-05)
云南省卫生科技内设研究机构项目(No.2011ws0050)。
昆明医科大学附属第一医院神经外科,云南昆明市650032。作者简介:张浩(1987-),男,汉族,山西晋城市人,硕士研究生,主要研究方向:神经干细胞基础应用及脑血管病的治疗。通讯作者:王崇谦(1963-),男,汉族,云南昆明市人,副主任医师,主要研究方向:神经干细胞基础应用及颅脑损伤。

