可诱导心肌特异性表达TRX蛋白转基因小鼠模型的建立
孙煜,李成刚,周立
(1.湖北省食品药品监督管理局药品审评认证中心,湖北 武汉 430071;2.武汉市刚子科贸有限公司,湖北 武汉 430071;3.武汉大学动物实验中心/ABSL-3实验室,湖北 武汉 430071)
·论著·
可诱导心肌特异性表达TRX蛋白转基因小鼠模型的建立
孙煜1,李成刚2,周立3
(1.湖北省食品药品监督管理局药品审评认证中心,湖北 武汉 430071;2.武汉市刚子科贸有限公司,湖北 武汉 430071;3.武汉大学动物实验中心/ABSL-3实验室,湖北 武汉 430071)
目的建立心肌特异性、高效表达鼠源硫氧还蛋白-1(Thioredoxin 1,Trx-1)的转基因小鼠模型。方法将TRE-Tight-Trx-1与能够控制TRE-Tight下游基因在心肌特异性表达的α-MHC-rtTA-hGH转基因载体分别显微注射入C57BL/6小鼠受精卵细胞中得到的分别含有一段转基因载体的转基因小鼠,再将这两种转基因小鼠进行交配,获得同时含有TRE-Tight-Trx-1和α-MHC-rtTA-hGH这两段基因的双阳性子代转基因小鼠。使用强力霉素(Dox)持续诱导6周龄双阳性小鼠6周,再用Western blot方法检测转基因小鼠心肌细胞中Trx-1表达量。结果与野生型C57BL/6小鼠比较,经过强力霉素诱导的双阳转基因小鼠心肌细胞中Trx-1有高表达量(P<0.05)。结论我们得到了可诱导、高效表达Trx-1的转基因小鼠系,为心肌肥大疾病的研究和治疗提供新的研究思路。
硫氧还蛋白-1;α-肌球蛋白重链;强力霉素;Tet-on/pTRE-Tight诱导表达系统
转基因动物技术是通过实验技术把外源基因通过基因注射等方法导入动物的早期胚胎细胞或者受精卵,使外源基因与受体细胞的基因组随机或定向的整合[1]。最为常用的是Hammer等[2]建立的原核显微注射法,由于其插入外源基因片段的大小受限制较小,效果又很可靠,到现在为止依然是最主要的制备转基因动物的方法。
Tet-on&TRE-Tight基因表达系统在1995年由Gossen和Bujard等建立,是一种高效、低毒以及具有高效诱导能力表达外源DNA的调控系统。该系统在四环素类诱导物的作用下,其Tet-on质粒中反向(Tet-on)四环素调控转录激活因子rtTA调控元件和质粒TRE-tight中四环素操纵元件tet07特异性结合,启动下游目的基因的高效表达,而在无诱导物时则不能启动下游基因的转录,具有特异性、严密性以及高效性的特点,已经广泛应用于构建转基因动物模型。
硫氧还蛋白系统是生物体内主要的抗氧化系统之一,由硫氧还蛋白(Thioredoxin,Trx)、烟酰胺腺嘌呤二核苷酸(NAPDH)和硫氧还蛋白还原酶(Thioredoxin reductase,TrxR)三部分组成,是一个广泛分布的NAPDH依赖性二硫化物还原酶系统[3-4]。Trx作为一抗氧化物,能被诸如ROS自由基氧化,也能通过清除过氧化氢,还原硫氧还蛋白过氧化物酶(Peroxiredoxin,PrX),还原谷胱甘肽过氧化物酶-3(Glutathione peroxidise-3)等特异性酶类,进而维持细胞正常的氧化还原水平。Trx-1细胞内广泛存在的抗氧化酶,是一种小分子蛋白(12 kD),由104个氨基酸残基构成,其蛋白结构为3个α螺旋和4个β折叠紧密结合的球状结构[5]。Trx-1作为一种氧化还原调控蛋白在细胞的各种生理活动和功能中中发挥着重要的作用,其调控方式主要通过氧化还原状态的变化实现。Trx-1不仅可以通过清除ROS来抵抗细胞内的氧化应激,还可以作为一种生长因子促进细胞的生长[5]。除此之外,Trx-1还能够与某些含有半胱苷酸残基的蛋白质相互作用,从而调控这种蛋白的功能[6]。此外,Trx-1还与某些疾病的发病机制有密切关系[6],其中之一便是抑制心肌肥大。Trx-1通过上调miR-98的转录促使miR-98与cyclin D2的3'UTR区域miR-98结合位点结合,抑制cycling D2的表达。因cyclin D2具有促进心肌肥大的作用,故Trx-1能间接抑制cyclin D2的表达,进而抑制心肌肥大的发生[7]。
基于Trx的重要生物学功能,以及缺乏合适的动物模型的现状,本研究构建了以TRE-Tight质粒为载体,构建可在心肌细胞诱导型产生小鼠Trx-1基因的表达质粒系统,结合显微注射技术生产了能够心肌组织特异性、诱导性高表达鼠源Trx-1的转基因小鼠,为心脏疾病的研究建立了Trx-1局部高表达模型,为心肌肥大疾病的研究和治疗提供新的研究思路。
1 材料与方法
1.1 质粒、感受态、细胞系和实验动物载体Tet-on-rtTA-hGH以及TRE-Tight质粒由本实验室保存;大肠杆菌感受态细胞TOP10购自天根生化科技(北京)有限公司;小鼠心肌细胞(MCM)由美国Johns Hopkins大学医学院Dr.Yingming Tsai提供;C57/BL6小鼠由武汉大学动物实验中心提供。
1.2 主要试剂LATaq DNA聚合酶、限制性内切酶、T4DNA连接酶、dNTP、基因组DNA提取试剂盒(DV811A)购自宝生物工程(大连)有限公司;普通质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒购自生工生物工程(上海)股份有限公司;高糖DMEM、胎牛血清(FBS)、100 U/ml青/链霉素转染试剂Lipofectamin 2000、0.25%胰酶购自Life Technologies公司、M-MLV逆转录试剂盒;质粒大量提取试剂盒购自德国QIAGEN公司;Tris base、Tween-20、EDTA、二硫苏糖醇(DTT)、Trition X-100、盐酸胍(Guanidine HCl)、蛋白酶K均购于Sigma公司;丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵、TEMED、Western blot超敏发光液购于北京鼎国生物技术有限公司;兔抗鼠Trx-1一抗以及HRP标记的羊抗兔二抗购于Cell Signaling公司。
1.3 重组质粒的构建
1.3.1 α-MHC promoter-rtTA-hGH质粒的构建以含有C57/BL6小鼠全基因为模板,用含有Xhol和HindⅢ特异性酶切位点的上下游引物扩增出含心肌特异性α-肌球蛋白重链(α-MHC)启动子的片段;引物序列为:Trx-FP:5'-GCGAATTCCCCGCAACAGCCAAAA-3',EcoRITrx-RP:5'-CGCGGATCCATGATTAGCATATTC AGTA-3',BamHⅠ用EcoRⅠ和BamHⅠ双酶切PCR产物Trx-1片段以及TRE-Tight质粒,回收长度分别为337bp的IL-22片段和2.6kb的线性化TRE-Tight片段;将两片段按照拷贝数3:1混合后用T4连接酶连接,两者粘合成环形重组质粒TRE-Tight-Trx-1(图1)。
1.3.2 TRE-Tight-Trx-1质粒的构建以含有C57/ BL6小鼠全基因为模板,用含有EcoRⅠ和BamHⅠ特异性酶切位点的上下游引物扩增出含Trx-1的表达框片段;引物序列为:Trx-FP:5'-GCGAATTC CCCGCAACAGCCAAAA-3',EcoRITrx-RP:5'-CGCGGATCC ATGATTAGGCATATTCAGTA-3',BamHⅠ用EcoRⅠ和BamHⅠ双酶切PCR产物Trx-1片段以及TRE-Tight质粒,回收长度分别为337 bp的Trx-1片段和2.6 kb的线性化TRE-Tight片段;将两片段按照拷贝数3:1混合后用T4连接酶连接,两者粘合成环形重组质粒TRE-Tight-Trx-1(图1)。

图1 α-MHC promoter-rtTA-hGH以及TRE-Tight-Trx-1片段构建示意图
将重组质粒转化到大肠杆菌Top10感受态细胞中,用菌落PCR的方法挑选阳性单克隆子,并送到金唯智(Genewiz)生物科技有限公司进行测序,检查目的α-MHC启动子片段与rtTA-hGH片段连接序列是否正确以及目的基因翻译起始位点是否完好,获得含有重组质粒α-MHC promoter-rtTA-hGH(简称α-MHC-rt-TA-hGH)或者TRE-Tight-Trx-1的阳性克隆菌。
1.4 体外表达检测取含有阳性克隆的细菌,大量扩增菌液,并按照质粒提取试剂盒的操作规范提取高浓度质粒进行培养,从中提取重组质粒,保存于-20℃,待用。将4×105个小鼠心肌细胞接种于6孔板中,培养12 h(细胞密度达到80%~90%)后进行双质粒转染。转染后6 h更换新鲜培养基并加入无菌过滤的强力霉素(Doxycycline)0 ng、10 ng、100 ng或1 000 ng,于诱导表达12 h后收集细胞,或使用100 ng Doxycycline诱导细胞表达6 h、12 h以及24 h后收集细胞,使用TRI Reagent提取细胞总RNA,并使用M-MLV逆转录试剂盒进行逆转录,得到cDNA。使用鼠源Trx-1特异性引物通过荧光定量PCR的方法对cDNA中Trx-1的表达进行检测,以未经过处理的细胞的Trx-1表达量定义为1,计算经过处理后的细胞内Trx-1表达量的增加倍数。检测的引物序列分别为Trx-1D15'-CAAGCCCCCAT和Trx-1D25'-GCAACAT ATCCTG'(产物长度为84 bp),结果用软件Graph pad Prism5.0进行数据分析。
1.5 显微注射用线性DNA的制备取含有阳性克隆的细菌,大量扩增菌液,并按照QIAGEN质粒大量提取试剂盒的操作规范提取高浓度质粒进行培养,从中提取重组质粒,并分别用限制性核酸内切酶XhoⅠ与NotⅠ(α-MHC-rtTA-hGH)或者XhoⅠ(TRE-Tight-Trx-1)进行酶切,使用QIAGEN胶回收试剂盒将酶切片段回收,纯化后的DNA调整浓度为1 μg/μl,-20℃保存,待用于基因注射。
1.6 转基因小鼠的制备与检测获得新生小鼠后,将鼠尾用200 μl DNA裂解液(0.5%SDS、0.05 mol/L EDTA、0.1 mol/L NaCl、0.01 mol/LTris。HCl使用前加入终浓度为1 mg/ml的蛋白酶K)裂解后作为模板DNA,用检测引物检测其基因型(引物分别为rtTA检测引物rtTAD1:5'-TGGGAGTTTGTTTTGGCAC-3'和rt-TA D2:5'-ATGGCTAAGGCGTCGAG-3',产物长度为380 bp)以及Trx-1的检测引物Trx-1 D1和Trx-1 D2。反应参数:94℃预变性10 min,然后94℃30 s,60℃30s,72℃60s,共30个循环,最后72℃延伸5 min)。最终得到3个α-MHC-rtTA-hGH Founders,编号分别为10,19,30;两个得到TRE-Tight-Trx-1Foundes,编号分别为9,13。将含有其中一种转基因片段的小鼠分别作为父母系进行繁殖,对获得的子代小鼠使用上述方法进行基因鉴定。参照Zheng等[8]的方法将筛选出的同时含有两种转基因片段的小鼠(双阳性小鼠)分窝后单独饲养,连续喂饮含有强力霉素的饮用水6周,刺激Trx-1在心肌大量表达。
1.7 小鼠心肌细胞的分离将小鼠按照Zhang等[9]的方法处理,收集心脏血液并对心脏进行清洗。取出心脏剪碎后,用PBS漂洗3次,去除残余的血细胞和死细胞,再加入0.25%胰酶,于37℃消化10 min,摇荡20 s,再放入37℃消化。10 min后静置后吸取上清用胎牛血清终止消化,将收集的消化液上清用200目筛网过滤,收集分离的心肌细胞,离心5 min,用PBS漂洗2次,使用含有10%FBS的高糖DMEM培养基重选后放置于T25培养皿中于37℃培养1 h。因心肌细胞不贴壁,吸取悬浮细胞即含有高浓度的心肌细胞,重悬培养。
1.8 转基因小鼠心肌细胞内Trx-1的表达向心肌细胞中加入无菌过滤的强力霉素(Doxycycline)1 000 ng,诱导转基因小鼠心肌细胞内Trx-1表达72 h后,用G-lysis缓冲液(pH值为8.3的50 mmol/L Tris盐酸缓冲液,3 mmol/L EDTA,6 mmol/L盐酸胍,0.5% TritonX-100)收集细胞蛋白质,37℃避光放置30 min,加入蛋白上样缓冲液电泳至溴酚蓝带泳出胶外8 min,转至PVDF膜(40V,3 h),5%封闭液室温封闭1 h,加入一抗(羊抗鼠Trx1 1:15 000),4℃避光过夜,再加入二抗(1:3 000)室温1 h,最后用超敏发光液化学发光,显影,定影。
2 实验结果
2.1 质粒体外表达Trx-1的检测诱导性产生Trx-1的检测结果见图2。在α-MHC-rtTA-hGH以及TRE-Tight-Trx-1系统中,Trx-1在mRNA水平的表达量随着时间的延长而增多(图2A),表明强力霉素能够一直诱导Trx-1表达。而用于诱导表达的强力霉素的量与最终Trx-1的表达量成比例(图2B)。
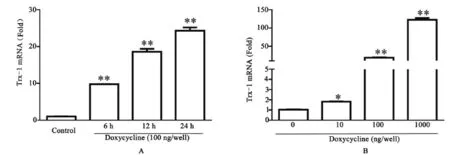
图2 Trx-1的诱导表达检测
2.2 体内检测Trx-1蛋白的表达由Western Blot显色以及条带分析结果可见,与野生型小鼠(WT)以及未经强力霉素诱导的小鼠(Tg-0周)相比,经过强力霉素诱导6周后的双阳性转基因小鼠心肌细胞中Trx-1蛋白表达量明显增高(见图3),说明在强力霉素诱导下,我们构建的双阳性转基因小鼠能够高水平的表达Trx-1蛋白。

图3 心肌细胞中Trx-1蛋白的表达水平
3 讨论
肌球蛋白是心肌肌小节粗肌丝的主要成分,由重链(MHC)和轻链(MLC)组成。在心肌中MHC有两种亚型,即α-MHC和β-MHC。α-MHC是成年机体心肌中的主要形式[10]。Gulick等[11]分离出小鼠心肌MHC基因座,并鉴定了α-MHC基因的启动子区,α-MHC启动子能够在心肌中特异性驱动CAT基因的表达,而非心肌组织中不表达。本研究克隆了α-MHC基因的启动子区,α-MHC启动子全长约5 kb,将α-MHC启动子连接到rtTA-hGH的5'端,控制下游基因rtTA在心肌细胞中特异性的高表达。我们利用人心肌细胞在体外进行的检测实验结果也证明我们构建的α-MHC promoter-rtTA-hGH能够指导rt-TA蛋白在心肌细胞中特异性表达。
Trx-1在细胞内具有非常重要的调控作用,据报道,这种蛋白质和心血管疾病的发生密切相关[12-14]。在针对心肌肥大的疾病研究中,Trx-1更是被视为治疗或者预防的新型药物,但是其功能和作用机理并未在体内实验中得到证实。此外,由于Trx-1在细胞内发挥着非常重要的作用,在同一组织类型中也发挥不同作用,我们不仅需要建立表达Trx-1的动物模型,还需要能够随时调控其特异性表达的调控手段进行辅助。
目前基因动物的构建主要用的是单质粒的显微注射,由于转基因动物的周期很长,如果目的基因具有一定的生物毒性或对机体存在潜在危害,就会造成工具鼠数量不足,获得率低。诱导性表达质粒体系的应用能很好的解决这个问题,我们能够通过在小鼠繁殖期间关闭基因的表达来避免表达的基因产物的生物毒性毒杀新生小鼠,而在小鼠成年后再开启转入基因的表达构建我们需要的动物模型。根据我们的实验,在Tet-on质粒系统的调控下,目的基因的蛋白表达量跟时间呈正相关,我们能够依据这种特性逐步建立转基因的模型。诚然双质粒在体外试验中会提高转染的难度,但是我们在体内实验中可以通过将两个质粒分别基因注射到两只小鼠,构建两种不同的转基因小鼠系,应用时再将两种小鼠交配获得双阳性小鼠用于实验。
我们建立的双质粒转基因模型不但可以解决Trx-1潜在的生物毒性问题,还能够通过将含有Trx-1的转基因小鼠与含有不同的控制特异性表达的启动子的转基因小鼠交配,获得一系列在不同组织和细胞中特异性表达Trx-1的小鼠。建立这样一个平台,对于丰富小鼠品系打下了坚实的基础。如果拥有大量控制特异性表达的启动子的转基因小鼠,往后建立任何一种含有目的基因的小鼠都能通过交配的方式获得一系列特异性表达该基因的小鼠系,使后期工作变得简便,省时。
(志谢:目的DNA显微注射这部分工作由武汉大学动物实验中心吴珂老师完成,特此感谢。)
[1]陈诗书,汤雪明.医学细胞与分子生物学[M].2版.北京:科学出版社,2004:844-876
[2]Hammer RE,Pursel VG,Rexroad CE Jr,et al.Production of transgenic rabbits,sheep and pigs by microinjection[J].Nature,1985, 315(6021):680-683.
[3]Go YM,Ziegler TR,Johnson JM,et al.Selective protection of nuclear thioredoxin-1 and glutathione redox systems against oxidation during glucose and glutamine deficiency in human colonic epithelial cells[J]. FreeRadicalBiology&Medicine,2007,42(3):363-370.
[4]Spyrou G,Enmark E,Miranda-Vizuete A,et al.Cloning and expression of a novel mammalian thioredoxin[J].The Journal of Biological Chemistry,1997,272(5):2936-2941.
[5]Dong WF LU,Yue WB.Progress in the study of Thioredoxin[J]. Grass-Feeding Livestock,2006,133(4):4-6.
[6]Hirota K,Nakamura H,Masutani H,et al.Thioredoxin superfamily and thioredoxin-inducing agents[J].Annals of the New York Academy of Sciences,2002,957:189-199.
[7]Yang Y,Ago T,Zhai P,et al.Thioredoxin 1 negatively regulates angiotensin II-induced cardiac hypertrophy through upregulation of miR-98/let-7[J].Circulation Research,2011,108(3):305-313.
[8]Zheng T,Zhu Z,Wang Z,et al.Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase-and cathepsin-dependent emphysema[J].J Clin Invest,2000,106(9):1081-1093.
[9]Zhang L,Oh SY,Wu X,et al.SHP-1 deficient mast cells are hyperresponsive to stimulation and critical in initiating allergic inflammation in the lung[J].J Immunol,2010,184(3):1180-1190.
[10]Liew CC,Jandreski MA.Construction and characterization of the alpha form of a cardiac myosin heavy chain cDNA clone and its developmental expression in the Syrian hamster[J].Proc Nat Acad Sci U SA,1986,83(10):3175-3179.
[11]Gulick J,Subramaniam A,Neumann J,et al.Isolation and characterization of the mouse cardiac myosin heavy chain genes[J].The Journal of Biological Chemistry,1991,266(14):9180-9185.
[12]Powis G,Mustacich D,Coon A.The role of the redox protein thioredoxin in cell growth and cancer[J].Free Radical Biology&Medicine,2000,29(3-4):312-322.
[13]Arner ES,Holmgren A.The thioredoxin system in cancer[J].Seminars in Cancer Biology,2006,16(6):420-426.
[14]Boonstra J,Post JA.Molecular events associated with reactive oxygen species and cell cycle progression in mammalian cells[J]. Gene,2004,337:1-13.
Establishment of transgenic mice model with myocardium-specific expression of TRX protein.
SUN Yu1,
LI Cheng-gang2,ZHOU Li3.
1.Drug Certification Center of Food and Drug Administration,Wuhan 430071,Hubei, CHINA;2.Gangzi Technology&Trade Co,LTD,Wuhan 430071,Hubei,CHINA;3.Wuhan University Laboratory Animal Center/ABSL-3 Labaratory,Wuhan 430071,Hubei,CHINA.
ObjectiveTo establish Thioredoxin 1(Trx-1)transgenic mice model with myocardium-specific high expression of Thioredoxin(Trx-1).MethodsTRE-Tight-Trx-1 and α-MHC-rtTA-hGH gene vector which specifically controls the expression of TRE-Tight downstream gene in cardiomyocytes were microinjected into the zygote of C57BL/6 mice respectively for establishing the transgenic mice with transgenic vectors.After mating,a double-positive offspring with bothTRE-Tight-Trx-1 and α-MHC-rtTA-hGH gene were obtained.And then doxycycline was added to feed the double positive transgenic mice aged over 6 weeks for 6 weeks,where the concentration of Trx-1 in cardiomyocytes was detected by Western Blot.ResultsThe transgenic mice feeding with doxycycline showed high expression levels of Trx-1 in cardiomyocytes compared with wild type C57BL/6 mice.ConclusionWe established a Trx-1 transgenic mice model with inducible and high expression of Trx-1,which provided a new pattern of thinking in the research and therapy for cardiac hypertrophy.
Thioredoxin 1;α-myosin heavy chain(α-MHC);Doxycycline;Tet-on/pTRE-tight system
R-332
A
1003—6350(2014)08—1093—04
10.3969/j.issn.1003-6350.2014.08.0427
2013-11-07)
周立。E-mail:zhouli_jerry@whu.edu.cn

