内镜智能分光比色技术和H IF-1α的表达在大肠息肉样病变中的诊断价值
胡中邦 陈 斌 黄 伟 刘尚忠
1.广东省韶关市粤北人民医院消化内科,广东韶关 512026;2.广东省韶关市粤北人民医院病理科,广东韶关 512026
内镜智能分光比色技术和H IF-1α的表达在大肠息肉样病变中的诊断价值
胡中邦1陈 斌1黄 伟2刘尚忠1
1.广东省韶关市粤北人民医院消化内科,广东韶关 512026;2.广东省韶关市粤北人民医院病理科,广东韶关 512026
目的 探讨内镜智能分光比色技术和缺氧诱导因子-1α(HIF-1α)的表达在大肠息肉样病变中的诊断价值。 方法 通过内镜智能分光比色技术对大肠息肉样病变进行黏膜表面细微腺管开口形态分型及微血管形态观察,同时用免疫组织化学法检测病变组织HIF-1α的表达。 结果 炎症性息肉和癌性息肉的腺管开口形态分型及微血管分型形态比较,差异有统计学意义(P<0.05);癌性息肉HIF-1α的表达强度明显高于炎症性息肉HIF-1α的表达强度,差异有统计学意义(P<0.05);不同腺管开口分型及微血管分型形态的大肠息肉HIF-1α的表达强度比较,差异有统计学意义(P<0.05)。 结论 内镜智能分光比色技术能够清楚观察大肠息肉患者的膜表面微细结构及微血管形态,有利于息肉样病变患者疾病的早期诊断,HIF-1α在肿瘤性息肉患者组织中的高表达有利于结肠早期癌的发现。
内镜智能分光比色技术;缺氧诱导因子-1α;大肠息肉样病变
大肠癌是一种常见的消化道恶性肿瘤,发病率和死亡率均较高[1]。有研究表明,约60%的大肠癌起源于腺瘤[2],非肿瘤性息肉也有癌变可能,故对大肠息肉样病变的研究显得尤为重要。本文探讨内镜智能分光比色技术和缺氧诱导因子-1α(hypoxia-inducible factor-1α,HIF-1α)的表达在大肠息肉样病变中的诊断价值,以期为临床诊断提供参考。
1 资料与方法
1.1 一般资料
选取本院2013年1~10月进行常规结肠镜检查的患者,筛选出资料完整的确诊为大肠息肉样病变的120例患者作为研究对象,纳入研究组,其中,男性65例,女性55例,年龄25~76岁,平均(54.3±4.3)岁。排除标准:炎症性肠疾病(溃疡性大肠炎、克罗恩病等)的患者,有家族史的大肠腺瘤病症的患者;肠道准备欠佳,影响进镜观察的患者;不能忍受内镜痛苦而未送达回盲部的患者。
1.2 研究方法
采用Fujinon 4400主机,EC590ZW/M结肠镜,检查前给予高效肠道清洁剂及解痉剂,保持肠道内良好的观察环境,普通观察模式下进镜至回盲部,退镜时观察大肠黏膜,发现息肉样病变后,记录病变形态部位。通过面板键盘或手柄中的快捷键转换到内镜智能分光模式,用内镜智能分光预先设定的不同波长组合,分别观察息肉样病变表面的细微腺管形态及微血管形态。然后根据内镜智能分光下细微腺管形态及微血管形态作出病变诊断并对病灶进行活检,对活检组织进行病理组织学检查及采用SP免疫组织化学法检测HIF-1α的表达强度。本研究正常组织取自来本院作常规结肠疾病筛查的健康人50例。
组织学检查:活检标本立即置入10%甲醛溶液中固定,常规脱水、透明、包埋、切片后行HE染色,设置阴性对照和阳性对照。随机观察10个高倍镜视野,以细胞质中出现淡黄色至棕色颗粒细胞为阳性细胞,根据视野的着色程度和阳性细胞比例来判定HIF-1α的表达强度。将阳性细胞的表达情况分为5个等级:分别记作0、1、2、3、4分,阳性细胞的比例<5%记作0分,阳性细胞的比例为5%~25%记作1分,阳性细胞的比例为26%~50%记作2分,阳性细胞的比例为51%~75%记作3分,阳性细胞的比例>75%记作4分。切片的着色程度分为弱、中和强,分别记作1、2、3分。两组得分乘积为HIF-1α的表达强度得分。阳性细胞数<10%者为(-),3分为(+),4~5分为(++),6~7分为(+++)。
1.3 统计学方法
应用SPSS 16.0统计软件进行数据处理,采用Fisher确切概率法,χ2检验及Spearman等级相关分析,并计算Pearson列联系数,以P<0.05为差异有统计学意义。
2 结果
2.1 不同病理类型的腺管开口形态分型及微血管分型形态的比较
在内镜智能分光观察模式下,炎性息肉的腺管开口分型均为Ⅰ型和Ⅱ型,微血管形态多为六角蜂窝状;增生性息肉和错构性瘤的腺管开口分型多为Ⅰ型和Ⅱ型,极少部分为ⅢL型,ⅢL型息肉微血管形态多为椭圆形改变;腺瘤的腺管开口分型为ⅢL型、Ⅳ型、ⅤA型和ⅤN型、Ⅴ型及ⅤN型病变微血管形态不规则、密度不均。炎症性息肉和癌性息肉的腺管开口形态分型及微血管分型形态比较,差异有统计学意义(P<0.05)(表1)。
2.2 不同病理类型的大肠息肉HIF-1α表达强度的比较
癌性息肉HIF-1α的表达强度明显高于炎症性息肉HIF-1α的表达强度,差异有统计学意义(P<0.05)(表2)。
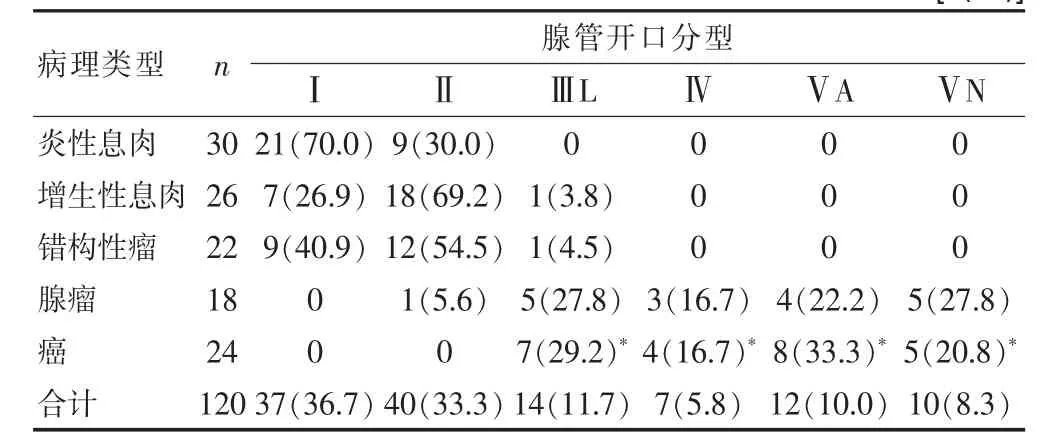
表1不同病理类型的腺管开口形态分型及微血管分型形态的比较[n(%)]

表2 不同病理类型的大肠息肉HIF-1α表达强度的比较[n(%)]
2.3 不同腺管开口分型及微血管分型形态的大肠息肉HIF-1α表达强度的比较
不同腺管开口分型及微血管分型形态的大肠息肉HIF-1α的表达强度比较,差异有统计学意义(P<0.05)(表3)。
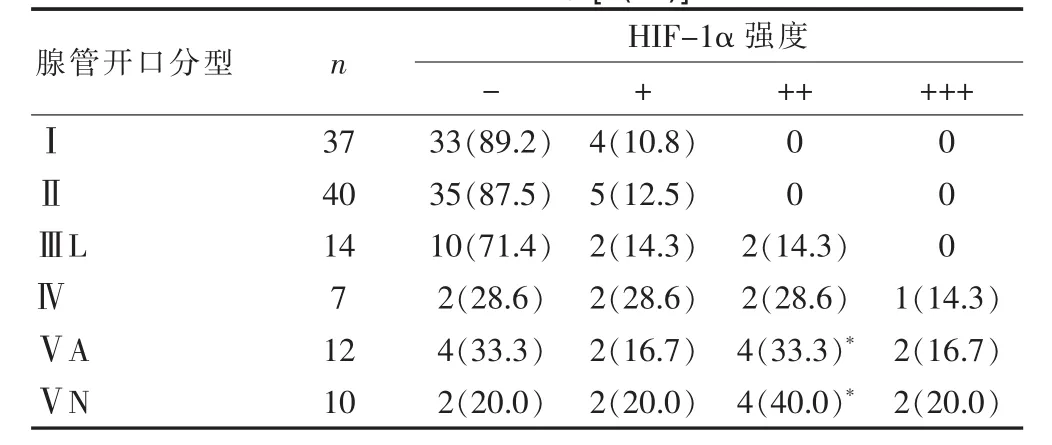
表3 不同腺管开口分型及微血管分型形态的大肠息肉HIF-1α表达强度的比较[n(%)]
3 讨论
所有恶性消化道疾病的早期阶段,无论是早期胃癌、结肠恶性息肉还是Barrett食管(BE)均或多或少伴有血管增生的情形,大肠镜是诊断大肠病变的最主要和最直接的手段,而普通大肠镜检查息判断息肉样病变的准确性不高[3]。内镜智能分光成像系统具有普通电子内镜和内镜智能分光两种工作模式,通过不同组合的RGB可呈现不同的颜色及不同层次的深度,有利于观察黏膜表层结构、毛细血管形态结构及黏膜微细凹凸变化。可对可疑病变进行靶向活检,提高消化道早期癌的诊断率。相关研究证实[4-5],内镜智能分光染色内镜结合放大内镜对大肠病变腺管开口的形态观察可以大致预测病理组织学诊断及早期大肠癌的浸润程度,对大肠肿瘤性病变诊断符合率高,操作简便,具有良好的临床实用价值。
目前认为大肠癌发生是一个多基因、多步骤的复杂过程[6]。有研究表明,实体恶性肿瘤迅速生长过程中形成局部缺氧环境,缺氧诱导因子是目前发现介导细胞低氧反应最关键的核转录因子,是肿瘤细胞适应缺氧环境作出反应的关键性介导细胞转录基因,HIF-1α在低氧环境下通过诱导多种基因表达,使肿瘤适应相对低氧的微环境[7-8]。研究表明HIF-1α在包括大肠癌等多数恶性肿瘤组织中都有表达。相关研究显示,HIF-1α表达水平在正常组织-腺瘤-腺癌中不断增高,提示细胞缺氧出现在癌变发生之前并持续到肿瘤发展的全过程,HIF-1α过度表达在促进腺瘤癌变中可能发挥重要作用,可把HIF-1α作为临床监测大肠癌进展转移、评价预后的一个有价值的指标。
综上所述,内镜智能分光比色技术能够清楚观察大肠息肉患者的膜表面微细结构及微血管形态,有利于息肉样病变患者疾病的早诊断,HIF-1α在肿瘤性息肉患者组织中的高表达有利于结肠早期癌的发现。
[1]张思维,雷正龙,李光琳,等.中国肿瘤登记地区2006年肿瘤发病和死亡资料分析[J].中国肿瘤,2010,19(6):356-365.
[2]Morson BC.Genesis of colorectal cancer[J].Clin Gastmnterol,1976,5(3):505-507.
[3]Sun X,Kanwaar JR.Gene transfer of antisense hypoxia inducible factor-1 alpha enhances the therapeutic efficacy of cancer immunotherapy[J].Gene Ther,2001,8(8):638-645.
[4]杨建荣,刘锦涛,陈彩霞.FICE技术在大肠病变诊治中的应用价值[J].临床消化病杂志,2010,22(4):229.
[5]黄留业,徐宁,刘运祥,等.内镜智能分光比色与染色技术对大肠肿瘤诊断价值的研究[J].中华消化内镜杂志,2008,25(10):524-528.
[6]刘运祥,徐宁,黄留业.内镜智能分光比色技术对大肠息肉的诊断价值[J].中国临床实用医学,2010,4(5):58-60.
[7]Vaupel P.The role of hypoxia-induced factors in tumor progression[J].Oncologist,2004,9(Suppl 5):10-17.
[8]刘胜新,陈茂平.大肠腺瘤及腺癌组织中缺氧诱导因子-1α的表达及意义[J].中华消化杂志,2006,26(11):781-782.
Diagnostic value of endoscopic smart spectral colorimetric technique and HIF-1α expression in colorectal polypoid lesions
HU Zhong-bang1CHEN Bin1HUANG Wei2LIU Shang-zhong1
1.Department of Gastroenterology,Yuebei People′s Hospital of Shaoguan City in Guangdong Province,Shaoguan 512026, China;2.Department of Pathology,Yuebei People′s Hospital of Shaoguan City in Guangdong Province,Shaoguan 512026, China
ObjectiveTo explore the diagnostic value of endoscopic smart spectral colorimetric technique and hypoxiainducible factor-1α(HIF-1α)expression in colorectal polypoid lesions.MethodsThe mucosal surface of the duct openings subtle morphological classification and microvascular morphology of colorectal polypoid lesions was observed by endoscopic smart spectral colorimetric technique,and HIF-1α expression in lesions was detected by immunohistochemistry.ResultsThe duct openings and microvascular morphology typing form of inflammatory polyps and cancerous polyps had statistical difference(P<0.05).The HIF-1α expression of noplastic polyps was significantly higher than that of the inflammatory polyps,the difference was statistical(P<0.05).HIF-1α expression of colorectal polyps in different pit pattern and microvascular typing,the difference was significant(P<0.05).ConclusionEndoscopic smart spectral colorimetric technique can clearly observe the capillary membrane surface morphology and microstructure of patients with colorectal polyps,and be favor of early diagnosis of polypoid lesions.High expression of HIF-1α in tumor tissues of polyps is conducive to the early discovery of colon cancer.
Endoscopic smart spectral colorimetric technique;Hypoxia-inducible factor-1α;Colorectal polypoid lesions
R574.6
A
1674-4721(2014)03(c)-0038-03
2014-01-21本文编辑:郭静娟)

