凋亡抑制基因在急性白血病及骨髓增生异常综合征中的研究
魏百合 叶 芳 李国霞 王宏伟 周文峰 甄 祯 乔振华
山西医科大学第二医院血液科,太原 030013
凋亡抑制基因在急性白血病及骨髓增生异常综合征中的研究
魏百合 叶 芳▲李国霞 王宏伟 周文峰 甄 祯 乔振华
山西医科大学第二医院血液科,太原 030013
目的 探讨急性白血病及骨髓增生异常综合征患者骨髓凋亡抑制基因MCL-1、livin、aven的表达及临床意义。 方法 选取2012年9月~2013年12月本院收治的113例初发急性白血病患者,32例骨髓增生异常综合征患者及20例对照组患者(缺铁性贫血12例、血小板减少性紫癜8例)的新鲜骨髓液标本,采用RT-PCR方法检测MCL-1、livin、aven基因mRNA的表达水平及表达率。 结果AL组和MDS组MCL-1、livin、aven mRNA表达水平及阳性表达率分别高于对照组,差异有统计学意义(P<0.05)。MCL-1与livin基因mRNA的表达呈正相关(r= 0.586,P<0.05),MCL-1与aven基因的表达呈正相关(r=0.603,P<0.05),liven基因与aven基因表达无相关性(r=0,P>0.05)。 结论 3种凋亡抑制基因MCL-1、livin、aven基因mRNA在急性白血病及骨髓增生异常综合征中表达均增高。
MCL-1;Livin;Aven;急性白血病;骨髓增生异常综合征
细胞凋亡是多基因参与并严格控制的过程,可清除衰老、受损及有恶变倾向的细胞,对机体维持正常生理活动极为重要。凋亡过度将会提早终止正常细胞的活动,影响正常的生理功能;凋亡受抑将导致细胞存活时间延长,使易转化突变的细胞大量生长积累,最终导致肿瘤的发生,同时凋亡受抑也是导致癌细胞对化疗药物耐药的一个重要因素。近年来,关于细胞凋亡在急性白血病(acute leukemia,AL)及骨髓增生异常综合征(myelodysplastic syndrome,MDS)发病机制中的研究越来越多。凋亡抑制基因在AL发病机制中的研究较多,但在MDS发病机制中的作用研究较少。MDS具有向AL转化的高风险,所以明确凋亡抑制基因在MDS中的表达特点,有助于明确凋亡抑制基因在MDS中的发病机制,进而为MDS的靶向治疗提供理论依据。本课题主要对凋亡抑制基因MCL-1、livin、aven在初发AL和MDS患者中的表达进行研究。
1 材料与方法
1.1 材料
收集2012年9月~2013年12月本院收治的113例初发AL、32例MDS及20例(缺铁性贫血12例、血小板减少性紫癜8例)对照组患者的新鲜骨髓液标本,其中急性淋巴细胞白血病 (acute lymphoblastic leukemia,ALL)33例,男18例,女15例;急性髓细胞性白血病(acute myeloid leukemia,AML)80例,男46例,女34例;MDS患者32例,男14例,女18例。标本收集及提取总RNA,用EDTA抗凝管收集研究对象新鲜骨髓液1~2 ml。
1.2 标本采集方法
选取研究对象左或右侧髂后上脊为穿刺点,常规皮肤穿刺点碘伏消毒3次,戴无菌手套,铺无菌洞巾,抽取2%利多卡因注射液2 ml,自皮肤至骨膜逐层麻醉,麻醉后用穿刺针自穿刺点皮面进针,抵骨膜后左右旋转,进入骨髓腔,用20 ml无菌干燥注射器抽取2 ml新鲜骨髓液,用EDTA抗凝管收集。
1.3 实验方法及步骤
1.3.1 提取总RNA 采用Takara公司Trizol试剂提取研究对象新鲜骨髓液总RNA,并测定提取的RNA浓度,操作步骤如下:①1000 μl ddH2O+300 μl(新鲜骨髓液)裂解细胞,混匀,静置10 min;②12 000 r/min,4℃,离心1 min,弃上清(直接倒掉,少量用枪吸);③加800 μl Trizol(用枪吹起沉淀),再加160 μl氯仿(三氯甲烷)充分混匀;④12 000 r/min,4℃,离心10 min,取出时避免摇晃;⑤EP管(新)加异丙醇300 μl,少量(30 μl)的吸取上清于异丙醇中(≥200 μl),注意不要吸中间的白色沉淀物(蛋白),缓慢摇50次混匀,避免剧烈摇晃导致RNA断裂;⑥12 000 r/min,4℃,离心5 min,弃异丙醇(倒掉即可);⑦加70%乙醇300 μl(用枪把沉淀吹起来);⑧12 000 r/min,4℃,离心2 min,弃乙醇(充分弃净,倒掉后,用离心机甩一下,再用强吸,别碰壁,晾干);⑨加RNA溶解液20~30 μl(依量而定)DEPC水;⑩置-20℃保存。
1.3.2 cDNA的合成 引物设计均由上海生工生物工程公司合成。MCL-1:正义链为5′-CAAAAACGAAGACGATGTGAAA-3′,反义链为5′-AAAGGCACCAAAAGAAATGAGA-3′,扩增产物长度为109 bp;livin:正义链为5′-GAGCCAGTGTTCCCTCCAT-3′,反义链为5′-CTCCTCCTCTTCCTCCTCTGTC-3′,扩增产物长度为224 bp;aven:正义链为5′-ATGGAACCTGAGCAACCAAGTA-3′,反义链为5′-CGTTAGAAGGCAACCAAGATTT-3′,扩增产物长度为128 bp;GAPDH:正义链为5′-AGAAGGCTGGGGCTCATTTG-3′,反义链为5′-AGGGGCCATCCACAGTCTTC-3′,扩增产物长度为224 bp。总反应体系为10 μl,包括总RNA 2 μl、5×Prime ScriptRBuffer 2 μl、RNase Free dH2O 6 μl,混匀后,用离心机甩至底部;反应条件为37℃、15 min(反转录反应),85℃、5 s(反转录酶的失活反应),降至4℃,反应终止。
1.3.3 PCR 按照PCR反应试剂盒(Takara公司)说明书操作步骤进行。PCR反应体系为20 μl,包括逆转录产物2 μl,上、下游引物各0.8 μl,SYBRRPremix Ex TaqTmⅡ(2×)10 μl,ROX Reference Dye(50×)0.4 μl,dH2O 6 μl。扩增条件为:95℃预变性30 s,95℃变性5 s,60℃退火31 s,40个循环。
1.3.4 2-ΔΔCt法 采用 2-ΔΔCt法分析基因相对表达量,ΔΔCt=ΔCt样本-ΔCt对照,ΔCt=Ct(样本/对照)-Ct内参。
1.4 统计学处理
采用SPSS 17.0统计软件对数据进行分析和处理,计量资料以±s表示,采用单因素方差分析,计数资料采用χ2检验,相关性采用Pearson相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 3组MCL-1、livin、aven表达水平及表达率的比较
AL组和MDS组MCL-1、livin、aven mRNA的表达水平及阳性表达率分别高于对照组,差异有统计学意义(P<0.05)(表1)。
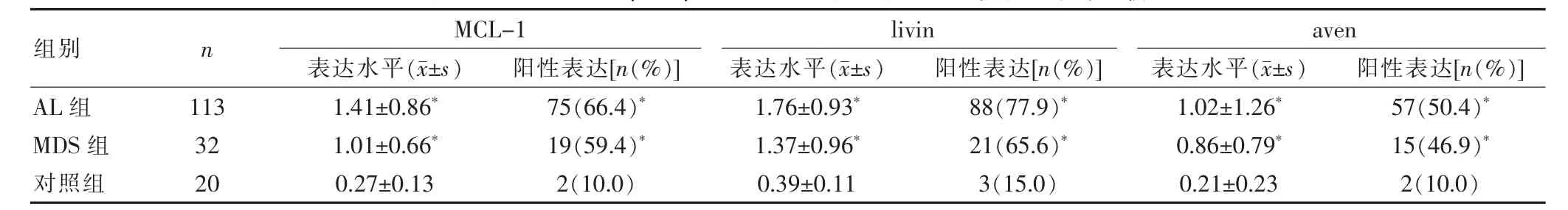
表1 3组MCL-1、livin、aven mRNA表达水平及阳性表达率的比较
2.2 MCL-1、livin、aven的相关性分析
MCL-1与livin的基因表达呈正相关 (r=0.586,P<0.05),在AL及MDS中表达均升高;MCL-1与aven的基因表达呈正相关 (r=0.603,P<0.05),在AL 及MDS中表达均升高;liven与aven的基因表达无相关性(r=0,P>0.05)。
2.3 MCL-1、livin、aven的扩增曲线和溶解曲线
内参基因GAPDH及凋亡抑制基因MCL-1、livin、aven的扩增曲线见图1~图4;MCL-1、livin、aven的融解曲线见图5。

图1GAPDH扩增曲线

图2MCL-1基因扩增曲线
图3 livin基因扩增曲线
图4 aven基因扩增曲线
图5 MCL-1、livin、aven基因融解曲线
3 讨论
目前AL及MDS的具体发病机制尚不十分明确,但是MDS有向AL转化的高风险。凋亡抑制基因参与肿瘤细胞的生长增殖,与肿瘤细胞的存在密切相关,研究凋亡抑制基因在恶性肿瘤中的作用机制,可以为恶性肿瘤的靶向治疗提供科学依据。
髓样细胞白血病-1(myeloid cell leukemia-1,MCL-1)基因是Bcl-2凋亡控制基因家族中的调控成员之一,MCL-1与Bcl-2间具有部分同源序列,Bcl-2家族中抗凋亡成员和促凋亡成员间可竞争性形成同源或异源二聚体(如Bcl-2/Bax、MCL-1/Bax等)而决定细胞是否凋亡[1],以调控细胞生存或凋亡平衡。MCL-1的过表达可以促进肿瘤形成,MCL-1的表达下调可促进肿瘤细胞凋亡、抑制肿瘤细胞增殖并导致其细胞周期阻滞;MCL-1在正常细胞及多种实体肿瘤及血液系统疾病中均有表达,MCL-1位于线粒体外膜,通过形成异源二聚体和(或)中和Bcl-2家族促凋亡蛋白(Bim或Bak),抑制细胞色素C释放,从而抑制细胞凋亡[2]。一直认为livin抑制细胞的程序化死亡(programmed cell death,PCD),即凋亡是通过直接抑制凋亡蛋白酶而实现。Vucic等[3]研究发现,livin可与caspase-3、caspase-9及caspase-9前体发生免疫共沉淀现象,由此推断livin可以通过抑制caspase-3 及caspase-9的活性而抑制细胞凋亡。aven已被确定为细胞凋亡的抑制剂,其作用机制为结合适配器蛋白APAF-1,防止凋亡体形成和线粒体凋亡[4]。
MDS早期有过多的凋亡发生,随着疾病进展,疾病后期,在抗凋亡基因作用下,MDS会向AL转化[5]。Bar等[6]采用RT-PCR方法对MCL-1在5例正常对照与11例MDS不同亚型中的表达进行分析,发现MCL-1表达在MDS患者骨髓液与正常骨髓液对照相比明显降低,且在MDS各亚型中表达逐渐减少。Economopoulou等[7]在对50例MDS不同亚型研究中发现,抗凋亡基因Bcl-xL和MCL-1表达增加,与低危组相比,MCL-1在MDS高危组中表达明显增加,而 caspase-8、caspase-3、caspase-6、caspase-5、caspase-2、caspase-7和颗粒酶 B在MDS中的表达下降,表明MCL-1在MDS的发生、发展中抑制了有恶性潜能的细胞凋亡,且MCL-1与凋亡信号蛋白caspase-8、caspase-3、caspase-6、caspase-5、caspase-2、caspase-7在MDS中的表达可能呈负相关。本研究中MCL-1在AL、MDS中表达均增高,与Economopoulou 等[7]研究结果一致,但与Bar等[6]研究结果不一致,可能与其研究标本量少有关,也可能MCL-1在MDS中的作用机制有其他途径而改变了mRNA表达量,有待进一步研究。芦慧霞等[8]在研究Bcl-2基因家族成员调控2-甲氧基雌二醇(2-ME)诱导MDS细胞凋亡的机制中发现,2-ME增强细胞内caspase-3活性,呈浓度和时间依赖性(P<0.05);随着2-ME浓度增加,细胞内MCL-1 mRNA表达下降(P<0.05),且MCL-1 mRNA表达量与相应时间点caspase-3活性呈负相关(r=-0.992,P<0.01),表明2-ME可能通过下调MCL-1表达和增强caspase-3活性的途径来调控MDS细胞凋亡,加速细胞凋亡。
Wang等[9]采用RT-PCR方法研究抗凋亡基因livin在急性非淋巴细胞性白血病(ANLL)细胞中的表达水平,结果显示46例ANLL成年患者中livin基因的mRNA水平与正常对照组比较,ANLL患者livin基因的mRNA水平显著高于正常对照组,同时降低患者均完全缓解,在复发的ANLL患者中,livin的表达水平再次升高。livin基因的高表达可能成为ANLL预后不良的标志物。Lü等[10]采用RT-PCR和Western blot方法研究siRNA对K562细胞livin表达和功能的影响,结果表明livin基因的siRNA可以抑制livin的抗凋亡作用,通过下调livin基因的表达,从而阻止疾病进展,这可能提供了新的抗白血病的研究方法。Choi 等[11]采用RT-PCR方法研究222例儿童ALL患者livin的表达,结果显示有良好预后因素的患者,livin基因的表达率和表达水平均较高,经过7 d诱导化疗骨髓反应良好的患者表达率也较高(P<0.05);livin基因表达与复发缺失相关,类似的有livin基因表达的患者比无livin基因表达患者的无复发存活率高(P<0.05);无复发存活率的多因素分析表明,livin基因在儿童ALL的表达是一个独立的预后良好因素。李建厂等[12]采用RT-PCR方法检测31例ALL及22例AML患儿白血病细胞livin mRNA的表达水平,结果表明在AML和ALL患儿中livin mRNA的表达均增高,且livin mRNA阳性患儿的缓解率明显低于livin mRNA阴性患儿。李文琦[13]采用半定量逆转录PCR方法检测95例成人ALL患者骨髓中livin mRNA的表达情况,发现livin在ALL中表达增高,且与ALL的预后相关。耿素霞等[14]在应用RT-PCR方法检测69例AML患者凋亡抑制基因aven mRNA的表达情况时,发现初发AML患者aven基因mRNA的表达水平显著升高,且aven mRNA在复发组较无复发组中表达明显升高,表明aven mRNA的表达与AML的发病及进展可能有关。Eiβmann等[4]的研究发现,aven在AL中表达增高,可以视为血液系统肿瘤的癌蛋白。Choi等[15]在研究91例儿童ALL中aven mRNA的表达在ALL组中显著高于正常对照组,提示aven基因是ALL的不良预后因素。
本研究结果显示,MCL-1、livin、aven三种凋亡抑制基因在AL及MDS中表达均增高,对于复发组表达高于缓解组,有待进一步验证;三种凋亡抑制基因在AL及MDS中表达比对照组高,但MDS标本量有限,在MDS不同亚型中的表达有待进一步研究;三种基因的表达存在相关性;凋亡抑制基因的表达可能与MDS的分型相关;三种基因可作为判断AL预后的新指标,为恶性血液病的靶向治疗及评估预后提供依据;MDS的诊断与靶向治疗能否从这三种凋亡抑制基因中找到新的突破,需进一步研究。
[1]Jacobson MD.Apoptosis:Bcl-2-related proteins get connected[J].Curr Biol,1997,7(5):R277-R281.
[2]Cuconati A,Mukherjee C,Perez D,et al.DNA damage response and MCL-1 destruction initate apoptosis in adenovirus-infected cells[J].Genes Dev,2003,17(23):2922-2932.
[3]Vucic D,Stennicke HR,Pisabarro MT,et al.ML-IAP,a novel inhibitor of apoptosis that is preferentially expressed in human melanomas[J].Curr Biol,2000,10(21):1359-1366.
[4]Eiβmann M,Melzer IM,Fernández SB,et al.Overexpression of the anti-apoptotic protein AVEN contributes to increased malignancy in hematopoietic neoplasms[J].Oncogene,2013,32(20):2586-2591.
[5]Parker JE,Mufti GJ,Rasool F,et al.The role of apoptosis, proliferation,and the Bcl-2-related proteins in the myelodysplastic syndromes and acute myeloid leukemia secondary to MDS[J].Blood,2000,96(12):3932-3938.
[6]Bar M,Stirewalt D,Pogosova-Agadjanyan E,et al.Gene expression patterns in myelodyplasia underline the role of apoptosis and differentiation in disease initiation and progression[J].Transl Oncogenomics,2008,3:137-149.
[7]Economopoulou C,Pappa V,Papageorgiou S,et al.Cell cycle and apoptosis regulatory gene expression in the bone marrow of patients with de novo myelodysplastic syndromes(MDS)[J].Ann Hematol,2010,89(4):349-358.
[8]芦慧霞,夏国华,陈宝安,等.Mcl-1和Bax基因在2-甲氧基雌二醇诱导骨髓增生异常综合征细胞凋亡中的调控作用[J].中国实验血液学杂志,2009,17(5):1246-1248.
[9]Wang XJ,Sun H,Wang GY,et al.Expression of anti-apoptosis livin gene in acute non-lymphocytic leukemia cells and its clinical significance[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2008,16(1):35-37.
[10]Lü J,Chen ZC,Li QB,et al.siRNA-induced down-regulation of Livin expression increases spontaneous apoptosis in K562 cell line[J].Zhongguo Shi Yan Xue Ye Xue Za Zhi,2012,20(2):258-261.
[11]Choi J,Hwang YK,Sung KW,et al.Expression of Livin,an antiapoptotic protein,is an independent favorable prognostic factor in childhood acute lymphoblastic leukemia [J].Blood,2007,109(2):471-477.
[12]李建厂,贾秀红,唐慎华,等.Livin基因在儿童急性白血病中的表达及其意义[J].肿瘤防治研究,2012,39(1):41-43.
[13]李文琦.Livin和Survivin在成人急性淋巴细胞白血病中的表达及临床意义[D].长沙:中南大学,2010.
[14]耿素霞,杜欣,翁建宇,等.凋亡抑制基因aven在急性髓系白血病的表达及其临床意义[J].中国实验血液学杂志,2009,17(6):1424-1428.
[15]Choi J,Hwang YK,Sung KW,et al.Aven overexpression:association with poor prognosis in childhood acute lymphoblastic leukemia[J].Leuk Res,2006,30(8):1019-1025.
Thereserch ofapoptosissuppressorgenein acuteleukemia and myelodysplastic syndrome
WEI Bai-he YE Fang▲LI Guo-xia WANG Hong-weiZHOU Wen-feng ZHEN Zhen QIAO Zhen-hua
Department of Hematology,the Second Hospital of Shanxi Medical University,Taiyuan 030013,China
ObjectiveTo study the expression of the apoptosis suppressor MCL-1,livin and aven in acute leukemia and myelodysplastic syndrome and its clinical significance.Methods113 patients with newly diagnosed acute leukemia patients were selected from September 2012 to December 2013 in our hospital,32 cases of myelodysplastic syndrome patients and 20 cases of control group patients(12 patients with iron deficiency anemia,8 cases with thrombocytopenia purpura),whose fresh bone marrow samples were collected.RT-PCR method was used for detection of MCL-1,livin,aven gene expression and mRNA expression.ResultsThe mRNA expression and positive expression rate of MCL-1,livin, aven in AL group and MDS group was higher than that in control group respectively,with statistical difference(P<0.05). The expression of MCL-1 was positively correlated to the expression of livin(r=0.586,P<0.05),the expression of MCL-1 was positively correlated to the expression of aven(r=0.603,P<0.05),no correlation between the expression of livin and the expression of aven(r=0,P>0.05).ConclusionThe expression of apoptosis suppressor MCL-1,livin and aven were upregulated in aute leukemia and myelodysplastic syndrome.
MCL-1;Livin;Aven;Acute leukemia;Myelodysplastic syndrome
R557
A
1674-4721(2014)03(c)-0015-05
2014-01-26本文编辑:李亚聪)
山西省国际科技合作项目 (2012081044-1);山西省留学基金(晋留管办发[2009]9号106);山西省人事厅归国留学人员择优资助项目(晋财社[2011]172号)
▲通讯作者

