VEGF基因转染间充质干细胞移植与单纯间充质干细胞移植对大鼠心肌梗死的疗效对比
朱 磊 李鲲鹏 马 捷
山西医科大学第二临床医院,太原 030001
VEGF基因转染间充质干细胞移植与单纯间充质干细胞移植对大鼠心肌梗死的疗效对比
朱 磊 李鲲鹏 马 捷
山西医科大学第二临床医院,太原 030001
目的 探讨VEGF基因转染骨髓间充质干细胞与单纯骨髓间充质干细胞移植对大鼠心肌梗死的疗效。 方法 将SD大鼠建立心肌缺血模型,1周后随机取30只采用随机分组法分为3组,A组为联合移植组,B组为单纯干细胞移植组,C组为对照组,通过一系列检测,对比3组的疗效。 结果 A组的疗效优于B组和C组,B组的疗效优于C组 (P<0.05)。 结论 VEGF基因转染骨髓间充质干细胞移植比单纯骨髓间充质干细胞移植的综合疗效好。
心肌梗死;血管内皮细胞生长因子;骨髓间充质干细胞;基因转染
临床上心肌缺血多发生在40岁以后,但随着人民生活水平的提高,目前心肌缺血在我国的患病率呈逐年上升趋势。以往多采用传统方法治疗心肌缺血,如药物治疗、介入治疗及外科手术治疗(冠状动脉旁路移植术)。近年来,随着人们对骨髓间充质干细胞研究的深入,骨髓间充质干细胞和血管内皮生长因子(VEGF)基因转染间充质干细胞对心肌缺血均有一定的疗效,在治疗心肌缺血方面已表现出传统治疗方法所无可比拟的优越性[1],但是这两种方法究竟哪一种疗效更好,少有报道。骨髓间充质干细胞是一类具有自我更新和多向分化潜能的非造血干细胞,属于成体干细胞的一种,在适当微环境和影响因子的作用下可以分化为多个胚层来源的细胞,甚至可以重建简单的组织结构,且其在体外的低免疫原性,为间充质干细胞在临床上的应用提供了可能性[2-3]。VEGF是一种特异性促使血管内皮细胞增殖的有丝分裂原,是机体内促进血管生成最主要的生长因子,功能是促进血管内皮细胞生长,启动血管形成和增加血管通透性,能与内皮细胞表面的特异性受体结合,强烈地促进血管内皮细胞增殖,诱导血管生成,在胚胎发育、创伤修复、侧支循环建立等病理生理过程中发挥重要作用[4]。
1 材料与方法
1.1 材料
SD大鼠(山西医科大学动物实验中心),DMEM培养基,胎牛血清(Hyclone),四甲基偶氮唑盐(MTT)(Sigma),携人VEGF腺病毒载体,0.25%胰蛋白酶 (华美公司),0.02%乙二胺四乙酸 (EDTA),ELISA试剂盒(博士德),jet-PEI细胞转染试剂盒(晶美),5-溴脱氧尿嘧啶(BrdU,博士德)
1.2 实验方法
1.2.1 大鼠骨髓间充质干细胞的培养 处死大鼠,无菌条件下获取大鼠股骨和胫骨,使用DMEM培养基冲洗骨髓腔,将冲洗后的悬液直接接种在DMEM培养基中(含10%胎牛血清、100 U/ml青霉素、100 U/ml链霉素),置于37℃、5%CO2饱和湿度的细胞培养箱中培养。24 h和72 h各换液1次,去除非贴壁细胞,以后每3天换液1次。当细胞生长达到80%~90%融合时,用0.25%胰蛋白酶和0.02%EDTA消化,以1∶3传代扩增培养,到第3代时细胞可用于以后的实验。
1.2.2 将携人VEGF腺病毒载体转染骨髓间充质干细胞 将大鼠第三代骨髓间充质干细胞接种至12孔培养板,培养至90%融合时,弃去培养上清。按jet-PEI试剂盒说明书操作步骤对其进行转染。
1.2.3 骨髓间充质干细胞的标记 BrdU-可代替胸腺嘧啶在DNA合成的S期,活体注射或细胞培养加入,然后利用抗BrdU单克隆抗体,ICC染色,显示增殖细胞[5]。将转染的骨髓间充质干细胞或骨髓间充质干细胞以3 μmol/L的BrdU培养24 h后换液,继续培养24 h,即可等待移植。
1.2.4 大鼠急性心肌缺血模型的建立 选取40只健康成年SD大鼠,称重后,使用3%戊巴比妥钠(45 mg/kg)腹腔注射,并固定于手术板上,行气管插管,呼吸机辅助呼吸。心前区备皮,常规消毒铺单,在第3或第4肋间横向切口开胸,切开心包。在动脉圆锥与左心耳之间冠状动脉处结扎左冠状动脉前降支。心电图检测ST段明显抬高和(或)异常Q波出现表示建模成功。迅速缝合胸腔,待大鼠恢复自主呼吸后,停止人工辅助呼吸。术后应用青霉素3 d,400 000 U/d,继续饲养。
1.2.5 细胞移植和实验分组 40只用于制作模型的大鼠有8只在<6 h死亡,在大鼠心肌缺血模型成功建立1周后,随机选择30只大鼠,采用随机分组法分为3组,每组10只。A组为联合移植组:将VEGF转染骨髓间充质干细胞 (1×106)与无血清DMEM配置成200 μl,将大鼠暴露心脏,使用微量注射器经心外膜途径在心肌梗死中央及外周移植细胞50 μl/点;B组为单纯干细胞移植组:使用同等量的骨髓间充质干细胞与DMEM制成细胞悬液,采用同等方法注入大鼠心肌;C组为对照组:使用等量DMEM培养液,采用A组和B组的方法注入大鼠心肌。
1.3 检测方法
1.3.1 超声心动图检查 模型建立后,在细胞移植前和细胞移植后第3周分别采用超声心动图检测射血分数(EF),每只测量3个心动周期,取平均值。
1.3.2 免疫组织化学检查 细胞移植后第4周处死大鼠,制作心肌细胞连续切片,并进行HE常规染色和BrdU染色,确定心肌细胞的存活与分化。
1.3.3 新生毛细血管密度计数 在200倍光学显微镜下观察并统计毛细血管数量,每张切片随机取4个视野,取其平均数。
1.4 统计学处理
采用SPSS 10.0统计软件对数据进行分析和处理,计量资料以±s表示,组间比较采用F检验,两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 3组大鼠细胞移植前后EF的比较
细胞移植后3周,A组的EF高于B组和C组,B组的EF高于C组,差异有统计学意义(P<0.05)(表1)。
表1 3组大鼠细胞移植前后EF的比较(%,±s)

表1 3组大鼠细胞移植前后EF的比较(%,±s)
与A组比较,*P<0.05;与C组比较,#P<0.05
组别 n 细胞移植前 细胞移植后3周A组B组C组10 10 10 43±13 44±12 42±12 64±20 53±15*#37±16*
2.2 3组大鼠细胞移植后4周BrdU细胞个数的比较
细胞移植后4周,A组的BrdU细胞个数多于B组和C组,B组的BrdU细胞个数多于C组,差异有统计学意义(P<0.05)(表2)。细胞移植后4周,A组和B组大鼠的梗死心肌均可以找到BrdU阳性移植细胞,C组则无(图1)。
表2 3组大鼠细胞移植后4周BrdU细胞个数的比较(个/高倍视野,±s)

表2 3组大鼠细胞移植后4周BrdU细胞个数的比较(个/高倍视野,±s)
与A组比较,*P<0.05;与C组比较,#P<0.05
组别 n 细胞移植后4周A组B组C组10 10 10 390±92 310±85*#0±0*

图1 3组大鼠BrdU染色结果(×200)
2.3 3组大鼠细胞移植后4周新生血管计数的比较
细胞移植后4周,A组的新生血管计数多于B组和C组,B组的新生血管计数多于C组,差异有统计学意义(P<0.05)(表3)。细胞移植后4周,3组心肌细胞梗死区域均可见新生毛细血管影(图2)。
表3 3组大鼠细胞移植后4周新生血管计数的比较(个/高倍视野,±s)

表3 3组大鼠细胞移植后4周新生血管计数的比较(个/高倍视野,±s)
与A组比较,*P<0.05;与C组比较,#P<0.05
组别 n 细胞移植后4周A组B组C组10 10 10 34±12 28±11*#19±8*
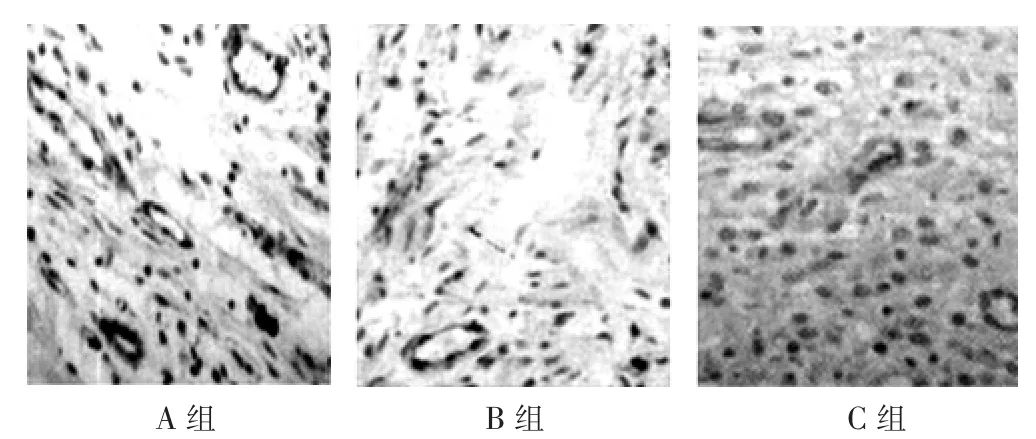
图1 3组大鼠HE染色结果(×200)
3 讨论
本实验结果显示,基因修饰骨髓间充质干细胞移植比单纯骨髓间充质干细胞移植的效果更明显,说明VEGF与骨髓间充质干细胞具有协同治疗心肌梗死的作用,原因可能是VEGF转染骨髓间充质干细胞后移植到梗死区域,使新生血管数目增加更多;骨髓间充质干细胞能向内皮细胞分化,参与移植后血管生成,并分泌VEGF[6-7]。心肌干细胞移植及联合移植是一个新兴的研究领域,移植细胞的活力受到心肌梗死多种不利因素的影响,包括:凋亡、缺少营养、缺血、宿主的相关因子、炎症和免疫应答等[8]。目前仍有许多问题尚待解决,如选择对人体无损害又便于追踪的标志物;移植的最佳途径、最佳时机、细胞数量尚不明确 (剂量过大可产生较多不良反应)[9];细胞移植后能否在宿主体内长期存活并正常增殖、分化等。同时基因修饰干细胞的移植过程很复杂,在将来工作中开展一种简单的过程替代骨髓间充质干细胞的分离、转染和外科注射的常规操作很有必要。
综上所述,VEGF基因转染骨髓间充质干细胞移植比单纯骨髓间充质干细胞移植对心肌梗死的综合疗效好。
[1]Laflamme MA,Murry CE.Regenerating the heart[J].Nat Biotechnol,2005,23(7):845-856.
[2]Toma C,Pittenger MF,Cahill KS,et al.Human mesenchymal stem cells differentiate to a cardiomyocyte phenotyoe in the adult murine heart[J].Circulation,2002,105(1):93-98.
[3]Mosca JD,Hendricks JK,Buyaner D,et al.Mesenchymal stem cells as vehicles for gene delivery[J].Clin Orthop Realt Res,2000,(379 Suppl):S71-S90.
[4]Vale PR,Losordo DW,Milliken CE,et al.Left ventricular electromechanical mapping to assess efficacy of phVEGF (165)gene transfer for therapeutic angiogenesis in chronic myocardial ischemia[J].Circulation,2000,102(9):965-974.
[5]解慧琪,杨志明,魏人前.PtsA58H质粒转化人胚腱细胞的生物学特性研究[J].中华手外科杂志,2000,16(3):136-139.
[7]McGonagle D,De Bari C,Arnold P,et al.Lessons from musculoskeletal stem cell research:the key to successful regenerative medicine development[J].Arthritis Rheum,2007,56 (3):714-721.
[8]Tran N,Li Y,Maskali F,et al.Short-term heart retention and distribution of intramyocardial delivered mesenchymal cells withinnecroticorintactmyocardium[J].CellTransplant,2006,15(4):351-358.
[9]盛小刚,宋卉,冯建章,等.转染人血管内皮生长因子165基因的骨髓间充质干细胞移植改善兔心肌梗死后心功能[J].中国动脉硬化杂志,2006,14(8):669-672.
Curative effect comparison of mesenchymal stem cell transplantation by VEGF gene transfection and simple mesenchymal stem cell transplantation in rat with myocardial infarction
ZHU LeiLI Kun-peng MA Jie
The Second Clinical Hospital of Shanxi Medical University,Taiyuan 030001,China
ObjectiveTo investigate the curative effect comparison of bone marrow mesenchymal stem cell transplantation by VEGF gene transfection and simple bone marrow mesenchymal stem cell transplantation in rat with myocardial infarction.MethodsThe myocardial ischemia model of SD rat was established,after 1 week and 30 rats were randomly selected and divided into 3 groups,group A was transplantation group,group B was simple stem cell transplantation group,group C was control group.Through a series of tests,curative effect of three groups was compared.ResultsCurative effect in Group A was better than that in group B and group C respectively,curative effect in group B was better than that in group C(P<0.05).ConclusionThe comprehensive curative effect of bone marrow mesenchymal stem cell transplantation by VEGF gene transfection is better than that of simple bone marrow mesenchymal stem cell transplantation.
Myocardial infarction;Vascular endothelial growth factor;Bone marrow mesenchymal stem cells;Gene transfection
R542.2+2
A
1674-4721(2014)03(c)-0009-03
2014-01-20本文编辑:李亚聪)

