血塞通注射液对缺氧缺糖/再灌注SH-SY5Y神经细胞线粒体损伤的影响*
郑宏
(北京中医药大学东直门医院,北京 100007)
血塞通注射液对缺氧缺糖/再灌注SH-SY5Y神经细胞线粒体损伤的影响*
郑宏
(北京中医药大学东直门医院,北京 100007)
目的观察血塞通注射液对缺氧缺糖/再灌注SH-SY5Y神经细胞线粒体损伤的影响。方法 采用MTT比色法(四唑盐比色实验)测定线粒体活性,流式细胞仪测定凋亡细胞百分率,观察不同剂量血塞通注射液(血塞通0.0781 μL、0.0391 μL、0.0195 μL)对神经细胞线粒体损伤的影响。结果神经细胞缺氧缺糖4 h再给氧12 h、24 h细胞线粒体活性明显降低,神经细胞凋亡率明显增加。血塞通注射液0.0781 μL、0.0391 μL组与模型组比较在线粒体活性12 h OD值差异有统计学意义(P<0.05),0.0391 μL组测定24 h OD值仍有明显差异(P<0.05)。血塞通0.0781 μL、0.0391 μL组12 h的神经细胞凋亡率与模型组比较差异有统计学意义(P<0.01);0.0391 μL、0.0195 μL组24 h的神经细胞凋亡率与模型组差异明显(P<0.01)。结论不同剂量血塞通注射液能够明显提高神经细胞线粒体活性,并且不同程度抑制经细胞凋亡率的增加。
血塞通注射液 神经细胞凋亡 线粒体损伤
缺血性脑血管的病理损害主要包括缺血性和缺血/再灌注性损害,两者可导致神经细胞的死亡。近年研究发现,线粒体损伤是缺血性脑细胞损伤过程中的重要环节[1]。线粒体又是细胞核外唯一含DNA的细胞器,凋亡是由线粒体DNA和核DNA相互作用、双重调控的病理生理过程[2]。因此线粒体是缺血再灌注脑损伤的重要靶目标[3]。本实验选用SH-SY5Y神经细胞,采用缺氧缺糖/再灌注的方法,模拟人体缺血再灌注损伤,观察中药血塞通注射液(三七提取物三七总皂苷)对缺氧缺糖/再灌注SH-SY5Y神经细胞线粒体活性损伤、神经细胞凋亡率的影响,探讨其作用环节及机制。
1 材料与方法
1.1 实验器材 培养基为Gibco公司产品,血清为Hyclone公司产品,碘化丙啶和MTT为美国Sigma公司产品,尼莫地平为山东新华制药有限公司产品,血塞通注射液为黑龙江珍宝岛制药有限公司产品。5%CO2培养箱:德国HERAEUS-BB16型。超净工作台:北京半导体设备仪器厂JJT1300型。倒置相差显微镜:日本OLYMPUS IMT-2型。低速离心机:北京医用离心机厂生产LD4-2型。移液器:芬兰Labsystems Finnpipette系列。流式细胞仪:美国BD公司FACS Calibur型。
1.2 种板 SH-SY5Y神经细胞用含100%胎牛血清、100 U/mL的青霉素、100 U/mL链霉素的DMEM培养基培养。镜下观察细胞约90%汇合时,用消化液消化细胞,用完全培养基制成细胞悬液,调整细胞浓度为1×105/mL,96孔板每孔100 μL细胞悬液,T25培养瓶每瓶5 mL细胞悬液,放入37℃,5%CO2培养箱内培养。
1.3 缺氧缺糖/再复氧模型分组及给药方法 每种药物浓度根据MTT药物毒性实验结果进行选择。各药物组弃去原培养液,用无糖Earle’s液洗细胞2次,96孔板内换入的药物终浓度分别为每100 μL无糖Earle’s含尼莫地平2.5 μL、1.25 μL、0.625 μL,血塞通0.0781 μL、0.0391 μL、0.0195 μL;T25培养瓶内药物浓度分别为每100μL无糖Earle’s含尼莫地平12.5μL,血塞通0.781μL、0.391μL、0.195μL;正常组换成无糖Earle’s液。于37℃缺氧箱内缺氧培养4 h,后换入无血清DMEM培养基在37℃,5%CO2培养箱内分别培养12 h、24 h复氧。正常组在模型组及各药物组缺氧时进行正常培养,后与模型组和各药物组一起换成无血清培养基培养12 h、24h。
1.4 线粒体活性的测定 采用MTT比色法测定线粒体活性。96孔板中的各组细胞经缺氧/缺糖再给氧和药物处理后,吸弃各孔培养液,加入无血清培养基100 μL,再加入20 μL MTT,混匀,37℃温育4 h,弃去孔内培养液,每孔加入100 μL DMSO,震荡10 min,充分溶解有活性的细胞中生成的蓝色颗粒。用酶标仪在550 nm波长处测定OD值,酶标仪自动打印结果。根据结果进行细胞线粒体活力的测定。
1.5 凋亡细胞计数 经消化液消化收集细胞悬液后,1000×g离心5 min,弃上清液,用PBS洗1次,用70%乙醇4℃冰箱内固定12 h以上。取固定后的细胞用0.1 mmol/L磷酸盐缓冲液洗2遍并悬浮,后加入终质量浓度为20 mg/L的RNaseA,37℃恒浴1 h,再加入PI染液至终质量浓度50 mg/L,摇匀后4℃避光静置1 h,在FACS Calibur型流式细胞仪上计数1万个细胞,测定凋亡细胞所占比例。
1.6 统计学处理 应用SPSS10.0统计软件进行统计分析。计量资料以(±s)表示,采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组线粒体活性比较 见表1。与正常组相比,模型组神经细胞缺氧缺糖4 h再给氧12 h、24 h细胞线粒体活性降低(P<0.05或P<0.01),提示缺氧缺糖/再给氧损伤可明显造成神经细胞线粒体的损伤;血塞通注射液能够明显提高神经细胞线粒体活性。
2.2 各组缺氧缺糖/再灌注损伤神经细胞凋亡率比较见表2。神经细胞经过缺氧缺糖4 h再给氧12 h、24 h后神经细胞凋亡率明显增加,尼莫地平1.25 μL组和血塞通各剂量组能够不同程度抑制经细胞凋亡率的增加,与模型组相比有显著差异(P<0.05或P<0.01)。
3 结论
近年来,中医药在治疗缺血性脑损伤显示了良好的前景,已引起国内外医学的重视,但从线粒体入手的研究还不多。线粒体是产生和储存ATP的场所,在缺血缺氧条件下,一方面,线粒体酶活性的改变影响到线粒体的呼吸功能[4],使线粒体不能有效合成ATP;另一方面,线粒体从胞浆摄取过量的Ca2+,导致线粒体Ca2+升高[5],使氧化磷酸化效率降低,ATP合成减少。因此,线粒体损伤导致的能量代谢障碍是缺血性脑细胞损伤过程中的重要环节。线粒体作为细胞核外唯一含DNA的细胞器,还对细胞凋亡起着中心调控作用,细胞凋亡过程中的许多关键环节都与线粒体密切相关,如线粒体膜电位的丧失[6],导致氧化磷酸化脱偶联,氧自由基生成增多而细胞凋亡;线粒体内重要的细胞凋亡蛋白细胞色素C的释放[7],使Caspase家族活化,激活脱氧核糖核酸酶,水解核酸及细胞骨架蛋白,最终引起细胞凋亡。
表1 各组缺氧缺糖4 h复氧12 h、24 h线粒体OD值比较(±s)
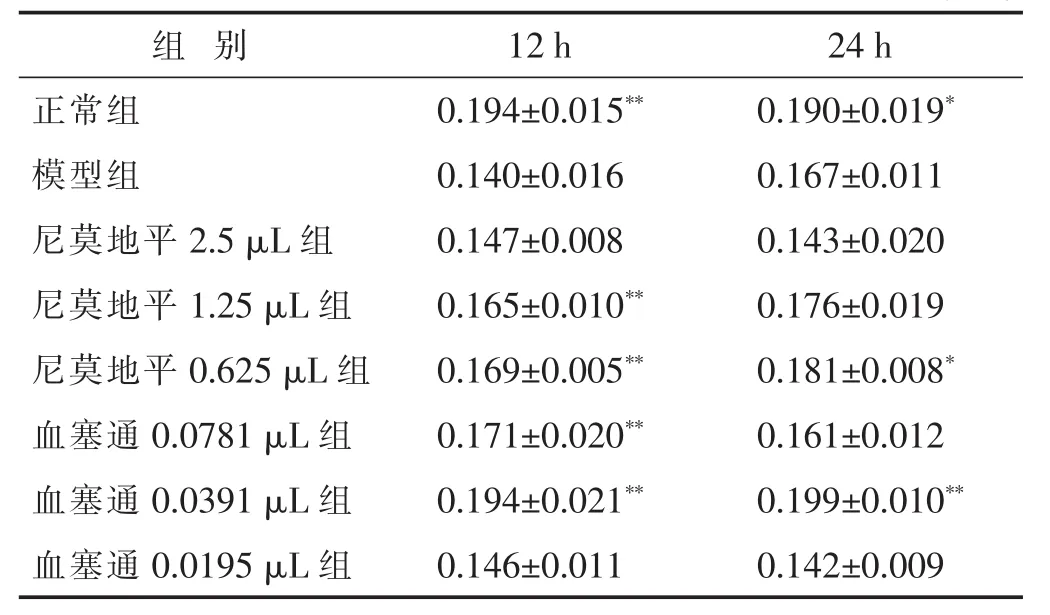
表1 各组缺氧缺糖4 h复氧12 h、24 h线粒体OD值比较(±s)
与模型组比较,*P<0.05,**P<0.01。下同。
组 别 12 h正常组 0.194±0.015**模型组 0.140±0.016尼莫地平2.5 μL组 0.147±0.008 24 h 0.190±0.019*0.167±0.011 0.143±0.020尼莫地平1.25 μL组 0.165±0.010** 0.176±0.019尼莫地平0.625 μL组 0.169±0.005** 0.181±0.008*血塞通0.0781 μL组 0.171±0.020** 0.161±0.012血塞通0.0391 μL组 0.194±0.021** 0.199±0.010**血塞通0.0195 μL组 0.146±0.011 0.142±0.009
表2 各组神经细胞缺氧缺糖4 h复氧1 2 h、2 4 h神经细胞凋亡率(%,x±s)
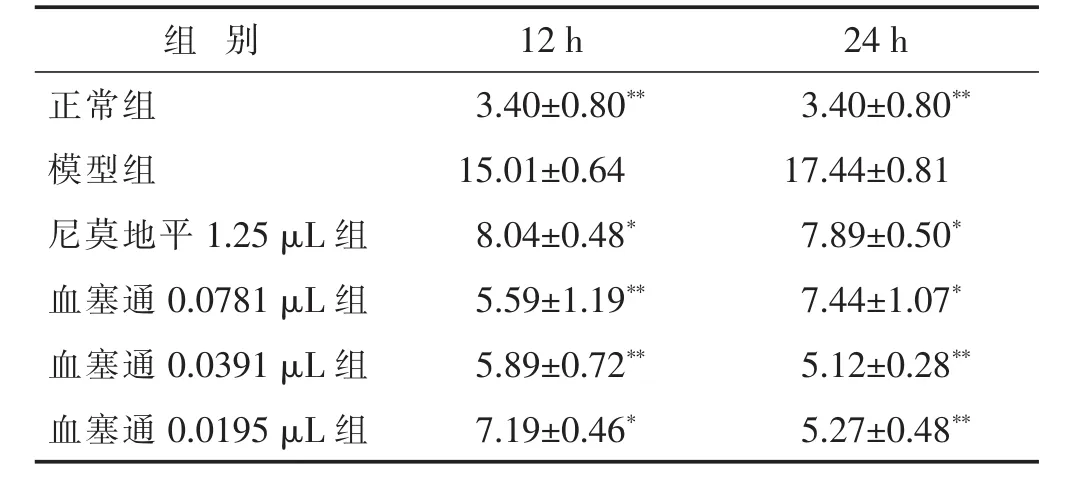
表2 各组神经细胞缺氧缺糖4 h复氧1 2 h、2 4 h神经细胞凋亡率(%,x±s)
组 别 12 h正常组 3.40±0.80**模型组 15.01±0.64 24 h 3.40±0.80**17.44±0.81尼莫地平1.25 μL组 8.04±0.48* 7.89±0.50*血塞通0.0781 μL组 5.59±1.19** 7.44±1.07*血塞通0.0391 μL组 5.89±0.72** 5.12±0.28**血塞通0.0195 μL组 7.19±0.46* 5.27±0.48**
血塞通注射液主要成分为三七总皂苷,临床具有保护心肌、抗心率失常、抗休克、降低动脉血压、抑制血小板聚集、增加心脑血流量等多方面的作用。实验研究表明三七总皂苷能降低细胞LDH的释放,降低细胞内Ca2+水平,使细胞凋亡及坏死神经元百分率明显降低,对缺血再灌注损伤的神经元有保护作用[8]。本实验选用SH-SY5Y神经细胞体外培养,采用缺氧缺糖/再灌注的方法,模拟人体缺血再灌注损伤,观察不同剂量血塞通注射液对缺氧缺糖/再灌注SH-SY5Y神经细胞线粒体活性损伤的影响。实验结果提示,血塞通注射液能够不同程度地提高神经细胞线粒体活性,并且不同程度抑制经细胞凋亡率的增加。
[1]Abe T,Takagi N,Nakano M,et al.The effects of monobromobimane on calcium and phenylarsineoxide-induced mitochondrial swelling and cytochrome C release in isolated brain mitochondria[J].Biol Pharm Bull.2004,27(4):524-527.
[2]Zou H,Li Y,Liu X,et al.An APAF-1.cytochrome c multimeric complex is a functional apoptosome that activates procaspase-9[J].J Biol Chem,1999,274(17):11549-11556.
[3]李露斯,汪青松,蔡昌启.缺血再灌注对脑线粒体磷脂、游离脂肪酸和呼吸的影响[J].中风与神经疾病杂志,1997,14(1):2-4.
[4]熊杰,冯亦璞.丁基苯酞对线粒体呼吸链复合酶活性的影响[J].药学学报,1999,34(4):241-245.
[5]Cano-Abad MF,Villarroya M,Garcia AG,et al.Calcium entry through L-type calcium channels causes mitochondrial disruption and chromaffin cell death[J].J Biol Chem,2001,276(43):39695-39704.
[6]管增伟,王盛兰,李勇,等.凋亡细胞膜和线粒体的动态变化[J].卫生研究,2000,29(2):83-86.
[7]Domanska-Janik K,Buzanska L.Neuroprotection by cyclosporin A following transient brain ischemia correlates with the inhibition of the early efflux of cytochrome C to cytoplasm[J].Brain Res Mol Brain Res,2004,121(1-2):50-59.
[8]朱陵群,范吉平,黄启福,等.三七总皂苷抗缺氧缺糖再给氧诱导大鼠海马神经细胞凋亡的研究[J].中国中药杂志,2003,28(1):52-54.
Influences of Xuesaitong Injection on Hypoxia/hypoglycem ia and Neuronal M itochondria Damage w ith SH-SY5Y Reperfusion
ZHENG Hong.Dongzhimen Hospital,Beijing University of Chinese Medicine,Beijing 100700,China
Objective:To observe the influences of Xuesaitong Injection on hypoxia/hypoglycemia and neuronal mitochondria apoptosis with SH-SY5Y-reperfusion.M ethods:Mitochondrion activity was detected by methyl thiazolyltetrazolium test(MTT).The apoptosis percentage was detected by flow cytometry to observe different influenceson neuronal mitochondria damage based on different density of Xuesaitong Injection used(0.0781 μL,0.0391 μL and 0.0195 μL).Results:After hypoxia-hypoglycemia treating for 4 hours and reoxygenation treating for 12 and 24hours,the neuron mitochondrion activity was decreased significantly.On the other hand,the apoptosis rate of neurons had distinct increase.Conclusion:Xuesaitong Injection with various density could enhance neuronal mitochondria activity significantly and inhibit the increase of neuron apoptosis percentage accordingly.
Xuesaitong Injection;Neuron apoptosis;Mitochondrial damage
R285.5
A
1004-745X(2014)03-0437-03
10.3969/j.issn.1004-745X.2014.03.024
2013-12-09)
北京中医药大学校级课题(2005X72)

