医院门诊药房药品贮藏管理风险分析与评价
(中国人民解放军总医院第一附属医院药剂药理科,北京 100048)
药品质量保障是安全用药的前提,而正确、合理地贮藏药品又是保证药品质量的基础。药品说明书作为了解药品信息的重要来源,在整个药品质量管理体系中占有举足轻重的地位。因此,药品的贮藏条件必须严格遵循药品说明书规定,若药品理化性质改变,将导致药品变质或失效,降低用药疗效,甚至产生不良反应,影响患者安全、有效地用药[1]。为进一步做好药品贮藏管理工作,确保药品在有效期内的质量,防止潜在临床用药风险的发生,现对我院门诊药房药品说明书中贮藏项内容进行分类整理和分析。
1 资料与方法
资料均来自我院门诊药房药品说明书中贮藏项内容,本次调查药品共计1 029种,其中西药740种,中成药238种,生物制品51种。依据2010年版《中国药典》凡例中药品贮藏项下的规定,并结合《中华人民共和国药品管理法》《药品说明书和标签管理规定》《关于印发化学药品和生物制品说明书规范细则的通知》及《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》的有关规定,应用Excel 2007软件对我院门诊药房药品说明书中贮藏项,按标准贮藏术语表述、非标准贮藏术语表述、具体贮藏温度标注等情况进行数据统计和分析。
2 结果与分析
2.1 统计结果
标准贮藏术语表述情况:贮藏项是药品说明书中的药品质量保障信息。调查发现,标准术语表述中,密封标准表述所占比例最大,详见表1。
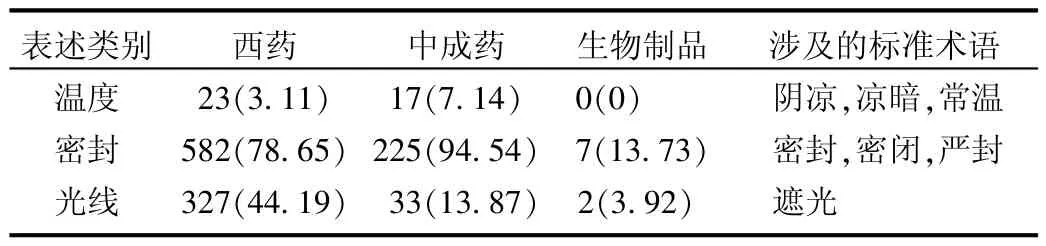
表1 药品说明书标准贮藏术语表述情况[种(%)]
非标准贮藏术语表述情况:调查的所有药品说明书均设有贮藏项,但规范表述实在匮乏,建议规范药品贮藏表述,以便患者获取药品的最佳贮藏信息,保障用药质量,详见表2。

表2 药品说明书非标准贮藏术语表述情况[例(%)]
具体贮藏温度标注情况:调查发现,1029种药品中,139种(13.51%)标注了“A-”温度表述,但表述方式繁杂;模糊温度表述涉及318种药品,占30.90%,表现为“以下”“以上”“不超过”表述;其他表述涉及西药1种(0.10%),具体温度表述为“25℃(15~30℃亦可接受)”。238种中成药具体温度表述标注率为22.27% (53/238),其中表述为10~30℃2种(0.84%),10~15℃1种(0.42%),15~30℃1种(0.42%),25℃以下3种(1.26%),30℃以下2种(0.84%),不超过20℃43种(18.07%),不超过25℃1种(0.42%);51种生物制品具体温度表述标注率为100.00%,其中表述为2~10℃2种(3.92%),2~8℃41种(80.39%),4~25℃1种(1.96%),10℃以下1种(1.96%),25℃以下2种(3.92%),不超过20℃3种(5.88%),不超过30℃1种(1.96%)。此外,为保证药品质量安全,大多数生物制品对贮藏项进行了详细的补充说明。740种西药药品说明书具体贮藏温度标注情况,详见表3。
2.2 分析
2.2.1温度表述情况分析
贮藏温度是确保药品质量的重要因素之一,温度过高或过低均会导致药品变质失效。《中国药典》凡例在贮藏项下规定:阴凉处系指不超过20℃;凉暗处系指避光并不超过20℃;冷处系指2~10℃;常温系指10~30℃。另外,《中国药典》虽未规定“冷藏”具体温度,但在药品说明书中一般系指2~8℃。调查显示,中成药贮藏温度缺失现象最严重,其次为西药;生物制品不同于一般医用药品,运输采用冷链方法,对贮藏温度有特殊要求,如胰岛素尚未使用时应冷藏于2~8℃,而打开包装使用后,由于冰箱中潮气较大,不宜继续放置于冰箱,否则会造成药品变质,因此应规范药品贮藏温度表述,使之趋于量化和细化[2]。
近年来,随着药物品种大量增加,贮藏温度的表述形式各种各样,增加了药品管理者和使用者的贮藏管理难度。如贮藏温度为2~8℃的注射用胸腺法新与贮藏温度为0~5℃的前列地尔,一般均放于2~8℃冰箱内,然而由于药房调剂药品时冰箱门开关较为频繁,很难保证任何时候贮藏温度均能恰好控制在2~5℃。调查发现,有些药品贮藏温度要求过窄,如夫西地酸乳膏要求15~20℃贮藏,难以保证药品各个流通环节均在该贮藏条件下。希望将药品贮藏温度要求放宽,使得药品贮藏管理具有可操作性,这就需要大量的临床试验研究提供数据支撑[3]。

表3 740种西药药品说明书具体贮藏温度标注情况
此外,大多数患者不仔细阅读药品说明书贮藏项,对专业术语的认识也很模糊,并且也不了解未规定贮藏温度即是指常温,不当的贮藏措施极易造成潜在的安全隐患。作为药师,在窗口用药交代时,尤其对路途遥远的外地患者有责任特殊指明阴凉处、凉暗处、冷处、常温等专业术语代表的具体温度。然而,对法定贮藏术语作误导注解也会影响用药安全,如依降钙素注射液要求“室温保存(不超过25℃)”,使医务人员和患者极易造成贮藏困扰,若按错误的注解操作,直接影响患者用药质量。另外,大多数药品说明书对贮藏温度不定上、下限,仅用“以下、以上、不超过”等含糊不清的词语进行描述,实在令人费解,管理部门应加大此类药品的贮藏标注监管力度,规范药品说明书贮藏项表述。同时,建议药品说明书补充药品常温贮藏有效期,以保障患者的安全、有效用药。
2.2.2光线表述情况分析
日光中的紫外线通过影响药物分子内部变化,加速药品氧化分解,可降低药效甚至产生药物毒性。尤其是注射剂配制成注射溶液后,若强光照射极易发生临床不良反应。药品说明书贮藏项下光线表述不当,或医务人员、患者对需避光贮藏的药品认识不足、贮藏不当,往往会造成药物浪费和不必要的危害[4]。
《中国药典》凡例在贮藏项下规定:遮光系指用不透光的容器包装,如棕色容器或黑色包装材料包裹的无色透明、半透明容器。当药品以整包装形式贮藏于药房时,是完全满足遮光要求的,然而在药品调剂拆零时,尤其是注射剂,均会出现遮光问题。如甲钴胺注射液药品说明书贮藏下标示药品需维持避光保护袋的状态保存,因为安瓿瓶外露会使药物见光分解、含量减低;盐酸肾上腺素注射液作为高危药品,遇光颜色加深、毒性增大,很容易因剂量掌握不当造成医疗事故。调查发现,药品说明书贮藏项下标示“遮光”规定的药品未达50%,导致药师在实际工作中也常常忽视药品需要“遮光”这一贮藏要求,增加了临床用药风险系数。此外,为了方便临床需求,一些药物常常拆零分装,如苯妥英钠片、左甲状腺素钠片等,但它们对光线均有要求,若分装后不采取遮光措施,会严重影响药品质量,尤其应警惕药品外观无改变但药品成分含量和性质改变的情况。因此,建议统一规范厂家对药品说明书贮藏项下的光线表述,加强医务人员对药品光线要求的重视。另外,中成药复方注射剂组分复杂且有效成分不明确,加之含有大量未知成分,医务人员应严格按照药品说明书贮藏要求做好日常药品管理工作。
2.2.3密封表述情况分析
空气中的氧、二氧化碳和湿度也是影响药品质量的限制性因素。需“密闭、密封、熔封、严封”的药物贮藏时若密封不严,会与空气中的氧气、二氧化碳发生化学反应;另外,空气湿度大会使药品潮解、霉变,湿度小则易使含结晶水的药品风化。《中国药典》凡例在贮藏项下规定:密闭系指将容器密闭,以防止尘土及异物进入;密封系指将容器密封以防止风化、吸潮、挥发或异物进入;熔封或严封系指将容器熔封或用适宜的材料严封,以防止空气与水分的侵入并防止污染。调查发现,西药、中成药和生物制品均有密封表述缺失情况出现,其中生物制品未标注率最高,达86.27%,应规范其贮藏密封表述,以保障患者安全使用。而一些含酚类、芳胺类、烯醇类结构的药品若贮藏不当,易氧化变质,甚至产生毒性,因此应密封贮藏,尽量不与空气接触。此外,空气中的微生物也会通过污染药品的外包装,导致临床用药质量事件发生。如2008年由于刺五加注射液在流通环节被雨水浸泡、贮藏不当,导致药品受到细菌污染而发生的致死事件。建议医药人员应严格按照药品贮藏条件养护药品,以防出现用药风险隐患,危及患者生命安全。
3 结语
药品的贮藏条件是保障临床用药安全的重要指标之一。在保证药品内在质量的基础上,只有切实做到科学、合理地贮藏药品,才能最大限度地确保用药质量[5]。通过对1029种药品说明书贮藏项内容的调查分析,发现其药品贮藏表述有待完善,主要表现为贮藏项表述不规范、不严谨,随意用词、模糊用词等。这既不符合规定,又给医疗单位增加了贮藏操作难度和贮藏成本,同时还会误导患者对药品的保管和使用,影响患者用药安全。希望国家相关部门对药品说明书贮藏项表述进行有效的监管和规范指导,同时,医疗机构也应加大药品贮藏条件的基础设施建设力度,以及加强药品贮藏工作的管理力度,以保障临床安全、有效用药。
参考文献:
[1]Jassim AM.In-home Drug Storage and Self-medication with Antimicrobial Drugs in Basrah,Iraq[J].Oman Med J,2010,25(2):79-87.
[2]李惠新.浅谈药品贮藏温度标示的规范化管理[J].中国现代药物应用,2008,2(24):193.
[3]侯晓宁.对规范药品贮藏温度标示的若干思考[J].中国药房,2008,19(10):788-789.
[4]Abushanab AS,Sweileh WM,Wazaify M.Storage and wastage of drug products in Jordanian households:a cross-sectional survey[J].Int J Pharm Pract,2013,21(3):185-191.
[5]Sharif SI,Abduelkarem AR,Bustami HA,et al.Trends of home drug storage and use in different regions across the northern United Arab Emirates[J].Med Princ Pract,2010,19(5):355-358.

