蛭弧菌对污水生物净化效果的实验观察
汪 红,徐 政,于正洋,李 浩,夏 凡,陈铎元,徐 恒
(四川大学 生命科学学院,四川 成都 610064)
1 创新性实验思路
教学实践是培养学生动手能力和创新能力的重要途径,而教学内容的更新是培养创新型人才的关键。微生物基础实验课的内容大多属于陈旧性实验,实验技术方法庞杂,细节众多,学生容易感到枯燥而厌学。为了改变现状,增加创新性实验内容,提高学生对微生物实验的兴趣,我们开设“蛭弧菌对污水生物净化效果的实验观察”实验。该实验内容新颖,并与生产实际相结合,特别是低年级学生对贴近生活的实验非常感兴趣,调动了学生的主观能动性,有利于培养学生在微生物实验中的动手能力和创新能力,也能让大学生理解微生物与环境工程的交叉,提高学习微生物知识的积极性。
噬菌蛭弧菌比细菌小,能通过细菌滤器,有类似噬菌体的作用,但它不是病毒,确确实实是一类能“吃掉”细菌的细菌,是一类寄生于其他细菌并能导致其裂解的革兰氏阴性细菌[1-2]。该菌能够在较短时间内清除水中的沙门氏菌属、志贺氏菌属、变形杆菌属、假单胞菌属、埃希氏菌属、欧文氏菌属、弧菌属等菌属,可消除致病菌,控制或减少致病菌对环境水源的污染[3]。由于蛭弧菌能裂解多种细菌,并且生活方式特殊,具有生态优势,因此被认为是自然净化的生物因子之一,在微生态研究领域已被作为一种新型微生态制剂的菌种得到开发和应用[4-7]。生活污水中常含有大肠杆菌,其含量常作为水质污染度的鉴定标准之一。蛭弧菌是能快速清除水体中有害菌,改善和稳定养殖环境,维护水产动物健康生长的无污染、无残留的“绿色”制剂[8-13]。因此,利用其这一特性对水产养殖中水体的生物净化和水产品污染病原菌的防控具有广泛的发展前景。
开设“蛭弧菌对污水生物净化效果的实验观察”实验,学生对微生物中的小细菌(蛭弧菌)有了感性认识,并通过平板菌落计数法和双层平板法的实验内容,提升学生的实验技能。由于实验内容新颖、贴近生活和生产实际相结合,很能激发学生的实验兴趣和创新热情。因此,该实验可作为微生物基础实验开设创新性实验内容,为创新人才提供良好的发展平台。
2 材料与方法
2.1 仪器及器材
(1)仪器:显微镜BA210型,生化培养箱LRH-250A型,电子天平BS224S型,高压灭菌锅LDZX-30KBS型,电热干燥箱DHG-9240型,超净工作台SW-CJ-1F型,冰箱BCD-301型,高速离心机LR56495型,普通离心机LD4-2型。
(2)器材:玻璃试管;培养皿;移液枪(5mL,1 000 μL,50μL,10μL);酒精灯;三角瓶;细菌过滤器。
(3)菌种:大肠杆菌(Escherichia coli);蛭弧菌(Bdellovibrio bacteriovoru)(蛭弧菌由徐恒教授课题组提供)。
(4)牛肉膏蛋白胨培养基:牛肉粉5g(质量分数为0.5%);蛋白胨10g(质量分数为1%);琼脂20g(质量分数为2%);蒸馏水1 000mL;pH 7.0~7.2。
(5)双层平板培养基:下层琼脂培养基:琼脂17.5g(质量分数为1.75%);蒸馏水1 000mL。
上层LB培养基:蛋白胨5g(质量分数为0.5%);酵母提取物1.5g(质量分数为0.15%);NaCl 2.5g(质量分数为0.25%);琼脂4g(质量分数为0.4%);蒸馏水1 000mL。
(6)平板技术培养基:胰蛋白胨5g(2.3.0.5%);葡萄糖1g(2.3.0.1%);酵母提取物5g(2.3.0.5%);琼脂15g(2.3.1.5%);蒸馏水1 000mL;pH6.8~7.0。
(7)无菌生理盐水NaCl(质量分数为0.85%)。
2.2 大肠杆菌悬液的制备
将大肠杆菌接种牛肉膏蛋白胨培养基斜面上,在37℃培养24h后,吸取1.0mL无菌水在大肠杆菌的斜面上,用接种环钩分散乳化菌苔,制备菌悬液备用。
2.3 蛭弧菌纯液的制备
挑取蛭弧菌单斑浸泡于1.5mL无菌水中,捣碎混匀,10 000 g离心10min,得到蛭弧菌悬液;在3.5 mL上层LB培养基(50℃)中加入0.3mL蛭弧菌液和0.2mL大肠杆菌菌悬液,混匀后立即倾注于预制底层培养基上,待凝固后置于32℃培养箱内培养24~120h,观察噬菌斑出现及大小;待透明噬菌斑产生后,挑取单斑浸泡于无菌水中,高速旋涡,将浸泡液进行梯度稀释,取合适梯度再做双层平板培养,连续传代3~5次,直到有明显的圆形噬菌斑出现;从平板上挑取单斑浸泡于5mL无菌水中,捣碎混匀,10 000 g离心10min,取含有蛭弧菌和大肠杆菌的上清液,利用细菌过滤器除去大肠杆菌,获得纯的蛭弧菌液。
2.4 灭活蛭弧菌纯液的制备
取1mL纯的蛭弧菌于无菌试管中,用木架子夹住试管,在酒精灯上加热沸腾5min,让蛭弧菌失去活性。
2.5 污水采集
用无菌瓶采集鱼塘污水250mL,常温保存运输至实验室。
2.6 实验方法
2.6.1 污水净化培养与指标检测
将实验污水摇匀,按2.6.2节中的方法进行细菌总数计数;取2个50mL无菌锥形瓶,分别加入30 mL污水,其中一个锥形瓶中加0.5mL蛭弧菌纯液,编号为1号;另一个锥形瓶中加0.5mL被灭活蛭弧菌纯液,编号为0号;将2个三角瓶放在35℃培养箱,1、3、5、7d分别取样检测污水培养液中的细菌总数和蛭弧菌生长菌斑。
2.6.2 平板计数法测定细菌总数
分别从培养的0号、1号水样中取出1mL培养液于无菌试管中,用生理盐水将培养液浓度稀释成10-1,同样的方法稀释水样为10-2、10-3,根据情况确定是否稀释至10-4;将稀释后的水样混合均匀,从中取出1mL,加入培养皿中;将溶解并冷却至50℃左右的平板计数培养基加入到培养皿中,每皿约20mL;左右交换摇匀,待凝固后置于37℃恒温培养箱中倒置培养2d,观察并计数每皿菌落数,再根据稀释倍数计算样液中细菌总数。
2.6.3 双层平板法检测蛭弧菌
将融化的下层琼脂培养基倒入20mL于无菌培养皿中,冷却凝固,在3.5mL上层LB培养基(50℃)中加入0.3mL污水样1号和0.2mL大肠杆菌菌悬液,混匀后立即倾注于预制底层培养基上,待凝固后置于32℃培养箱内,培养24~120h,观察噬菌斑。
3 结果与分析
3.1 污水中细菌的生长观察
在相同培养条件下,于1、3、5、7d分别取0号和1号培养液,稀释至10-2进行平板计数观察。结果表明,加蛭弧菌的污水培养物,随着培养时间的延长,计数平板上菌落数持续减少,而加灭活蛭弧菌的污水培养物,则菌落数变化不大(详见图1和图2)。

图1 1号样中细菌的生长情况
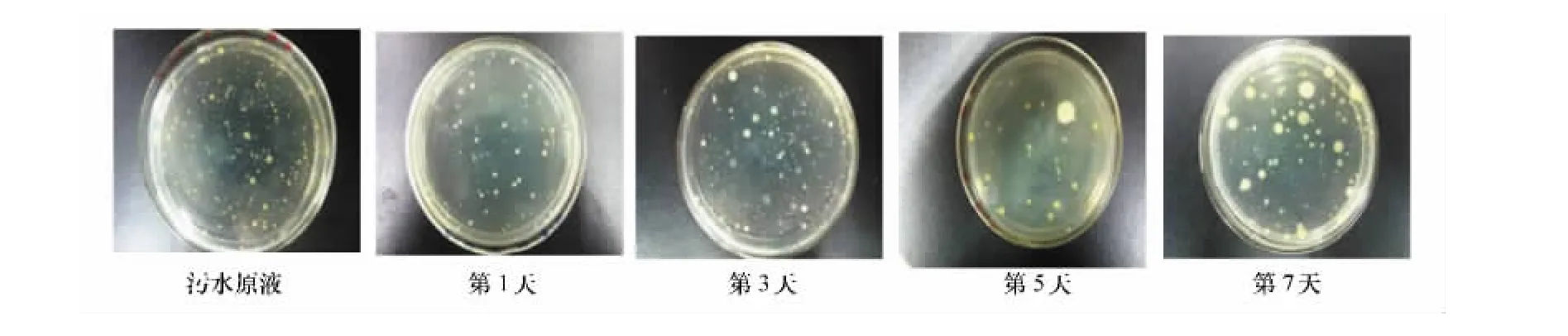
图2 0号样中细菌的生长情况
3.2 污水中细菌总数结果分析
通过对实验污水原液和加蛭弧菌(1号)与灭活蛭弧菌对照污水(0号)连续培养,并于1、3、5、7d取样进行细菌总数测定。结果表明,有蛭弧菌作用的污水中的细菌数3d后比灭活蛭弧菌的污水低,说明蛭弧菌对污水中特定细菌群具有侵染与裂解作用,详见图3。
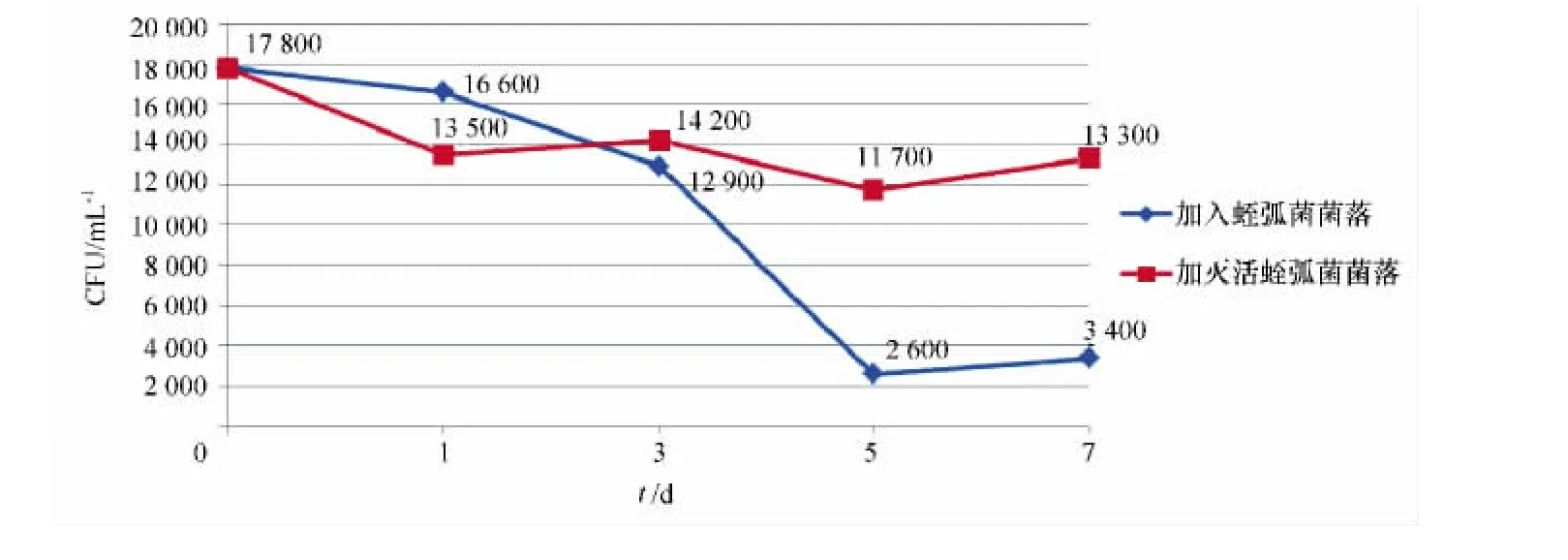
图3 污水培养液中细菌数的变化
3.3 双层平板实验结果分析
将蛭弧菌与污水混合培养后,分别于1、3、5d取样进行双层平板实验,检测蛭弧菌生长情况。结果表明,随着培养时间的延长,蛭弧菌菌斑数量逐渐增加,详见图4。

图4 1号样中蛭弧菌斑的生长情况
4 讨论
本实验成功建立了蛭弧菌对污水净化实验及其细菌和蛭弧菌指标检测,利用蛭弧菌对特定细菌的浸染与裂解作用,并通过平板计数法和双层平板法观察到蛭弧菌对污水中细菌的裂解现象,说明蛭弧菌对革兰氏阴性细菌有裂解作用,而不是对所有细菌均有作用。加有蛭弧菌的污水,其细菌数低于对照很多,同时噬菌斑随时间延长逐渐增多。
通过开设“蛭弧菌对污水生物净化效果的实验观察”实验,学生对微生物中的小细菌(蛭弧菌)有了更深的认识,并对蛭弧菌能显著改善鱼塘中的微生物环境,减少养殖水产生物的致病率,提高养殖经济效益,产生浓厚的兴趣,这样有助于学生动手能力和科学素质的培养。由于实验内容新颖,贴近生活,具有创新性,为开设创新性教学实验奠定了基础。
(
)
[1]邢华,何义进,黄钰,等,噬菌蛭弧菌的生物学特性研究[J].淡水渔业,1997,27(1):17-19.
[2]黄亮,宋虹霖,王莉,等.天津主要河流中耐高温蛭弧菌的分离及生物学特性[J].食品与生物技术学报,2011,30(2):311-315.
[3]司穉东,秦生巨,晏质.噬菌蛭弧菌在自然水体(或泥)中的分布数量调查[J].中国公共卫生,1987,6(3):139-140.
[4]张梁.蛭弧菌在水产养殖中的应用[J].江苏预防医学,2000,11(4):75-76.
[5]秦生巨.噬菌蛭弧菌微生物生态制剂的作用机制及生态效应[J].水产科技情报,2007,34(3):124-127.
[6]吕茉,韩剑众.蛭弧菌类生物噬菌特性及在畜禽养殖中的应用研究[J].饲料研究,2010(9):8-11.
[7]张小能,杨先乐,曹海鹏,等.噬菌蛭弧菌颗粒剂制备条件的优化[J].上海海洋大学学报,2010,19(6):778-786.
[8]张梁.蛭弧菌在水产养殖中的应用[J].江苏预防医学,2000,11(4):75-76.
[9]吕茉,韩剑众.蛭弧菌类生物噬菌特性及在畜禽养殖中的应用研究[J].饲料研究,2010(9):8-11.
[10]马志宏,丁文,杨莉,等.蛭弧菌对鱼类常见致病菌裂解作用的研究[J].水产科技情报,1996,23(5):220-224.
[11]孙志明,栾会妮,姚维志.微生态制剂在水产养殖中的作用[J].水利渔业,2004,24(1):1-3.
[12]朱文漓,徐恒.蛭弧菌研究进展[J].微生物学通报,2007,34(4):808-811.
[13]李永文,徐恒.大口鲶病原菌蛭弧菌的分离及生物学特性研究[J].淡水渔业,2006,36(2):9-12.

