达比加群酯中空微球的制备及溶剂选择
刘元芬,丁亚飞,郑春丽
(1.江苏建康职业学院,江苏 南京 210029; 2.中国药科大学药物制剂研究所,江苏 南京 210009)
达比加群酯为新合成的直接凝血酶抑制剂,为dabigatran的前体药物,属非肽类的凝血酶抑制剂[1]。本研究中采用乳化蒸发法制备达比加群酯中空微球,以期使制剂在胃液中长时间漂浮,延长释药时间,使药物缓慢到达肠道,促进药物在胃肠道的吸收。同时,主要对达比加群酯中空微球的制剂学基本性质进行了研究,现报道如下。
1 仪器与试药
RW 20型电动搅拌器(德国IKA公司);Agilent1100型HPLC(美国Agilent公司);ZRS-8G型智能溶出试验仪(天津大学无线电厂);电子天平(北京赛多利斯仪器系统有限公司);S-3400N型扫描电镜(日本Hitachi公司)。达比加群酯(上海灏云化工科技有限公司,纯度大于99.0%,批号为13041527);乙基纤维素(上海卡乐康包衣技术有限公司,10CP);聚乙烯醇(PVA124,国药集团化学试剂有限公司,进口分装);司盘80、二氯甲烷、无水乙醇均为分析纯。
2 方法与结果
2.1 中空微球形成机理
在1991年Kawashima等[2]首次报道了中空微球给药系统的制备,并步构思了中空微球的形成机理。中空微球的形成主要依靠有机溶剂二氯甲烷和乙醇。当骨架材料溶解在二氯甲烷和乙醇组成的混合溶剂中,加入到水溶液后则形成O/W的乳滴。由于乙醇为亲水性有机溶剂,会快速扩散到水溶液中,同时使骨架材料析出、表面固化;而二氯甲烷为疏水性有机溶剂,则停留在微球的中心,随着搅拌时间的延长,二氯甲烷则缓慢挥发而形成空腔[3]。
2.2 混合溶剂比例筛选
根据中空微球形成的机理设计验证试验。选择乙醇与二氯甲烷之比为 10∶0,9∶1,5∶5,1∶9,0∶10 共 5 个比例来制备空白中空微球。将乙基纤维素0.6 g加入到无水乙醇与二氯甲烷的混合溶剂中,搅拌混匀后,缓慢滴加至含有吐温80的聚乙烯醇溶液中,至有机溶剂挥发完全,物质形态见图1。

图1 乙醇与二氯甲烷不同比例制备的物质形态
可见,当主要用乙醇溶剂来制备中空微球时,由于乙醇为亲水性溶剂,扩散到水溶液中,乙基纤维素会在水溶液中析出而变成絮状沉淀。当主要用二氯甲烷来制备中空微球时,由于二氯甲烷为疏水性溶剂,扩散性差,可导致微球最后变成实心颗粒状;当混合有机溶剂乙醇与二氯甲烷之比为5∶5时,亲水溶剂乙醇先扩散至水溶液中,使表面骨架材料成圆形析出,然后疏水性溶剂二氯甲烷缓慢析出而形成空腔,所制备的中空微球具有非常明显的空腔,球形较好。因此,亲水溶剂和疏水溶剂的混合加入对于中空微球的形成至关重要。
2.3 达比加群酯中空微球制备
采用乳化蒸发法制备[3-4]。将乙基纤维素0.6 g与达比加群酯0.12 g(5∶1)加入到无水乙醇与二氯甲烷的混合溶剂(3mL∶3mL)中,搅拌混匀,然后缓慢滴加至含有 0.45%(g/mL)吐温 80的30mL(1.5%)聚乙烯醇溶液中,以 210 r/min 转速搅拌 2 h,至有机溶剂完全挥发,过80目筛收集,蒸馏水迅速荡洗,真空干燥器中干燥24 h,干燥后筛选16~40 目(500~1000μm)粒径的微球,备用[5]。
2.4 药物含量测定建立
2.4.1 色谱条件[6]
色谱柱:Agilent C18柱(250 mm ×4.6 mm,5 μm);流动相:0.2%的醋酸铵溶液(用冰醋酸调节 PH 至 4.4)-乙腈(50∶50);检测器:紫外检测器;检测波长:226 nm;柱温:室温;进样量:20μL。
2.4.2 方法学考察
标准曲线绘制:精密吸取质量浓度分别为 10,20,40,60,80,100μg/mL的达比加群酯溶液 20μL,依法进样。200~800 nm 紫外全波长扫描见图2,可见,达比加群酯在乙腈溶剂中的最大吸收波长为226 nm,且空白微球在此波长处不干扰测定。在检测波长226 nm下所得色谱图见图3。按拟订的色谱条件测定峰面积,以对照品进样量为横坐标、峰面积为纵坐标绘制标准曲线,得回归方程 A=38.58C +4.123,r2=0.9999(n=6)。
精密度试验:精密吸取对照品溶液和供试品溶液各20μL,重复进样5次,按拟订的色谱条件进样测定。结果对照品溶液和供试品溶液平均峰面积积分值的 RSD分别为1.52%和1.69%(n=5)。
回收率试验:称取空白微球10 mg,乙腈溶解,流动相定容于10 mL容量瓶中,精密吸取对照品溶液1mL置10mL容量瓶中,加空白微球溶液定容至刻度,摇匀,用0.45μm的微孔滤膜滤过,取20μL依法进样测定。结果平均回收率为98.70%,RSD=1.83%。
2.4.3 含量测定
精密称取制备的中空微球10 mg,置10 mL容量瓶中,甲醇溶解,摇匀,甲醇定容至刻度;移取 0.5 mL溶液,置10 mL容量瓶中,甲醇稀释,摇匀,定容至刻度。采用高效液相色谱法测定并计算中空微球中达比加群酯的百分含量(mg/mg)。结果的药物的百分含量为(11.18±0.05)% (n=3)。
2.5 主要制剂学性质考察
微球外观形态观察:取制得的粒径为500~1000μm的空白中空微球、含药中空微球,排列好后置铜片上喷金(15~20 nm),置S-3400N型扫描电子显微镜以相同放大倍数观察2种微球粒子的微观形态,加速电压设定为20 kV,结果见图4。可见,空白中空微球表面较光滑,球形度较好,具有明显的空腔,局部放大可见微小细孔;达比加群酯中空微球的表面附有较多颗粒状物质,与空白中空微球(不含药)对照,可以确定表面附着的物质为药物;在中空微球球壁能看到许多细小空隙,应为气体逃逸时所产生。中空结构的存在可使微球的密度低于胃液的密度,从而产生胃漂浮性能。
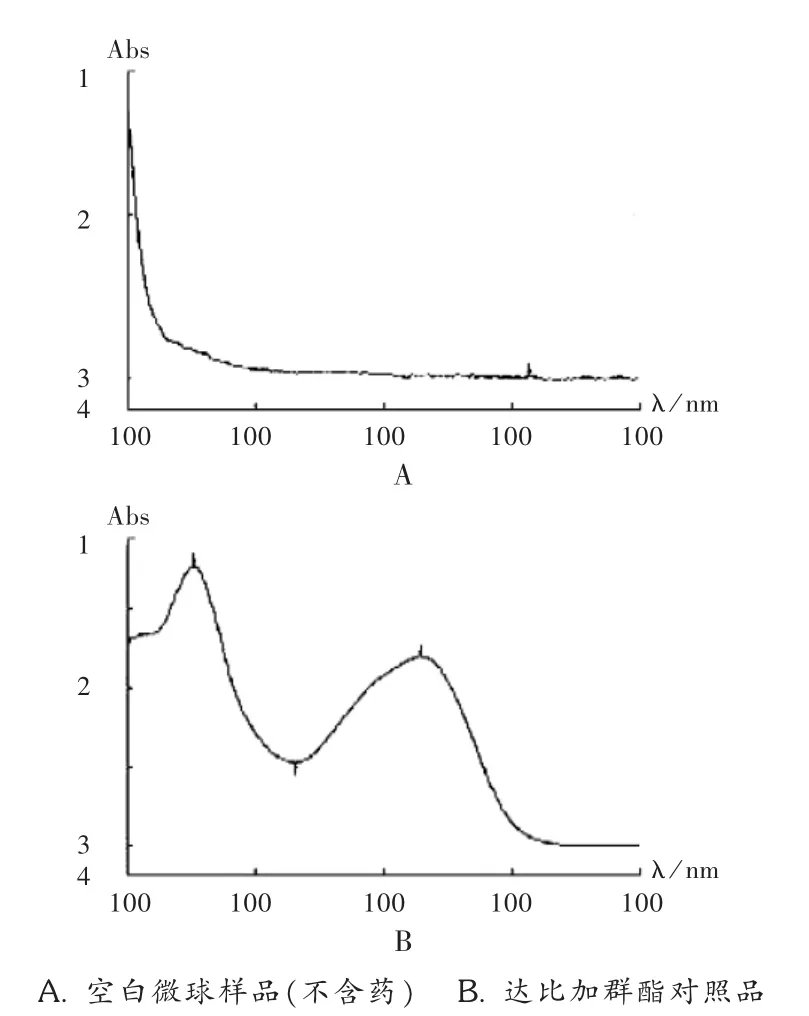
图2 紫外全波长扫描图
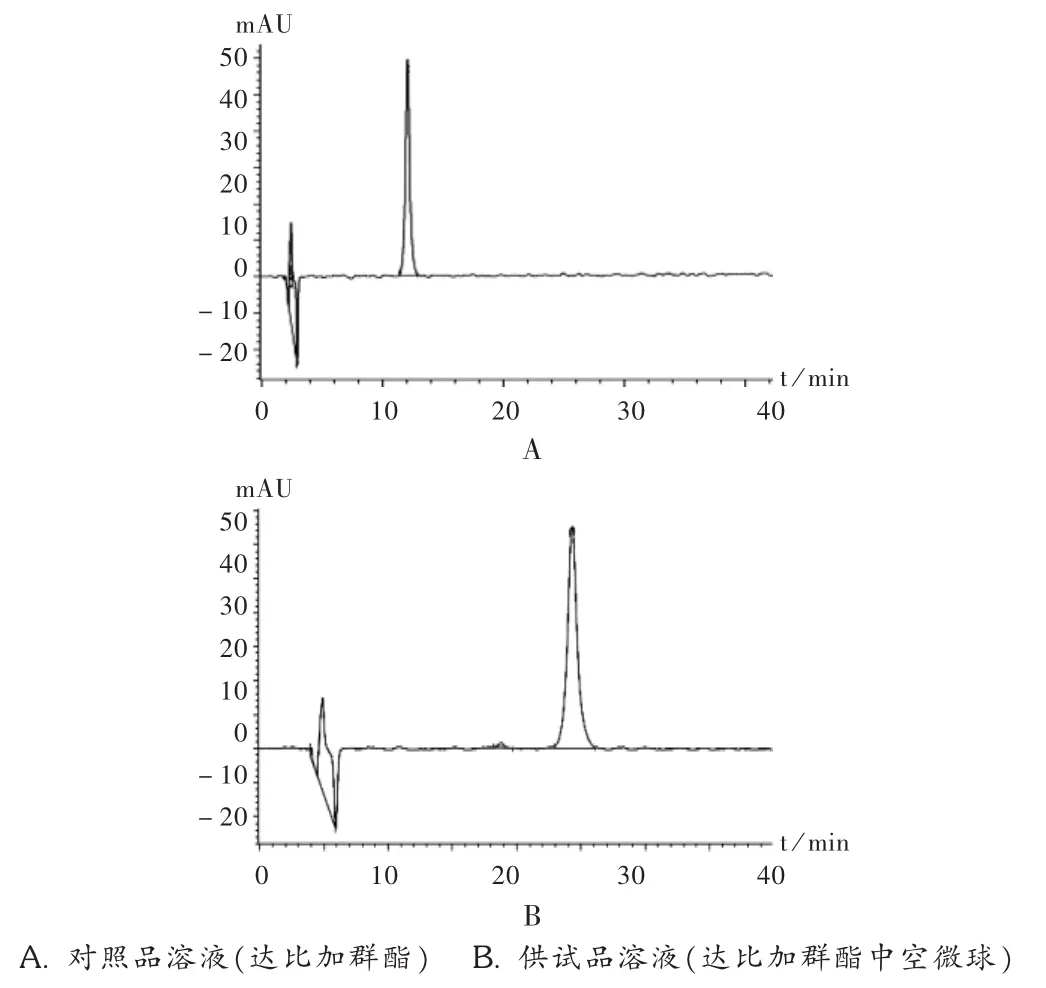
图3 高效液相色谱图
体外漂浮性能测定:取制得的微球100粒,置溶出度测定仪中进行漂浮性能测试,介质为人工胃液(pH=1.2)水溶液150mL。在温度37℃、转速50 r/min下搅拌,10 h后收集微球的漂浮部分和非漂浮部分。漂浮微球的漂浮力可通过公式计算[7]。P(%)=Sf÷100×100%。式中 F为漂浮百分率,Sf为10 h后漂浮微球的个数。经计算,10 h 后中空微球的漂浮百分率为(86.33 ±0.03)%(n=3),表明在较长时间里达比加群酯中空微球的体外漂浮性能良好。
体外释放度测定:按照2010年版《中国药典(二部)》测定法中转篮法测定。取粒径为500~1000μm的中空微球适量(约含达比加群酯 22 mg),置溶出度测定仪中,转速为 100 r/min,以pH =1.2的人工胃液 900 mL 为释放介质,温度为(37±0.5)℃,于 0.5,1.0,1.5,2.0,3.0,4.0,6.0,8.0,12.0,24.0 h 时取样5 mL,同时添加补液[8]。样品溶液经 0.8μm微孔滤膜滤过,人工胃液稀释后,于325 nm波长处测定吸光度(避免紫外测定中末端吸收),紫外分光光度法计算(标准曲线为 A=0.043+0.0201C,r2=0.998,线性范围为 4~16 μg/mL),以释药时间为横坐标、累积释药百分率为纵坐标绘制体外释药曲线,结果见图5。
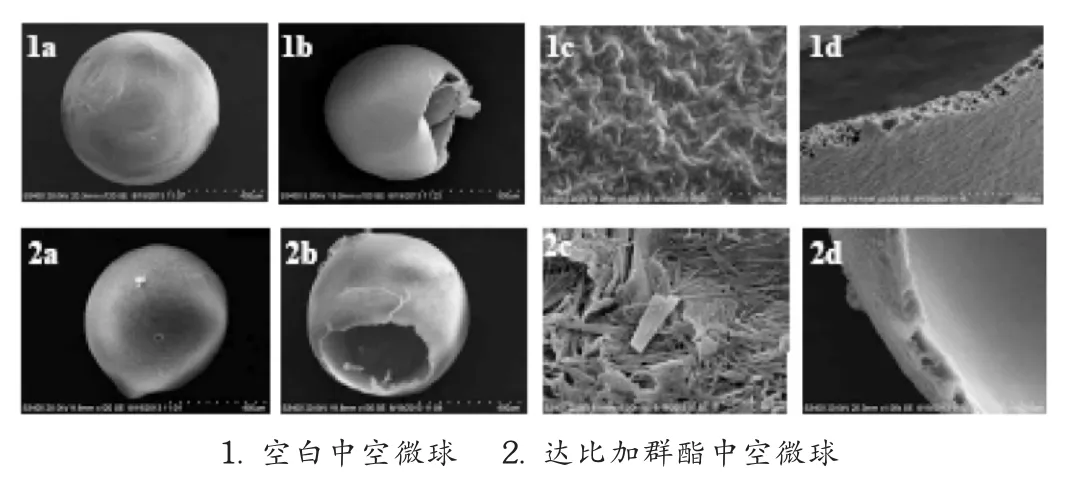
图4 中空微球的扫描电镜图
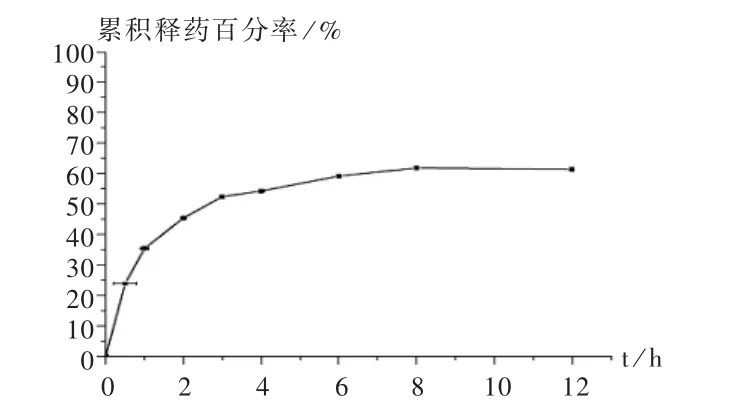
图5 载药微球累积释药曲线(n=3)
3 讨论
达比加群酯口服经胃肠吸收后,在体内转化为具有直接抗凝血活性的dabigatran。dabigatran结合于凝血酶的纤维蛋白特异结合位点,阻止纤维蛋白原裂解为纤维蛋白,从而阻断了凝血瀑布网络的最后步骤及血栓形成;还可从纤维蛋白-凝血酶结合体上解离,发挥可逆的抗凝作用。达比加群酯于2008年4月首次在德国和英国上市,2010年10月20日美国食品药物管理局(FDA)批准其应用于非瓣膜性心房颤动患者脑卒中及全身血栓栓塞的预防,是继华法林之后50年来上市的首个新类别口服抗凝血药物[9]。与华法林相比,达比加群酯具有可口服、强效、无需特殊用药监测、药物相互作用少等优点[10]。针对深静脉血栓的治疗及一级预防,达比加群酯只需每日1次,大大增加了患者的依从性;但针对非瓣膜性心房颤动患者脑卒中及全身血栓栓塞的预防,则需2次/d[11],给药至少3个月、6个月或12个月[12],降低了患者的顺应性。因此,根据达比加群酯的性质,有必要研究开发适合其每日一次、可长期给药的剂型,用以预防全身性血栓性疾病。
中空微球是一种带有较大空腔的固体微球制剂,中空微球给药系统被认为是胃漂浮给药系统中最有前景的形式。由于中空微球可长时间漂浮在胃内,能够用于治疗局部胃部疾病或者延长药物作用时间[13]。近年来,许多研究者对这种新制剂形式进行了研究和报道。Kawashima等[2]1991年首先报道了胃漂浮载药中空微球的制备,主要制备方法为,首先采用乳化蒸发方法制备含有有机溶剂(乙醇、二氯甲烷、正己烷、乙醚)的乳剂,然后蒸发有机溶剂,形成中空的微球。
达比加群酯为脂溶性药物,在 PH =1.2的酸性环境溶解度最大,因此本试验中制备的中空微球是可行的。利用中空微球可长时间漂浮在酸性胃液中的性质,可增加达比加群酯在胃中的溶解度,使药物缓慢到达肠道而被吸收,从而提高药物的生物利用度。在制备中空微球的过程中,将乙醇和二氯甲烷组成的混合溶剂加入到含吐温80的聚乙烯醇溶液中,混合溶剂相当于油相,在聚乙烯醇溶液中乳化形成乳滴;后来由于溶剂的挥发,乙基纤维素和药物析出,形成中空微球。该法制备的中空微球性质较稳定,方法简单易行;中空微球在体外能长时间漂浮在液面,漂浮性能良好。但处方中应用了毒性较大的有机溶剂二氯甲烷,如何筛选更加安全的有机溶剂需要进一步研究。体外释放行为考察结果表明,达比加群酯中空微球在pH=1.2的盐酸溶液(释放介质)中的释放行为符合缓释制剂的要求。
参考文献:
[1]Bishoy F.A new anticoagulant for anew era:review of recentdata on dabigatran etexilate[J].Clin Adv HematolOncol,2010,8(10):679-702.
[2]Kawashima Y,Niwa T,Takeuchi H,et al.Preparation ofmultiple unit hollow microspheres (microballoons) with acrylic resin containing tranilast and their druGrelease characteristics (in vitro) and floating behavior (in vivo) [J].JControl Release,1991,16:279-289.
[3]张向荣,朱悦铭,王 晶,等.乳化-溶剂扩散法制备克拉霉素缓释微球[J].中国药业,2009,18(2):39-40.
[4]Kumaresh S.Soppimath,Anandrao RK,et al.Development of Hollow Microspheres as Floating Controlled-Release Systems for Cardiovascular Drugs:Preparation and Release Characteristics[J].Drug Dev Ind Pharm,2001,27(6):507-515.
[5]Ramachandran S,Shaheedha SM,Thirumurugan G,et al.Floating controlled drug delivery systemof famotidine loaded hollow microspheres(microballoons) in the stomach[J].Current Drug Delivery,2010,7 (1):93-97.
[6]Stangier J,Rathgen K,Stahleh,et al.The pharmacokinetics,pharmacodynamics and tolerability of dabigatran etexilate,a new oral direct thrombin inhibitor,in healthymale subjects[J].Br JClin Pharmacol,2007,64(3):292-303.
[7]Yasunori S,Yoshiaki K,Hirofumi T,et al.Physicochemical properties to determine the buoyancy of hollow microspheres (microballoons) Prepared by the emulsion solvent diffusion method[J].Eur JPharm and Biopharm,2003,55 (2):297-304.
[8]蒋红艳,杨元娟,杨宗发,等.微球给药系统及其质量评价[J].中国药业,2012,21(13):1-2.
[9]Schulman S,Kearon C,Kakkar AK,et al.Dabigatran versuswarfarin in the treatmentofacutevenous thromboembolism[J].NEngl JMed,2009,361(5):2342-2352.
[10]肖宜超,刘启明.新型口服抗凝药达比加群酯研究进展[J].心血管病学进展,2011,32 (4):575-578.
[11]邢松松,王晓蕾,周付刚,等.达比加群酯的合成[J].中国医药工业杂志,2010,41(5):321-325.
[12]保罗·A·赖利.使用达比加群酯或其盐治疗或预防血栓形成且与常规的华法林疗法相比具有改良安全性的方法[P].中国:200980144212.4.2011-10-05.
[13]晋运环,曹德英.胃内漂浮给药系统的研究进展[J].中国新药杂志,2005,14(7):835-838.

