HPLC法测定右旋兰索拉唑控释胶囊中左旋异构体含量
郭俊平
宜兴市人民医院,宜兴 214200
HPLC法测定右旋兰索拉唑控释胶囊中左旋异构体含量
郭俊平
宜兴市人民医院,宜兴 214200
目的:建立HPLC法对右旋兰索拉唑控释胶囊中左旋和右旋异构体进行拆分并测定其中左旋异构体含量。方法:采用Chiral-AGP手性柱(4.6 mm×150 mm,5 μm);流动相为乙腈-pH 6.0磷酸盐缓冲液(10∶90);流速0.5 mL·min-1;柱温30℃;检测波长285 nm;进样量20 μL。结果:兰索拉唑左旋和右旋异构体之间的分离度为3.0,左旋异构体的线性范围为0.51~5.10 μg·mL-1(r=0.9996),检测限为2.52 ng,平均回收率(n=9)为98.4%。结论:该方法操作简便,结果准确,可用于右旋兰索拉唑控释胶囊中左旋异构体的含量测定。
高效液相色谱;手性柱;右旋兰索拉唑控释胶囊;左旋异构体
右旋兰索拉唑(dexlansoprazole)是日本武田公司开发的新一代质子泵抑制剂,是该公司曾经开发的兰索拉唑(lansoprazole)的右旋光学异构体,该制剂采用新型的双相控释剂型,可持续抑制胃酸分泌,效果显著,耐受性良好[1]。右旋兰索拉唑控释胶囊(dexlansoprazole delayed release capsules)已于2009年经美国FDA批准上市,商品名:DexliantTM。本品分子结构中含有一个手性中心,可能在生产过程中引入少量的左旋异构体,因此建立一个良好的异构体检查方法对本品的质量控制尤为重要。本文采用手性固定相的HPLC法对兰索拉唑异构体进行拆分并检测左旋异构体含量,可有效地控制本品的质量。
1 材料
1.1 仪器
岛津20A高效液相色谱仪,SPD-M20A二极管阵列检测器,Labsultion色谱工作站;赛多利斯BT125D电子分析天平;梅特勒FE20 pH计。
1.2 试药
右旋兰索拉唑控释胶囊(南京源健医药技术有限公司,批号:20131201、20131202、20131203;日本武田制药,批号:C19323,4批规格均为60 mg/粒);兰索拉唑对照品(中国药品生物制品检定所,批号:100709-200902,纯度为99.8%);左旋兰索拉唑对照品(南京源健医药技术有限公司,批号:20131101,标定含量为99.5%);乙腈(色谱纯,美国TEDIA公司);磷酸二氢钠、磷酸氢二钠和磷酸钠均为分析纯。
2 方法和结果
2.1 色谱条件
色谱柱为大赛璐公司Chiral-AGP手性柱(4.6 mm×15 cm,5 μm);流动相:乙腈-磷酸盐缓冲液(pH 6.0)(10∶90);流速:0.5 mL·min-1;柱温:30℃;检测波长:285 nm;进样量:20 μL。
2.2 溶液配制
2.2.1 磷酸盐缓冲液(pH 6.0)取156.0 g·L-1磷酸二氢钠溶液70 mL与179.1 g·L-1磷酸氢二钠溶液20 mL,用水稀释至1000 mL,取250 mL加水稀释至1000 mL。
2.2.2 稀释液取磷酸钠(Na3PO4·12H2O)0.68 g与磷酸氢二钠(Na2HPO4·2H2O)0.62 g,加水适量使溶解并稀释至100 mL,摇匀。
2.2.3 兰索拉唑对照品溶液取兰索拉唑对照品10 mg,精密称定,置于100 mL量瓶中,加稀释液溶解并定容至刻度,摇匀,即得。
2.2.4 左旋对照品溶液取左旋兰索拉唑对照品12.5 mg,精密称定,置于100 mL量瓶中,加稀释液溶解并定容至刻度,摇匀,作为左旋兰索拉唑对照品储备液;精密量取对照品储备液2 mL,置100 mL量瓶中,用稀释液溶解定容至刻度,即得。
2.2.5 样品溶液取右旋兰索拉唑约25 mg的胶囊内容物,精密称定,置于50 mL量瓶中,加稀释液溶解并定容至刻度,摇匀,即得。
2.3 系统适用性试验
精密量取兰索拉唑对照品溶液、左旋兰索拉唑对照品溶液和样品溶液各20 μL,注入液相色谱仪中,左旋兰索拉唑保留时间为20.5 min,右旋兰索拉唑保留时间13.6 min,两者分离度达3.0,理论板数按左旋兰索拉唑计达3567。色谱图见图1。
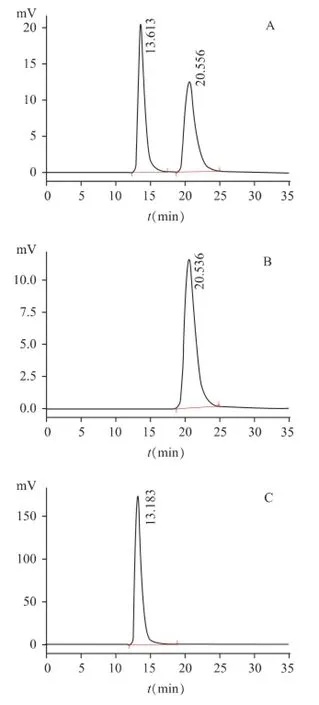
图1 右旋兰索拉唑HPLC色谱图
2.4 线性关系考察
取左旋兰索拉唑对照品适量,精密称定,用稀释液溶解稀释成0.51、1.02、2.04、3.06、4.08、5.1 μg· mL-1浓度的系列溶液。精密量取各20 μL,分别注入液相色谱仪中,记录色谱图。以峰面积(A)为纵坐标,浓度(C)为横坐标,进行线性回归,得方程:A= 4.56×105C-2.14×104(r=0.9996)。左旋兰索拉唑浓度在0.51~5.10 μg·mL-1范围内线性关系良好。
2.5 检测限和定量限
取“2.4”项下左旋兰索拉唑对照品溶液逐级稀释,分别进样,按信噪比(S/N)为3,确定本品检测限为2.52 ng,按信噪比(S/N)为10,确定本品定量限为7.56 ng。
2.6 进样精密度
取左旋兰索拉唑对照品溶液连续进样6次,记录左旋兰索拉唑峰面积,RSD为0.36%(n=6)。
2.7 重复性试验
取右旋兰索拉唑控释胶囊20粒(批号:20131201),倒出内容物,混匀,取混匀后的内容物6份,精密称定,分别加稀释液溶解并稀释成浓度为0.5 mg·mL-1的样品溶液。分别进样,测定左旋异构体的含量。结果左旋兰索拉唑含量平均值为0.12%(n=6),RSD为2.5%。表明该方法重复性良好。
2.8 中间精密度
由不同试验人员在不同的液相色谱仪上测定同一批右旋兰索拉唑控释胶囊(批号:20131201)中左旋异构体含量。结果左旋兰索拉唑含量平均值为0.12%(n=12),RSD为2.8%。表明该方法精密度良好。
2.9 回收率试验
取右旋兰索拉唑约25 mg的胶囊内容物(批号:20131201,左旋异构体含量为0.12%),共9份,精密称定,分别置于50 mL量瓶中,精密加入左旋兰索拉唑对照品储备液1.0、2.0、3.0 mL各3份,加稀释液溶解并定容至刻度,摇匀,作为回收率供试品溶液。取回收率供试品溶液分别注入液相色谱仪,按外标法计算回收率。结果平均回收率为98.4%,RSD为3.5%(n=9)。
2.10 溶液稳定性
取右旋兰索拉唑约50 mg的胶囊内容物(批号:20131201),精密称定,分别置于100 mL量瓶中,加稀释液溶解并定容至刻度,摇匀,室温放置。分别于配制后0、2、4、6、8、10 h进样,记录色谱图。其中左旋异构体峰面积RSD为1.1%(n=6),表明样品溶液在室温条件下放置10 h稳定。
2.11 样品测定
取右旋兰索拉唑约25 mg的胶囊内容物(南京源健,批号:20131201、20131202、20131203;日本武田,批号:C19323),精密称定,分别置于50 mL量瓶中,加稀释液溶解并定容至刻度,摇匀,分别进样测定,4批制剂左旋异构体的含量分别为0.12%、0.15%、0.10%、0.13%(n=2)。均符合产品质量标准中规定的含量限度(0.5%)。
3 讨论
3.1 检测波长的确定
取兰索拉唑对照品、左旋兰索拉唑对照品和右旋兰索拉唑原料,用稀释液溶解并稀释成10 μg· mL-1的溶液,在紫外200~400 nm的波长范围内扫描,结果发现三者在285 nm附近均有最大吸收,所以将285 nm作为本品的检测波长。
3.2 色谱柱的选择
据文献报道[2],Chiralcel OD、Chiralcel AD和Chiral AGP手性柱均可用于兰索拉唑对映体的分离和检测。使用Chiralcel OD和Chiralcel AD手性柱均需要使用正相稀释液(异丙醇、正己烷),对环境污染较大;而Chiral AGP手性柱可使用乙腈和磷酸盐溶液的反相稀释液系统,不需要专门的正相设备,对环境污染小。故选择Chiral AGP手性柱。
3.3 耐用性试验
微调检测波长(±5 nm)、柱温(±5℃)及稀释液比例(±2%),在兰索拉唑色谱中,右旋和左旋异构体分离度均符合要求,左旋兰索拉唑对照品主峰柱效符合要求。说明该测定方法适合本品测定,具有良好的耐用性。
[1] 房超,包泳初,陈庆华.右旋兰索拉唑双相控释制剂的药动学研究及其临床疗效[J].世界临床药物,2011,32(7):429-32.
[2] 崔欣,付芳敏,朱槿,等.奥美拉唑、兰索拉唑对映体及相关物质在不同手性柱的分离比较[J].分析化学,2002,30(12):1494-6.
S-isomer Determination in Dexlansoprazole Delayed Release Capsules Using an HPLC Method
GUO Jun-ping
People’s Hospital in Yixing,Yixing 214200,China
Objective:To establish an HPLC method for enantio-separation of S-and R-lansoprazole and quantitation of the S-isomer.Methods:The separation was performed on an AGP chiral column (DAICEL CHIRALPAK,150 mm×4.6 mm,5 μm).The mobile phase was acetonitrile-pH 6.0 sodium phosphate buffer(10∶90)at the flow rate of 0.5 mL·min-1.The column temperature was 30℃,and the UV detection was set at 285 nm.The injection volume was 20 μL.Results:The resolution of the isomers was 3.0,the linear range of the s-isomer was 0.51~5.10 μg·mL-1(r=0.9996),the detection limit was 2.52 ng and the average recovery(n=9)was 98.4%.Conclusion:The method is simple and accurate and can be used for S-isomer assay in dexlansoprazole delayed release capsules.
HPLC;Chiral column;Dexlansoprazole delayed release capsules;S-isomer
R927.2
A
1673-7806(2014)03-228-03
郭俊平,男,副主任药师
E-mail:staff187@yxph.com
2014-03-17
2014-04-15