吡非尼酮对百草枯诱导的大鼠急性肺损伤保护作用研究*
韩枫,凌心
徐州市肿瘤医院药剂科,徐州 221005
吡非尼酮对百草枯诱导的大鼠急性肺损伤保护作用研究*
韩枫,凌心
徐州市肿瘤医院药剂科,徐州 221005
目的:研究吡非尼酮(pirfenidone,PF)对百草枯(paraquat,PQ)诱导的大鼠急性肺损伤的保护作用及机制。方法:30只雄性成年SD大鼠随机分为对照组、PQ组、PF治疗低、中、高组,采用腹腔注射20%PQ溶液诱导大鼠成急性PQ中毒模型。测定各组大鼠肺组织中超氧化物歧化酶(SOD)活性、丙二醛(MDA)以及炎症因子白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)含量变化,同时以蛋白免疫印迹法测定转化生长因子(TGF-β)、结缔组织生长因子(CTGF)、smad3蛋白表达。HE染色观察大鼠肺组织病理改变。结果:与对照组大鼠相比,PQ组大鼠肺组织氧化应激和炎症反应水平明显升高,而给予PF可明显抑制中毒大鼠肺组织氧化应激和炎症反应。蛋白免疫印迹结果显示,中毒大鼠肺组织中TGF-β、CTGF、smad3蛋白表达显著升高,光镜观察显示中毒大鼠肺组织大量肺泡萎缩,部分过度膨胀,组织炎性浸润和纤维化明显。给予PF治疗后,大鼠肺组织TGF-β、CTGF和smad3蛋白表达以及组织损伤和纤维化显著降低。结论:PF可以减轻百草枯中毒大鼠肺组织损伤,其治疗作用可能与其抗炎、抗氧化、抑制TGF-β、CTGF和smad3表达有关。
吡非尼酮;百草枯;氧化应激;炎症反应;转化生长因子;结缔组织生长因子
百草枯(paraquat,PQ,见图1)是一种有机杂环类非选择性触杀型、灭生性除草剂,以其除草效果好、环保等优点而得到广泛应用,然而使用操作不当或口服均可造成中毒[1]。PQ对皮肤、肝脏、肺脏、肾脏等器官均有不同程度的损伤,其中以肺脏毒性尤为突出,主要表现为急性肺泡炎和肺纤维化[2],但其致肺损伤和纤维化的作用机制目前尚未阐明,且无有效拮抗药物,患者常死于多脏器功能衰竭或呼吸衰竭,预后较差[3-4]。
吡非尼酮(pirfenidone,PF,见图1)是一种口服易吸收的小分子药物,临床可用于特发性肺纤维化(IPF)的治疗[5]。研究表明,PF可抑制多种细胞因子的产生,包括白介素6(IL-6)、转化生长因子(TGF-β)等[6],具有较好地抗肺纤维化作用。基于其较好的疗效,其药物作用机制已成为国内外学者研究的热点[7-8],但其肺保护作用机制尚未完全明确。本实验通过建立PQ诱导大鼠急性肺损伤模型,研究PF对大鼠急性肺损伤及纤维化的治疗作用及相关机制。
图1 百草枯和吡非尼酮结构式
1 材料和方法
1.1 主要仪器及设备
UV-754紫外可见分光光度计(上海精密科学仪器有限公司);TGL-16G台式高速离心机(上海安亭科学仪器厂);SSH-2型电热恒温水浴(上海精密科学仪器有限公司);IX71光学显微镜(日本奥林巴斯光学工业株式会社)。
1.2 药品和试剂
PF(纯度99%,南京荣世医药科技有限公司);PQ,山东三元工贸有限公司;大鼠白细胞介素-6(IL-6)和肿瘤坏死因子(TNF-α)ELISA试剂盒(上海西塘生物有限公司);超氧化物歧化酶(SOD)、丙二醛(MDA)测定试剂盒(南京建成生物工程研究所);转化生长因子(TGF-β)、结缔组织生长因子(CTGF)、smad3多克隆一抗(美国BioVision公司)。
1.3 实验动物
雄性成年SD大鼠30只,体重280~310 g,由徐州医学院动物中心提供。
2 实验方法
2.1 大鼠急性肺损伤模型的制备
将SD大鼠随机分为5组,每组6只,分别为正常对照组、PQ组、PF治疗低、中、高剂量组。自由饮食一周后,PQ组和PF组大鼠给予一次性腹腔注射PQ 25 mg·kg-1;对照组给予腹腔注射等量的生理盐水。腹腔注射1 h后,灌胃给予PF治疗,PF低、中、高组剂量分别为10 mg·kg-1、20 mg·kg-1和40 mg· kg-1(PF溶于0.5%的CMC-Na中);对照组大鼠灌胃给予等量CMC-Na溶液。
2.2 样本采集
连续给药3 d,将各组大鼠麻醉处死,取大鼠左肺置于体积重量为4%多聚甲醛固定液中固定,同时取大鼠右肺立刻于-80℃保存,进行后续生化指标测定。
2.3 HE染色
将固定好的大鼠右肺组织进行常规石蜡包埋,连续性49 μm切片,后进行HE染色实验。
2.4 Western blot测定蛋白表达
称取肺组织充分研磨后,按每克组织加入0.5 mL预冷的匀浆缓冲液[Tris缓冲液(TBS)∶苯甲基磺酰氟(PMSF)=20∶11],组织匀浆器12000 r·min-1冰浴匀浆30 s,14000 g 4℃离心15 min,取上清液,BCA蛋白质定量试剂盒测定蛋白浓度。取各组胞浆蛋白,加入等体积10%十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)样品缓冲液,沸水浴10 min,自然冷却后上样行垂直凝胶电泳。水浴电转移法将目的蛋白转移至硝酸纤维素膜上,免疫组化染色marker,鉴定转移效果。5%BSA溶液封闭1 h,室温振荡孵育,TBST液洗膜,分别加入兔抗大鼠TGF-β、CTGF和smad3一抗(1∶1000),4℃孵育过夜,TBST液洗膜3次,每次3 min。然后加入二抗(1∶1000)孵育2 h。回收二抗,TBST液洗膜3次,每次3 min,加显色剂(NBT/BCIP显色试剂盒),随时观察,达到要求后流水洗涤终止反应,所得条带经图像处理仪进行激光扫描,Image J软件定量分子。
2.5 生化指标测定
大鼠右肺组织匀浆后,3000 r·min-1离心10 min,取上清液,测定SOD、MDA、IL-6和TNF-α的水平,严格按照试剂盒规定的方法比色测定吸光度,按公式换算成SOD的活性以及MDA、IL-6和 TNF-α的浓度。
2.6 统计学方法
3 结果
3.1 PF对PQ损伤大鼠肺组织SOD活性和MDA含量的影响
表1结果显示,与对照组比较,PQ组肺组织SOD活性显著降低(P<0.001),MDA含量显著升高(P<0.001);与PQ组比较,PF治疗中、高剂量组大鼠肺组织SOD活性升高(P<0.05),而MDA含量显著降低(P<0.05)。
表1 PF对PQ致大鼠肺组织损伤的SOD活性和MDA含量的影响(±s,n=6)
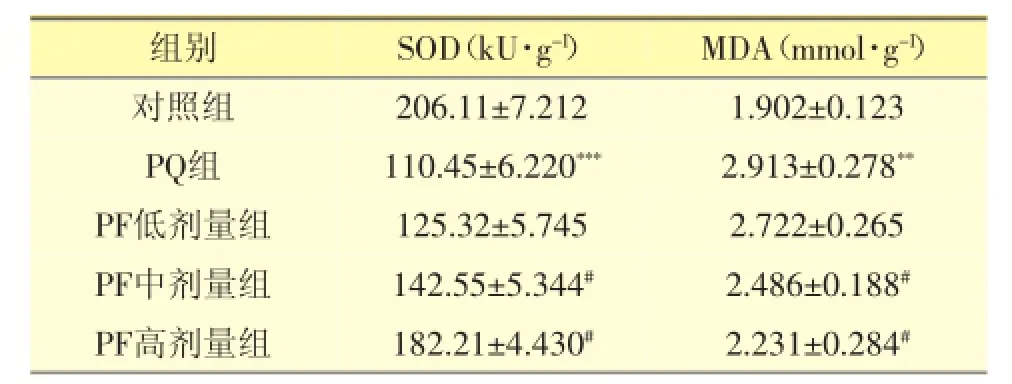
表1 PF对PQ致大鼠肺组织损伤的SOD活性和MDA含量的影响(±s,n=6)
与对照组比较:***P<0.001,**P<0.01;与PQ组比较:#P<0.05
组别SOD(kU·g-1)MDA(mmol·g-1)对照组206.11±7.2121.902±0.123PQ组110.45±6.220***2.913±0.278**PF低剂量组125.32±5.7452.722±0.265PF中剂量组142.55±5.344#2.486±0.188#PF高剂量组182.21±4.430#2.231±0.284#
3.2 PF对PQ损伤大鼠肺组织IL-6和TNF-α含量的影响
表2结果显示,与对照组比较,PQ组大鼠肺组织IL-6和TNF-α含量显著升高(P<0.001);与PQ组比较,PF治疗中、高剂量组大鼠肺组织IL-6和TNF-α含量降低(P<0.05或P<0.01)。
表2 PF对PQ致大鼠肺组织损伤的IL-6和TNF-α含量的影响(±s,n=6)

表2 PF对PQ致大鼠肺组织损伤的IL-6和TNF-α含量的影响(±s,n=6)
与对照组比较:***P<0.001;与PQ组比较:#P<0.05;##P<0.01
组别IL-6(pg·mL-1)TNF-α(pg·mL-1)对照组86.94±6.6774.20±12.65PQ组658.76±4.92***437.90±6.59***PF低剂量组594.82±5.77380.70±7.33PF中剂量组420.11±6.44#260.29±10.35#PF高剂量组384.54±2.89##172.13±15.82##
3.3 PF对PQ损伤大鼠肺组织TGF-β、CTGF和smad3蛋白表达的影响
免疫印迹实验结果显示(见图2和表3),PQ中毒大鼠肺组织中TGF-β的蛋白表达明显升高(***P< 0.001),给予PF治疗后与PQ组大鼠相比,其表达显著降低(##P<0.01);同时,染毒大鼠肺组织中CTGF蛋白表达显著升高(**P<0.01),给予PF治疗后与PQ组大鼠相比,其表达显著降低(#P<0.05);smad3蛋白表达在PQ中毒大鼠的肺组织中明显升高(**P< 0.01),给予PF治疗后与PQ组大鼠相比,其表达显著降低(#P<0.05)。
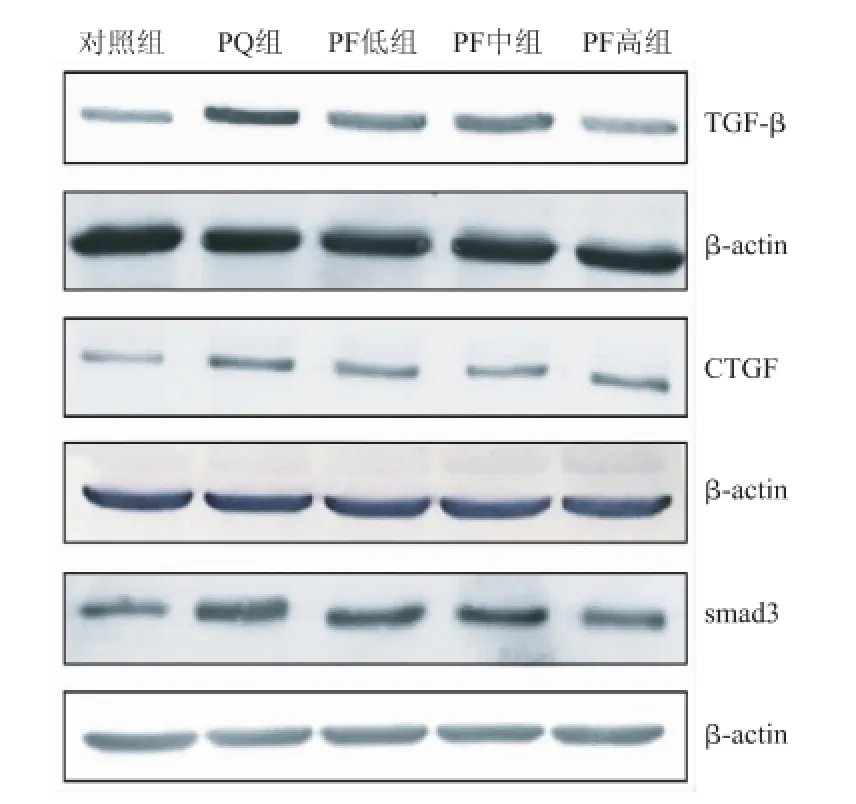
图2 PF对PQ致大鼠肺组织损伤的TGF-β、CTGF和smad3蛋白表达的影响(±s,n=3)
3.4 HE染色
对照组肺泡结构清晰,肺泡壁薄,肺泡间隔无增宽及充血,无炎性细胞浸润及出血现象(图3-A);PQ组大鼠肺组织成纤维细胞大量增殖,肺充血、肺水肿及炎性细胞浸润病变严重处见纤维瘢痕样组织,肺泡萎陷或消失(图3-B);给予PF治疗后肺组织损伤情况明显降低(图3-E)。
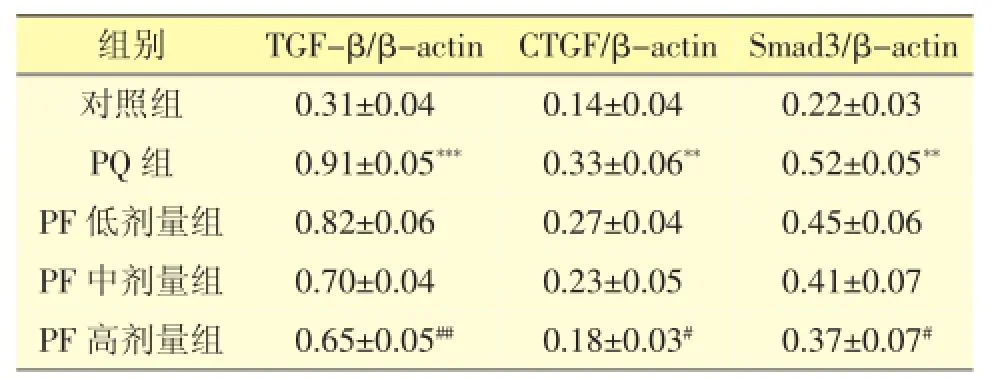
表3 TGF-β、CTGF和smad3蛋白表达灰度值比较
4 讨论
多项研究表明[2,9],PQ对染毒后机体内部氧化应激和炎症反应水平升高,过量的氧自由基和促炎因子具有广泛的致病作用,可引起细胞、组织和机体的损伤,在肺部炎症、肺纤维化的进程中具有重要作用。
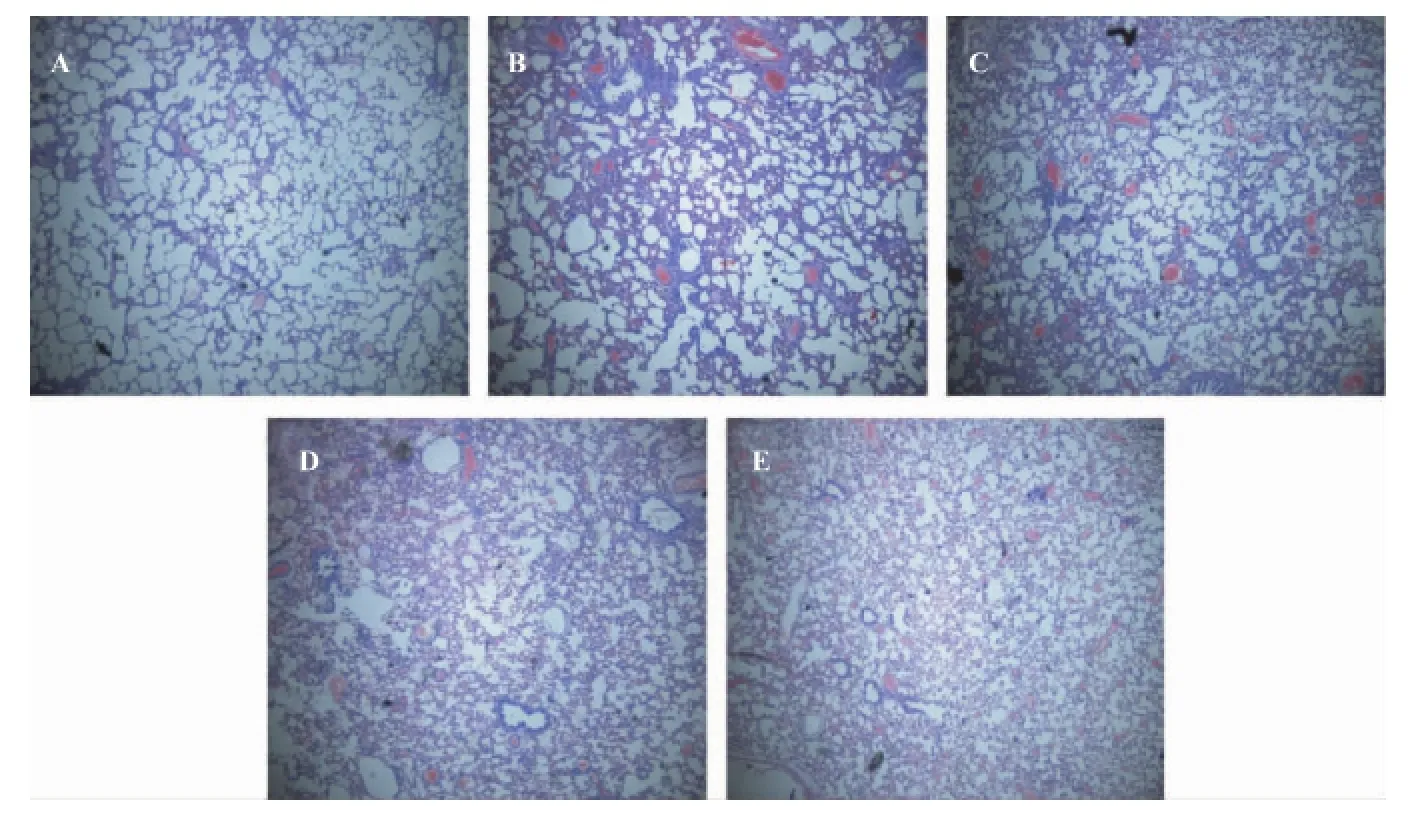
图3 PF对肺组织的保护作用
有文献报道[10],CTGF作为即刻早期基因编码的蛋白,具有明显的丝裂原性和趋化性,可调控基质成分的产生和积聚,促进成纤维细胞趋化和分裂,同时CTGF mRNA变化规律与TGF-β非常类似,且TGF-β在PQ中毒动物肺组织纤维化过程中起关键作用,并进一步证实CTGF作为TGF-β的下游效应分子介导了其纤维化的进程。研究显示[11],smad蛋白家族在肺部病变及后期纤维化过程中起重要作用,可调控TGF-β在肺纤维化过程中的表达。实验结果发现,PQ中毒大鼠肺组织氧化应激及炎症水平显著升高,TGF-β、CTGF及smad3的蛋白表达水平明显增加,这与前期文献报道相一致[10-11]。
本实验发现,PF可明显降低PQ中毒大鼠肺组织中氧化应激和炎症反应水平,显示了PF在治疗肺组织纤维化过程中具有较好的抗炎、抗氧化作用;组织形态学观察也发现,PF可显著降低PQ中毒导致的肺部感染及组织纤维化,维持肺组织正常生理功能;同时研究发现,PF可显著抑制大鼠肺组织中TGF-β、CTGF及smad3的蛋白表达的上调。这提示,PF对PQ中毒大鼠肺组织氧化应激和炎症损伤均具有保护作用,且抑制了肺组织的纤维化,其保护作用与抑制TGF-β、CTGF及smad3的表达上调有关。
综上所述,PF对PQ诱导的大鼠急性肺损伤具有显著的保护作用,其作用机制可能与减轻肺组织自由基及炎症反应,抑制TGF-β、CTGF及smad3的表达上调有关。
[1] Serra A,Domingos F,Prata MM.Paraquat intoxication [J].Acta Med Port,2003,16(1):25-32.
[2] Dinis-Oliveira RJ,Duarte JA,Sánchez-Navarro A,et al.Paraquat poisonings:mechanisms of lung toxicity, clinical features,and treatment[J].Crit Rev Toxicol, 2008,38(1):13-71.
[3] BertoloteJM,FleischmannA,EddlestonM,etal. Deaths from pesticide poisoning:a global response[J].Br J Psychiatry,2006,189:201-3.
[4] Sittipunt C.Paraquat poisoning[J].Respir Care,2005, 50(3):383-5.
[5] Raghu G,Johnson WC,Lockhart D,et al.Treatment of idiopathic pulmonary fibrosis with a new antifibrotic agent,pirfenidone:results of a prospective,open-label PhaseⅡstudy[J].Am J Respir Crit Care Med,1999, 159(4 Pt 1):1061-9.
[6] Spond J,Case N,Chapman RW,et al.Inhibition of experimentalacutepulmonaryinflammationbypirfenidone[J].Pulm Pharmacol Ther,2003,16(4):207-14.
[7] Azuma A,Nukiwa T,Tsuboi E,et al.Double-blind, placebo-controlled trial of pirfenidone in patients with idiopathic pulmonary fibrosis[J].Am J Respir Crit Care Med,2005,171(9):1040-7.
[8] 李军,伟沈秀,微孙未,等.吡非尼酮抗百草枯中毒小鼠肺纤维化的研究[J].中华劳动卫生职业病杂志,2012,29(2):87-93.
[9] 黄敏,张平,常秀丽,等.核因子-κB及细胞因子在百草枯致大鼠肺损伤中的动态变化[J].中华劳动卫生职业病杂志,2009,27(8):463-7.
[10] Ihn H.Pathogenesis of fibrosis:role of TGF-beta and CTGF[J].Curr Opin Rheumatol,2002,14(6):681-5.
[11] Leivonen SK,Häkkinen L,Liu D,et al.Smad3 and extracellular signal-regulated kinase 1/2 coordinately mediate transforming growth factor-beta-induced expression of connective tissue growth factor in human fibroblasts[J].J Invest Dermatol,2005,124(6):1162-9.
Protective Effects of Pirfenidone against Paraquat-Induced Lung Damage in Rats*
HAN Feng,LING Xin
Pharmacy Department,Xuzhou Cancer Hospital,Xuzhou 221005
Objective:To study the protective effect of Pirfenidone(PF)against Paraquat(PQ)-induced lung damage in rats and its underlying mechanisms.Methods:Thirty rats were randomly divided into five groups:control group,PQ group,PF low-,middle-and high-dose treatment groups.The activties of superoxide dismutase(SOD),the contents of malondialdehyde(MDA),IL-6 and TNF-α in the lung tissues were examined.Also,the expression of TGF-β,CTGF and smad3 in lung tissues w measured by Western-blotting.The lung coefficient was calculated and pathological changes of lung tissues were observed by HE staining.Results:Compared with the control group rats,the levels of oxidative stress and inflammation were increased in the lung tissues of PQ group rats,while the PF group rats exhibited significant decrease in oxidative stress and inflammation.The expression of TGF-β,CTGF and smad3 were increased in PQ group rats.The sections showed that the lung tissue damage was obvious in PQ group rats with alveolar atrophy,overinflation,inflammatory cell infiltration and pulmonary fibrosis.However,the administration of PF significantly decreased the damage.Conclusion:The results indicated that PF had a protective effect against PQ-induced lung damage in rats.It is considered that this protective effect may be related to its free radical scavenging activity,inhibition of inflammation and inhibition of the expression of TGF-β,CTGF and smad3.
Pirfenidone;Paraquat;Oxidative stress;Inflammatory reaction;Transforming growth factor; Connective tissue growth factor
R963
A
1673-7806(2014)02-101-04
徐州市科技计划项目(编号:XZZDY1204)
韩枫,副主任药师、药剂科主任
E-mail:hanfeng1966@126.com
2013-12-16
2013-12-26

