探究氢氧燃料电池的工作原理
李聪芳
氢氧燃料电池是利用原电池的工作原理,将氢气(燃料)和氧气(氧化剂)反应所放出的化学能直接转化为电能的装置。高中化学教材必修2第二章第二节中给出了氢氧燃料电池的构造示意图,课后题第5题以信息的形式给出了碱性电解质溶液中氢氧燃料电池的电极反应式,使学生有一个大体的印象,选修4第四章第二节中简单介绍了它的工作原理,但学生们还是搞不清是怎样产生电流的,难以相信氢气和氧气不经点燃就能反应,还能产生电流。本文详细探究了氢氧燃料电池的工作原理,设计了简单的实验,以事实来说明,使学生心服口服。
一般原电池的工作原理是具有还原性的物质在一个电极上失去电子发生氧化反应,失去的电子通过导线流向另一个电极,在该电极上具有氧化性的物质接受电子发生还原反应,从而形成电子的定向移动,也就形成了电流。一般原电池的构成条件是:两个活性不同金属或导电的非金属作电极,两电极材料均插入电解质溶液,电极相连形成闭合回路。
理论上任何一个能自发进行的、放出能量的化学反应均能设计为原电池,氢气和氧气反应生成水就符合这一条件。将2H2+O2=2H2O 拆成两个半反应,氧化反应为:H2-2e-=2H+ ,还原反应为:O2+4e-+2H2O=4OH-,可见,失去电子和得到电子的物质是气体,而气体不能作为电极材料,必须有一个气体可以依附的导电的载体。我选择的是1号电池的碳棒:将一端磨尖(尖端放电,更有利于反应),为了使碳棒表面吸附更多的气体,将表面进行一下处理,即在酒精喷灯上烧红,然后迅速放入冷水,如此反复几次,可使表面变得疏松,也可用热的浓硝酸处理一下碳棒(不建议用,因会放出NO2气体,有毒),效果也很好。碳棒处理好了,该选择电解质溶液了。由于该电池的电解质溶液不参与反应,所以电解质溶液只要不影响电池的工作均可,酸性电解液如H2SO4溶液,碱性电解液如NaOH溶液,中性电解液如Na2SO4溶液均可。再有導线若干,装置材料就完成了。
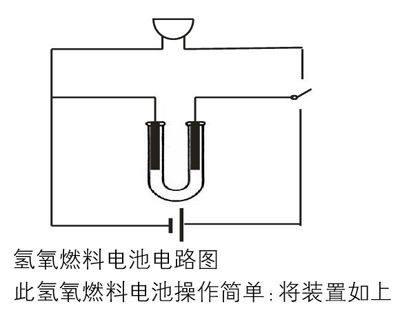
还有最重要的一个问题,即H2和O2的来源。实验室中做氢氧燃料电池的实验,若由外界通入H2和O2显然比较复杂,所以我选用的是电解水产生H2和O2。生成的H2和O2吸附在碳棒上,利用碳棒上吸附的H2和O2构成氢氧燃料电池,用生日蜡烛中的电子发声元件检验电流。为了快速的由电解水的电路转化为燃料电池的电路,引入单刀双掷开关,装置见下图
氢氧燃料电池电路图
此氢氧燃料电池操作简单:将装置如上图组装好,打开电源,即可在两极上观察到明显的气泡产生,然后断开电源,将单刀双掷开关掷向另一端,马上就能听到生日歌,效果明显,学生反响强烈。
这一实验由废电池的碳棒、泡沫塑料和实验室中简单的仪器制成氢氧燃料电池的装置,具有电解水及燃料电池供电的双重示范效果,是一套具有高效能和对环境友好的绿色实验装置,适合于电化学教学演示及学生亲手做实验,使我们在电化学的教与学上更为生动有趣,方便提高学生学习电化学这一知识板块的兴趣及学习成效。本专题通过对氢氧燃料电池工作原理的探究,使学生在自主的获取知识、知识迁移、探索知识的形成过程等方面更为主动,符合新课程的教学理念。

