微波耦合类Fenton处理水中对硝基苯酚
潘维倩,张广山,郑 彤,张 洁,王 鹏,2*(.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨50090;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 50090)
微波耦合类Fenton处理水中对硝基苯酚
潘维倩1,张广山1,郑 彤1,张 洁1,王 鹏1,2*(1.哈尔滨工业大学市政环境工程学院,黑龙江 哈尔滨150090;2.哈尔滨工业大学城市水资源与水环境国家重点实验室,黑龙江 哈尔滨 150090)
针对对硝基苯酚环境危害大、难生物降解的特点,为克服传统Fenton适用pH范围窄的缺点,制备了CuO催化剂,并对微波耦合类Fenton氧化对硝基苯酚溶液进行了实验研究,考察了H2O2投加量、催化剂投加量、微波功率、辐照时间、溶液初始pH对PNP去除效果的影响.结果表明,在H2O2和催化剂投加量分别为0.06mol/L和 0.3g/L,微波功率 125W,不调节溶液初始pH(约为 6)的条件下,初始浓度为50mg/L的PNP溶液反应6min去除率达92%, TOC去除63%.比较不同氧化体系,得到微波能够增大微波耦合类Fenton体系中•OH的生成量,从而提高对PNP的去除率.实验表明,CuO催化微波耦合类Fenton作为一种新型类Fenton反应,能克服传统Fenton适用pH范围窄的局限性,并且显著提高反应效率,拓展了Fenton反应在废水处理中的应用.
类Fenton;微波;PNP;CuO
对硝基苯酚是化工生产中重要的有机合成原料,不仅是染料、农药和医药的重要中间体,还广泛应用于光化学品、防腐剂等生产过程[1].对硝基苯酚属高毒性物质,被列于世界“环境优先控制有毒有机污染物”的名单前列[2].它具有苯环结构,在环境中残留时间较长,所造成的环境危害和潜在的危险性均很大[3].物理法处理,常见的有吸附法、萃取法等.对于中低浓度的对硝基苯酚废水,目前研究较多的采用化学氧化法处理.
传统 Fenton反应应用于有机污染物的处理已有诸多报道.但传统Fenton反应pH值适应范围窄、催化剂不能重复利用、大量铁泥产生的缺点制约了其大规模应用[4].研究表明,相对于均相催化反应,多相催化具有催化剂重复利用性好、不易受pH值影响等优点[5-6].微波加热具有快速高效的特点,微波技术已被应用到废物处理的研究中[7].近年来国内外一些学者不断地探索利用微波与高级氧化技术的耦合作用处理各种污染物[8-10].目前采用微波-CuO-H2O2联合处理对硝基苯酚鲜有报道.本文采用实验室制备的CuO为催化剂,微波耦合类Fenton氧化体系处理PNP溶液,以期待在无需调节反应前后溶液 pH值条件下,快速、高效去除水中PNP.
1 材料与方法
1.1 CuO的制备
本实验采用表面活性剂辅助水热法制备CuO.表面活性剂和铜源分别为十六烷基三甲基溴化铵和硝酸铜.称取一定质量的Cu(NO3)2·3H2O和C16H33(CH3)3NBr溶于50mL去离子水中,在搅拌状态下逐滴滴加 5mol/L的NaOH溶液直至混合物pH值至10,继续搅拌2h,将混合物移置入 100mL水热反应釜中,160℃保温12h.自然冷却,离心弃上清液,用去离子水和无水乙醇交替反复洗涤,离心,最后于60℃干燥12h,研磨得到所需CuO催化剂.
1.2 CuO的表征
采用日本理学公司的D/max-rB型旋转阳极X射线衍射仪(XRD)对催化剂进行物相测定,Cu阳极靶,激发波长 1.5418Å,加速电压 45kV,电流50mA,扫描步长 0.02°/s.采用美国 FEI公司的Helios Nanolab 600i型场发射扫描电子显微镜(FESEM)观察催化剂的表面形貌.采用美国麦克仪器公司的ASAP2020型气体吸附仪(BET)通过在 77K时液氮的吸附来分析催化剂的比表面积及孔容孔径分布情况.
1.3 微波耦合类Fenton处理PNP
采用实验室配制的50mg/L的PNP溶液进行研究,PNP的微波耦合类Fenton实验在经家用微波炉改造的功率连续可调的微波化学实验炉中进行,微波发射频率2.45GHz,最大功率700W.将100mLPNP溶液移入250mL锥形瓶中,加入一定量 H2O2和催化剂,开启一定功率微波进行反应.每隔1min取样1mL立即经0.45µm滤膜过滤,用 4mol/L的 NaOH溶液稀释一定倍数后检测.PNP溶液初始pH用H2SO4和NaOH调节.
1.4 分析测定方法
PNP浓度采用双波长紫外-可见分光光度计(岛津,UV-2550)在400nm处测定.TOC采用总有机碳分析仪(岛津,TOC-VCPN)测定.反应后PNP溶液中 Cu2+浓度采用火焰原子吸收分光光度计(珀金埃尔默公司,AAnalyst200)测定.不同氧化体系反应过程中⋅OH生成规律采用分子荧光光谱法检测.以对苯二甲酸为⋅OH捕获剂,捕获⋅OH生成唯一产物2-羟基对苯二甲酸,其在315nm激发波长下会在425nm波长处发出强烈荧光[11].根据2-羟基对苯二甲酸在425nm处发射的相对荧光强度判断体系中⋅OH的生成规律.
2 结果与讨论
2.1 CuO表征分析
催化剂的XRD谱见图1.从图1可以看出,得到的晶相衍射峰峰型尖锐,强度较大,说明在本实验条件下制得的催化剂结晶度良好.2θ在35.54°,38.72°,61.46°处出现的衍射峰位置和强度与单斜相CuO特征衍射谱峰(JCPDS 45-0937)一致,对应的是单斜相CuO的002,111,-113晶面结构.此外,催化剂中还存在单斜相 Cu4SO4(OH)6(JCPDS 43-1458)杂质,这是由于制备过程中水热前驱物 pH值不够高,在水热反应过程中可能会生成Cu4SO4(OH)6[12].
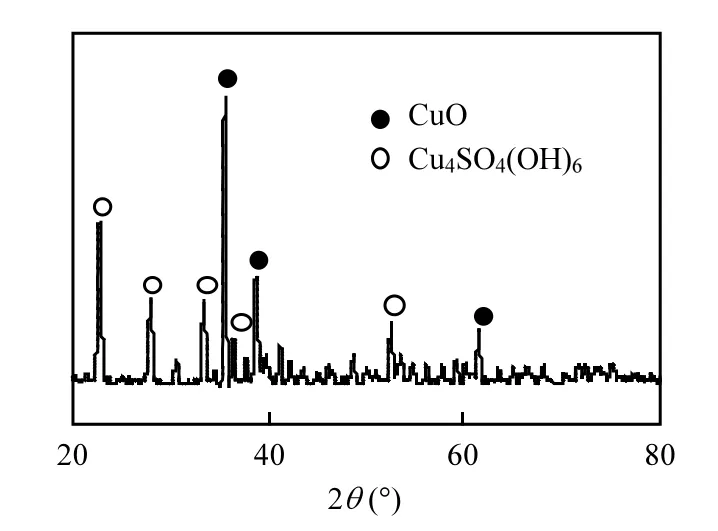
图1 催化剂的XRD谱图Fig.1 X-ray diffractogram of the catalyst
图2是催化剂的SEM结果.由图2可以看出,催化剂表面大部分分散均匀,偶有团聚.样品由大量的棒状和少量的粒状两种形貌构成,棒状长大约为0.8~1.5µm,宽大约为80~100nm,粒状尺寸大约为 50~80nm.此外,得到样品的 BET比表面积为 30.91m2/g,孔容为 0.1496cm3/g,平均孔径为9.22nm.

图2 催化剂的FE-SEM照片Fig.2 FE-SEM images of the catalyst
2.2 微波耦合类Fenton处理PNP
2.2.1 不同氧化体系下PNP去除及⋅OH生成规律 为考察微波耦合类 Fenton对 PNP的去除,比较了 4种氧化体系:单独微波辐照(MW),类Fenton体系(FL),微波耦合类 Fenton体系(MW/FL)和微波辐照 H2O2氧化(MW/H2O2)对PNP的去除效果.实验条件为:PNP初始pH值为6(未调节),CuO和H2O2投加量分别为0.3g/L和0.06mol/L,微波功率 125W 辐照,反应时间均为6min.
由图3可见,不加入催化剂和H2O2,仅微波辐照,PNP几乎没有去除,这是由于2.45GHz微波能量不足以破坏 PNP的化学键[13].类 Fenton体系6min对PNP仅去除8%,而微波耦合类Fenton体系中,CuO和 H2O2投加量与类 Fenton体系相同,PNP去除率达92%,比类Fenton体系显著提高,表明微波辐照与类Fenton之间存在很好的协同作用.此外,没有催化剂的加入,微波辐照 H2O2氧化对PNP也具有一定去除效果.比较不同氧化体系,对PNP去除能力顺序为:MW/FL>MW/H2O2> FL>MW.
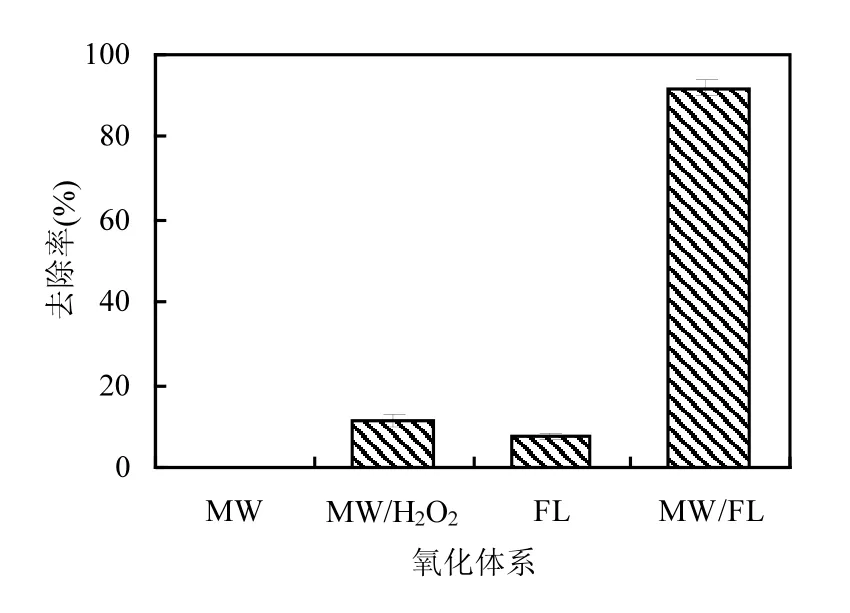
图3 不同氧化体系下PNP去除率Fig.3 Removal efficiency of PNP in different oxidation processes
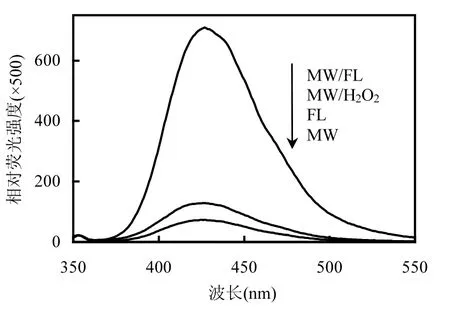
图4 不同氧化体系下生成的2-羟基对苯二甲酸相对荧光强度比较Fig.4 Comparison of relative fluorescence intensity of 2-hydroxyterephthalic acid formed in different oxidation processes
图4为不同氧化体系的⋅OH生成规律.可见,不同氧化体系⋅OH生成量顺序为:MW/FL> MW/H2O2>FL>MW,与PNP去除能力顺序一致,说明各体系中 PNP的去除均主要为所产生的⋅OH氧化降解导致.在微波耦合类Fenton体系中,微波场的存在很大程度上促进了类Fenton体系⋅OH的生成.此外,微波辐照可使 H2O2分解产生一定量⋅OH[13]:
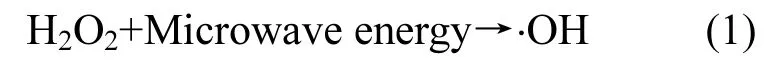
因此微波辐照H2O2氧化对PNP也具有一定的氧化去除能力.
2.2.2 单因素对微波耦合类Fenton去除PNP效果的影响 图5为H2O2投加量对PNP去除效果的影响.实验条件为:PNP初始pH值为6,CuO投加量为0.3g/L,微波功率为125W,改变H2O2投加量从0.02增加到0.12mol/L.结果表明,PNP去除效果随H2O2投加量增加呈上升趋势.当H2O2投加量由0.02mol/L增加至0.06mol/L时,反应6min后PNP去除率由60%提高至92%.但当H2O2投加量大于 0.06mol/L以后,继续增加 H2O2浓度,PNP去除效果变化不大.这是因为当 H2O2浓度较低时,增加 H2O2投加量,生成的⋅OH的量也随之增加,PNP去除率提高,但是当 H2O2浓度过高时,H2O2也可能成为⋅OH清除剂[14]:
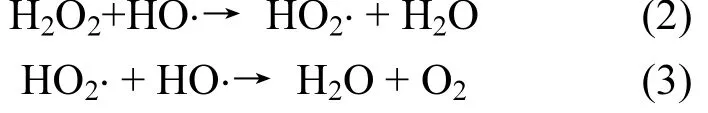
从而使H2O2分解无效,PNP去除率不再提高.
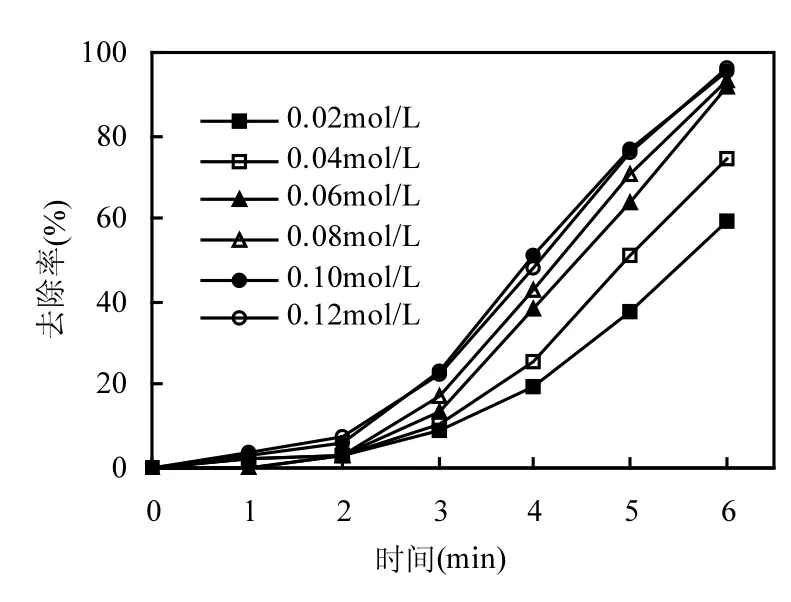
图5 H2O2投加量对PNP去除效果的影响Fig.5 Effect of H2O2dosage on the PNP removal efficiency
图6为CuO投加量对PNP去除效果的影响.实验条件为:PNP初始pH值为6,H2O2投加量为0.06mol/L,微波功率为125W,改变CuO投加量分别为0.1,0.3,0.5,0.75g/L.由图6可以看出,当CuO投加量小于0.3g/L时,PNP去除率随CuO投加量增大而增加,0.3g/L时达到最大PNP去除率92%.当CuO投加量大于0.3g/L时,继续增大催化剂投加量,PNP去除效果不变.作为微波耦合类Fenton的催化剂,增加 CuO的量能够增加活性点位,从而加速⋅OH的产生,提高PNP的去除率,但当催化剂达到一定投加量以后,氧化剂和底物量不变,因此继续增加催化剂的量不能进一步提高PNP去除率.
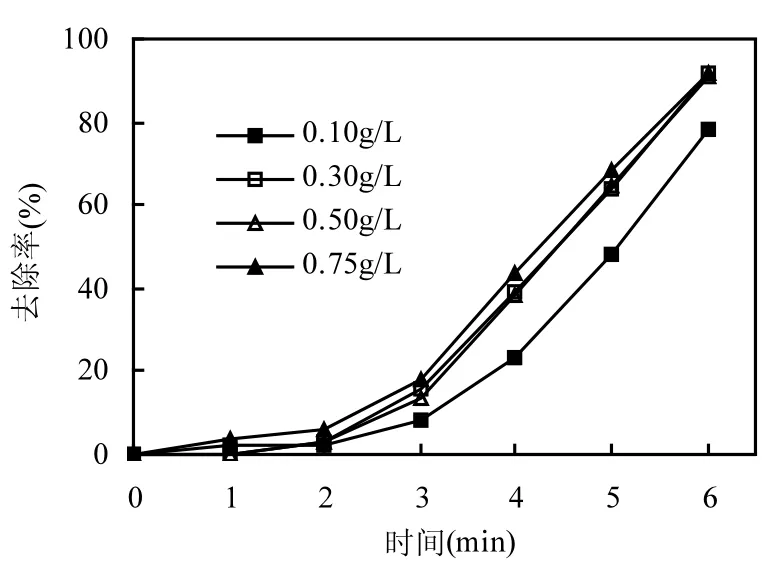
图6 CuO投加量对PNP去除效果的影响Fig.6 Effect of CuO dosage on the PNP removal efficiency
图7 微波功率和辐照时间对PNP去除效果的影响Fig.7 Effects of microwave power and irradiation time on the PNP removal efficiency
图7为微波功率和辐照时间对PNP去除效果的影响.实验条件为:PNP初始pH值为6,H2O2和CuO投加量分别为0.06mol/L和0.3g/L,固定微波能耗改变微波功率分别为75W辐照10min, 100W辐照7.5min,125W辐照6min和150W辐照 5min.由图 7可知,在消耗相同微波能耗时,不同微波功率PNP去除率相差不大,约为87~92%.但是微波功率越高,PNP去除越迅速.综合考虑反应时间的因素,选取125W辐照6min作为本实验的最佳微波功率和辐照时间.微波 125W 辐照6min后,PNP溶液温度约为70℃.此外还可看出,在反应过程的前2~3钟,PNP去除缓慢,此后随反应时间的延长,PNP去除速率加快.
在传统Fenton体系中,pH值是影响Fenton反应的重要因素,最佳反应 pH值范围为 2~3.5.这是因为主要催化相是 Fe(OH)2+,pH>3.0时,由于铁离子沉淀而失去催化作用,⋅OH数量减少,造成有机污染物的降解速度降低[6].图 8为溶液初始 pH值对 PNP去除效果的影响.实验条件为:H2O2和 CuO投加量分别为 0.06mol/L和0.3g/L,微波功率125W辐照6min,调节溶液初始pH值为4~10.可以看到,以CuO为催化剂,微波耦合类Fenton体系拓宽了传统Fenton的适宜反应pH值,在pH值处于4~7范围时,PNP均有良好去除,PNP去除率均达到 80%以上.随 pH值升高, PNP去除效果下降.当pH值从7升高到8时,PNP去除率从 84%降至 58%.此后随 pH值继续升高,PNP去除率下降趋势减慢.
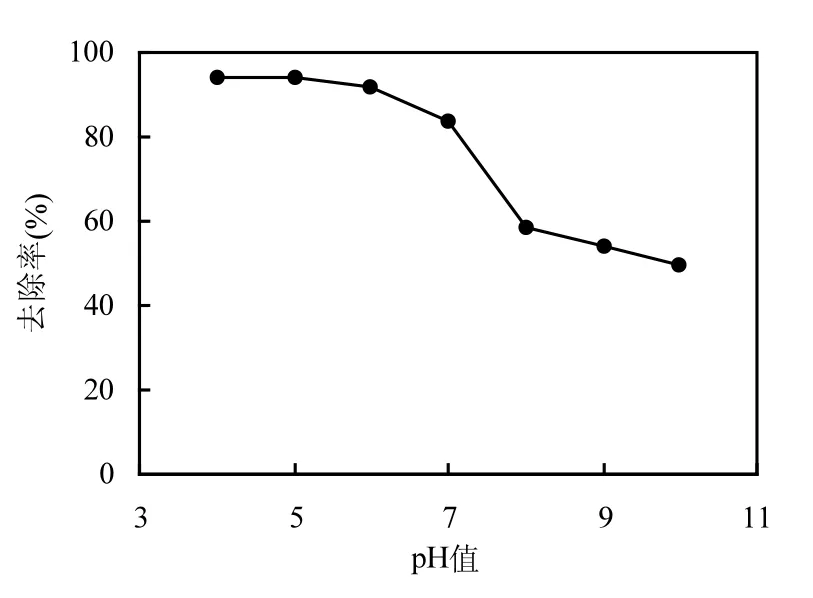
图8 初始pH对PNP去除效果的影响Fig.8 Effect of initial pH on the PNP removal efficiency
因此,CuO催化微波耦合类Fenton处理PNP的最佳反应条件为:H2O2和 CuO投加量分别为0.06mol/L和0.3g/L,微波功率125W辐照6min,PNP溶液初始pH值无需调节.图9为最佳反应条件下,微波耦合类Fenton体系对PNP及TOC的去除情况.由图9可见,反应6min时虽然PNP去除率已达90%以上,但是由于中间产物的存在,TOC去除约为63%,表明已有大部分PNP被矿化.
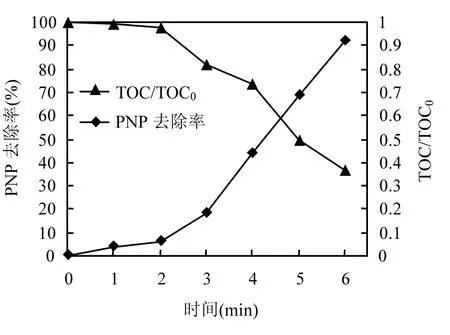
图9 PNP与TOC的去除Fig.9 PNP removal efficiency and TOC/TOC0in the oxidation process
2.2.3 CuO催化剂的溶出 考察催化剂的溶出具有重要意义[16]:(i)溶出的金属离子可能使得反应体系成为一个均相或均相/非均相混合体系,而不是一个完全的异相类Fenton体系;(ii)从催化剂中可能溶出有毒的金属离子造成二次污染,从而需要进一步的处理;(iii)持续的溶出会导致催化剂活性逐渐降低.
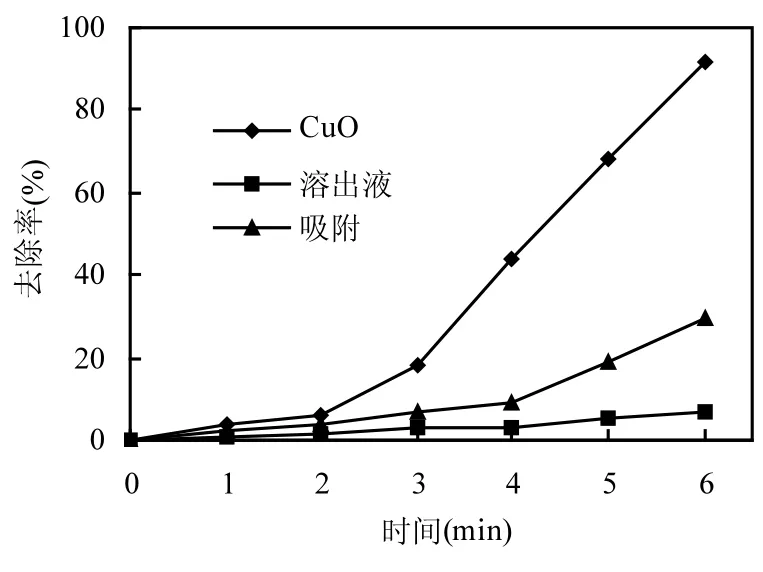
图10 CuO催化、溶出液反应、CuO吸附去除PNPFig.10 PNP removal efficiency under catalysis, heterogeneous catalysis and adsorption
图10为CuO催化、溶出液反应和CuO吸附对PNP的去除效果的比较.CuO催化为最佳工艺条件下微波耦合类Fenton降解PNP.溶出液反应是将0.3g/LCuO加入到100mLPNP溶液中,震荡 30min后经 0.45µm滤膜过滤所得的溶出液,加入 H2O2开启微波进行反应,H2O2投加量和微波功率与 CuO 催化相同.CuO 吸附是在100mLPNP溶液中仅加入 0.3g/LCuO,而不加入H2O2,也不开启微波.由图10可见,没有CuO催化剂的存在仅溶出液,6minPNP仅去除30%,相比之下,CuO催化剂存在下,PNP去除达90%以上.另外,仅CuO吸附,PNP基本没有去除.测定反应后溶液中Cu2+浓度为7.2mg/L,溶出比例约3%.说明CuO催化微波耦合类Fenton对PNP的去除主要是发生在CuO表面的异相类Fenton,其次还有由于溶出的少量Cu2+发生的均相类Fenton.
2.2.4 微波耦合类Fenton氧化PNP的机理 由不同体系⋅OH生成规律可知(图 4),微波耦合类Fenton过程生成大量⋅OH.此外,类Fenton和微波辐照H2O2氧化体系也产生一定量⋅OH.因此,可以推断在微波耦合类Fenton体系中,PNP的氧化降解主要是由H2O2转化生成的强氧化性⋅OH所致.一方面, H2O2在微波辐照下分解产生一部分⋅OH[13]:

⋅OH攻击PNP发生矿化的反应历程已有研究报道[17-18].PNP降解中间产物通常有四硝基儿茶酚,对苯二酚,偏苯三酚和苯醌,产生过程如图11所示.PNP降解时苯环的邻位最先容易受到⋅OH攻击,生成四硝基儿茶酚.与此平行地,硝基也可能从苯环上脱除,生成亚硝酸根离子和对苯二酚,亚硝酸根离子最终进一步被氧化为硝酸根离子于溶液中,对苯二酚同样邻位可受到⋅OH攻击生成偏苯三酚,或者转化为苯醌.然后,这些化合物再进一步发生一系列反应最终开环生成羧酸类物质,再最终被彻底氧化为二氧化碳.
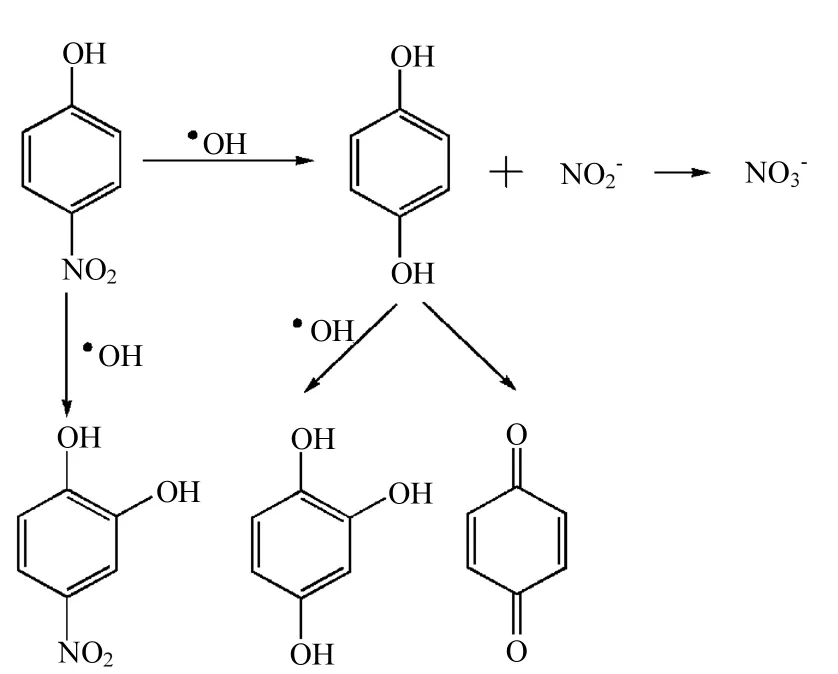
图11 PNP中间产物产生途径Fig.11 Producing pathway of the intermediate degradation products of PNP
3 结论
3.1 CuO催化微波耦合类Fenton能快速降解和矿化 PNP.其最佳反应条件为:H2O2和催化剂投加量分别为0.06mol/L和0.3g/L,微波功率125W反应6min,无需调节溶液初始pH值.在此条件下,初始浓度50mg/L的PNP去除率为92%,TOC去除63%.
3.2 CuO催化微波耦合类Fenton体系可有效拓宽传统Fenton的适用pH值.溶液初始pH≤7范围内,PNP去除率均可达80%以上.
3.3 微波耦合类 Fenton体系可显著增大类Fenton对PNP的去除效果.微波耦合类Fenton将PNP去除率由类Fenton的8%提高至92%.与类Fenton体系相比,其⋅OH生成量明显增大.
[1] Kam L T, Odile T. Minerzlization of p-nitrophenol by pentachlorophenol-degrading Sphingomonas spp [J]. FEMS Microbiology Letters, 1997,155(1):107-114.
[2] Kam L T, Steve C. The Sphingomonas species UG30 pentachlorophenol-4-monooxygenase in p-nitrophenol degradation [J]. FEMS Microbiology Letters, 1999,173(1):247-253.
[3] 刘 智,洪 青,张晓舟,等.甲基对硫磷降解菌DLL-E4降解对-硝基苯酚特性 [J]. 中国环境科学, 2003,23(4):435-439.
[4] 冯 勇,吴德礼,马鲁铭.黄铁矿催化类 Fenton反应处理阳离子红X-GRL溶液 [J]. 中国环境科学, 2012,32(6):1011-1017.
[5] Barreiro J C, Capelato M D, Martin M D. Oxidativedecomposition of atrazine by a Fenton-like reaction in a H2O2/ferrihydrite system [J]. Water Research, 2007,43(1):55-62.
[6] 张亚平,韦朝海,吴超飞.光Fenton反应的Ce-Fe/Al2O3催化剂制备及特性表征 [J]. 中国环境科学, 2006,26(3):320-323.
[7] Wu Z L, Ondruschka B, Cravotto G. Degradation of Phenol under Combined Irradiation of Microwaves and Ultrasound [J]. Environmental Science and Technology, 2008,42(21):8083-8087.
[8] Homem V, Alves A, Santos L. Microwave-assisted Fenton's oxidation of amoxicillin [J]. Chemical Engineering Journal, 2013, 220:35-44.
[9] Ai Z H, Wang Y N, Xiao M, et al. Microwave-induced catalytic oxidation of RhB by a nanocomposite of Fe@Fe2O3core-shell nanowires and carbon nanotubes [J]. Journal of Physical Chemistry C, 2008,112(26):9847-9853.
[10] Cravotto G, Di Carlo S, Ondruschka B, et al. Decontamination of soil containing POPS by the combined action of solid Fenton-like reagents and microwaves [J]. Chemosphere, 2007,69(8):1326-1329.
[11] Liao W C, Wang P. Microwave-assisted Photocatalytic Degradation of Dimethyl Phthalate using a Microwave Discharged Electrodeless Lamp [J]. Journal of the Brazilian Chemical Society, 2009,20(5):866-872.
[12] Sun J H, Jing Y, Yao Y, et al. Controlled synthesis of Cu4(OH)6SO4nanobelts and CuO nanoleaflets by hydrothermal method [J]. Journal of Salt Lake Research, 2007,15(3):51-55.
[13] Li N, Wang P, Zuo C, et al. Microwave-enhanced Fenton process for DMSO-containing wastewater [J]. Environmental Engineering Science, 2010,27(3):271-280.
[14] Bradu C, Frunza L, Mihalche L, et al. Removal of reactive black 5azo dye from aqueous solutions by catalytic oxidation using CuO/Al2O3and NiO/Al2O3[J]. Applied Catalysis BEnvironmental, 2010,96(3/4): 548-556.
[15] Zhang G Q, Zhang S A, Zhao S, et al. Oxidative degradation of azo dye by hydrogen peroxide electrogenerated in situ on anthraquinonemonosul- phonate/polypyrrole composite cathode with heterogeneous CuO/gamma-Al2O3catalyst [J]. Applied Catalysis B-Environmental, 2011,106(3/4):370-378.
[16] Zhong X, Barbier J, Duprez D, et al. Modulating the copper oxide morphology and accessibility by using micro-/mesoporous SBA-15structures as host support: Effect on the activity for the CWPO of phenol reaction [J]. Applied Catalysis BEnvironmental, 2011,121: 123-134.
[17] Oturan M A, Peiroten J, Chartrin P, et al. Complete destruction of p-nitrophenol in aqueous medium by electro-Fenton method [J]. Environmental Science & Technology, 2000,34(16):3474-3479.
[18] Yang L X, Luo S L, Li Y, et al. High Efficient Photocatalytic Degradation of p-Nitrophenol on a Unique Cu2O/TiO2p-n Heterojunction Network Catalyst [J]. Environmental Science and Technology, 2010,44(19):7641-7646.
Treatment of p-nitrophenol in water by Fenton-like reaction with microwave coupling.
PAN Wei-qian1, ZHANG
Guang-shan1, ZHENG Tong1, ZHANG Jie1, WANG Peng1,2*(1.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China;2.State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2012,34(12):3112~3118
In order to avoid the narrow pH range in the traditional Fenton process, the CuO catalyst was synthesized and used in the microwave-assisted Fenton-like process to remove the p-Nitrophenol (PNP), which is harmful to the environment and difficultly biodegradable. The effects of the H2O2dosage, CuO dosage, microwave power, irradiation time, and initial pH on the degradation of PNP were investigated in detail. The optimal values of operating parameters were found at a H2O2concentration of 0.06mol/L, a CuO concentration of 0.3g/L, a microwave power of 125W, and a pH of about 6without adjusting the initial pH. Under the optimal conditions, the removal efficient of PNP reached 92% and the TOC removal was 63% after 6min of irradiation when the initial concentration of PNP was 50mg/L. Compared with the other oxidation processes, the microwave can enhance the ·OH production from the Fenton-like process, resulting in the improved removal efficiency of PNP. As a new kind of Fenton-like process, the microwave-assisted one using the CuO catalyst can overcome the limitation of the narrow pH range in the traditional Fenton reaction, and broaden the application of the Fenton process in wastewater treatment.
Fenton-like;microwave;PNP;CuO
X703.1
A
1000-6923(2014)12-3112-07
潘维倩(1984-),女,云南巧家人,哈尔滨工业大学博士研究生,主要从事微波强化高级氧化研究.发表论文8篇.
2014-03-24
国家创新团队基金资助项目(51121062);国家水体污染控制与治理科技重大专项(2012ZX07205-005)
* 责任作者, 教授, pwang73@vip.sina.com

