藠头组培快繁技术研究
李 佳,黄凯敏,郭 涛
(武汉轻工大学生物与制药工程学院,湖北武汉430023)
藠头(Allium chinensis G.Don)又名薤或荞头,是百合科(Liliaceae)葱属(Allium)草本植物,适应性广,抗逆性强,在我国种植已有3700多年的历史。藠头具有多种药理作用[1-8]。据《本草纲目》记载,藠头辛、温、滑、无毒,主治金疮败毒,有轻身、不饥、耐劳之功效,还能预防多种疾病;同时,薤白对提高机体免疫功能,对抗免疫损伤及丰富餐桌食品都具有一定意义[2],是现代绿色保健食品之一,被誉为“菜中灵芝”;曾有报道提出藠头中活性成分有抑癌作用[3-6],有研究表明,藠头所含有的 DADS,对实验动物的结肠癌、皮肤癌[5]、肝癌[6]、乳腺癌[7]和肺癌[8]等都具有明显的抑制作用。藠头在日本、新加坡、韩国、马来西亚等国备受青睐,其加工后的价值呈几倍甚至几十倍地增加。湖北省武汉市江夏区梁子湖地区是我国的藠头之乡,有着800多年的种植历史,经加工后的产品出口10多个国家和地区,已成为日本、韩国等国家饮食的必备品,市场逐年稳步上升。
然而,藠头在组织培养方面的研究目前还很少[9,10],对该种植物组培中存在的各种问题还没有深入的研究报道,在培养过程中的培养条件的研究还是空白。本文的研究意义就在于对藠头在组织培养过程中,培养基配方及培养的光照条件对其的影响,并对这些条件进行优化,以得到最佳的培养条件,为该植物的组织培养及品种改良提供实验依据。
1 材料与方法
1.1 材料
所用材料为藠头(A.chinensis G.Don),材料来源为田间采集。
1.2 主要仪器设备
高压蒸汽灭菌锅、超净工作台、光照恒温培养箱等。
1.3 外植体的制备与接种
取藠头的鳞茎部分,洗去表面尘土,自来水冲洗3 h左右,软毛刷刷洗,75%酒精浸泡20 s,0.1%升汞浸泡10 min,无菌水冲洗3次,在超净工作台上操作,去根,将鳞茎部分去除外层鳞片,纵切,一分为二,进行接种。
1.4 培养基配方
不定芽诱导培养基采用MS基本培养基,附加不同浓度的6-BA、NAA和活性炭,另加3%蔗糖、0.7%琼脂粉,pH 值 5.8。
生根培养基采用1/2 MS基本培养基,附加0.1 mg/L NAA、1g/L活性炭,其它同上。
1.5 培养条件
培养过程在光照培养箱中进行,培养温度为25℃。
光照条件分3组进行,A组为24 h黑暗培养,B组光照周期为8 h光照,16 h黑暗培养,C组为16 h光照,8h黑暗培养。
1.6 炼苗移栽
将根系发达、生长良好的组培苗瓶转移至自然光照下,2 d后将瓶盖半开,4—5 d后,小心将组培苗取出,用清水洗净根系上的残余培养基,移栽入砂子:腐殖土(1∶1)的混合基质中,喷水保湿。注意炼苗期间防止阳光直射和基质过湿。
1.7 数据统计分析
诱导率=诱导出芽的外植体的数目/接种的外植体总数×100(%),不定芽平均数=诱导出芽的数目/诱导出芽的外植体数目(个)。数据采用正交实验直观分析或单因素LSD检验。
2 结果与分析
2.1 不同培养基配比对藠头不定芽诱导的影响
将藠头鳞茎纵切后,按照表1所示的正交设计实验,垂直接种在不同浓度配比的不定芽诱导培养基中,每个实验号接种10瓶,每瓶接种5块外植体,培养4—5 d即可见不定芽萌发,30 d后不定芽长势良好,实验数据经统计,结果如表1所示。实验表明不同外源激素浓度及活性炭的添加对藠头不定芽的诱导均有较大的影响。

表1 藠头不定芽诱导培养正交设计实验结果
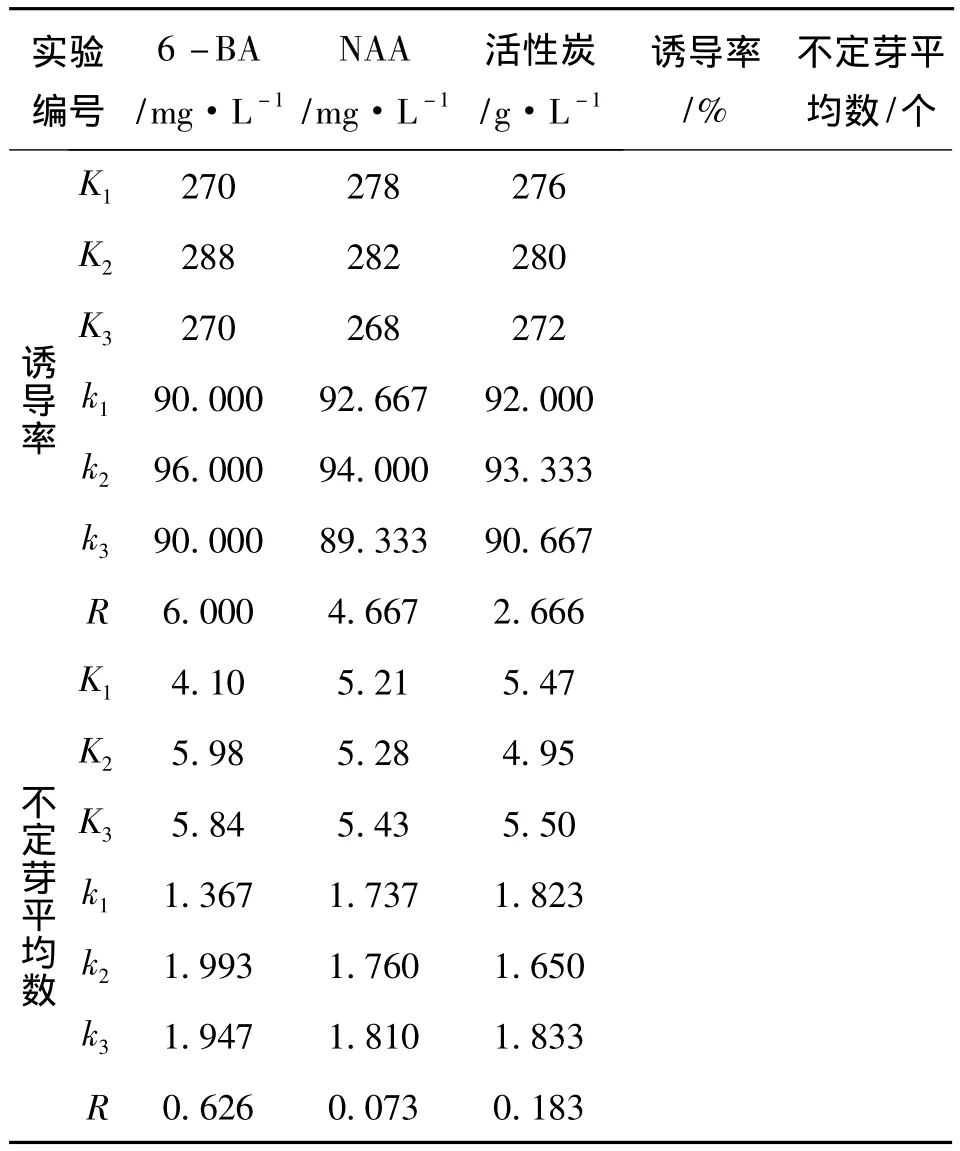
续表
2.1.1 6-BA对藠头不定芽诱导的影响
经过正交分析显示,不同浓度的6-BA对藠头不定芽的诱导率和不定芽平均值的影响极差分别为6.000和0.626,为三个影响因素中最大的,因此,6-BA的浓度变化水平对藠头不定芽的诱导起主导作用。比较k值,诱导率的作用效果值从大到小为k2>k1=k3,且数值上相差不大,均在90以上,我们在实验中也发现,只要操作规范,染菌情况控制好,外植体基本都能够诱导出不定芽(见图1)。
不定芽平均数的k值从大到小为k2>k3>k1,且差距较大,其中,当6-BA浓度为1.5 mg/L时,效果最好,诱导出的不定芽色泽嫩绿、芽多而粗壮(见图1b),而6-BA浓度为1.0 mg/L时,虽然大多也能诱导出芽,但数目少,且芽的色泽黄绿,形态纤细(见图1a),当6-BA浓度为2.0 mg/L时,芽的色泽暗绿,形态粗壮(见图1c)。因此,分析6-BA浓度的变化主要影响不定芽的数目和状态,对诱导率影响不大。
2.1.2 NAA对藠头不定芽诱导的影响
不同浓度的NAA对藠头不定芽诱导率的影响极差为4.667,在三个因素中排第二位,因此,NAA的添加对藠头不定芽诱导率同样有较大的影响,比较k值,诱导率的作用效果值从大到小为k2>k1>k3,其中k1和k2在数值上相差不大,因此认为,添加低浓度的NAA对不定芽的诱导更为有利,当NAA浓度增加时,不定芽诱导降低,且出现少量愈伤组织。
NAA对不定芽诱导平均数的影响极差为0.073,在三个因素中排最后,k值也相差不大,因此分析NAA的添加对不定芽数目的影响不大。
2.1.3 活性炭对藠头不定芽诱导的影响
不同浓度的活性炭对藠头不定芽诱导率的影响极差为2.666,在三个因素中排第三位,因此,活性炭的添加对藠头不定芽诱导率的影响最小,比较k值,诱导率的作用效果值从大到小为k2>k1>k3,三个数值相差不大,均在90以上。而对于不定芽平均数的影响极差为0.183,排在第二,比较k值,从大到小为k3>k1>k2。当不添加活性炭时,不定芽诱导情况良好,色泽嫩绿、形态纤细(见图2a),然而,随着培养时间的延长,芽的长势不佳,易褐化。当添加1mg/L活性炭时,不定芽长势良好,色泽嫩绿、形态粗壮(见图2b),然而芽的数目有所降低,可能是由于活性炭吸附了部分的营养物质,使得外植体营养吸收不足,但是,如果及时转接,则芽的生长良好。当添加2mg/L活性炭时,不定芽诱导数目较多,然而芽的状态不佳,均较为细弱,长势缓慢(见图2c)。

图2 添加不同浓度的活性炭对藠头不定芽诱导的影响
综合考虑以上结果,对藠头不定芽诱导的最佳培养基配方为MS培养基,附加1.5 mg/L 6-BA、0.1 mg/L NAA和1.0 g/L活性炭,经过验证实验,诱导率可达90%以上,不定芽平均数可达2.0以上,不定芽色泽嫩绿、形态粗壮。
2.2 光照条件对藠头不定芽诱导的影响
在固定6-BA、NAA和活性炭的浓度分别为1.0mg/L、0.1mg/L 和 1.0g/L 的情况下,我们对光照条件对藠头不定芽诱导的影响结果进行了单因素分析,结果见表2。
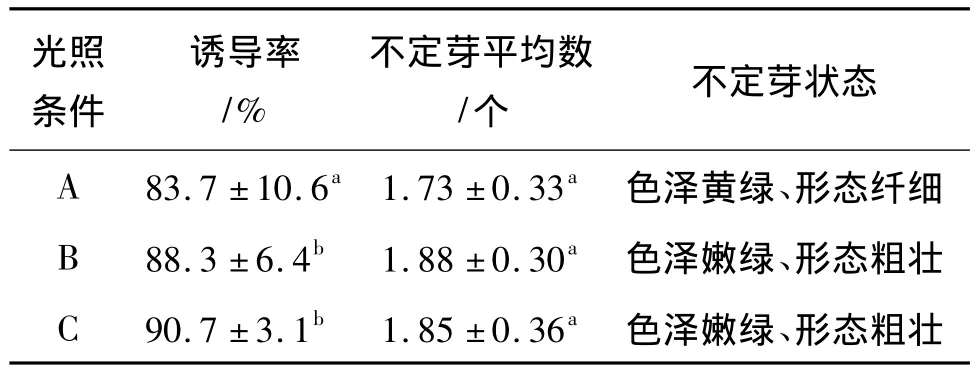
表2 光照条件对藠头不定芽诱导的影响
在暗培养和光照培养的不同条件下,外植体诱导率有显著性差异,光照培养的要高,说明光照可促进外植体芽的诱导,但不定芽平均数的结果,二者之间的差异不显著,而光照下,芽诱导率比暗培养下稍有提高。然而,在暗培养时,诱导出的不定芽色泽黄绿、形态细弱(见图3a),成活率不高。而在光照不足和光照充足的不同培养条件下,外植体诱导率和芽诱导率均无显著差异,然而,在弱光照下,芽的诱导率比强光照下要稍高些。然而,同时还观察到,在光照充足的条件下,再生芽的长势比较旺盛(见图3b)。

图3 光照条件对藠头不定芽诱导的影响
由于考虑到我们接种的藠头外植体是鳞茎,因此,我们在藠头的培养初期(48小时),采取暗培养,使之在与土壤中相似的暗条件下生长。48小时后,将其转到光照8小时/黑暗16小时下培养,4—5 d后即可诱导出较多的芽,大约一周后,将培养瓶转到光照16小时/黑暗8小时下培养,诱导出的芽在充足的光照下生长旺盛。
2.3 藠头不定芽生根培养及炼苗移栽
在培养30 d后,选取嫩绿、粗壮的不定芽,转接入生根培养基中诱导生根,5 d左右发现有根生成,15 d后,根生长良好,并有毛状根生成。此时,可将根系发达、生长良好的组培苗进行炼苗移栽,成活率可达90%左右。
3 讨论
正交设计实验结果显示,6-BA对藠头的不定芽影响最为显著,NAA的影响较小,说明细胞分裂素对藠头的芽的诱导起主导作用,然而应控制在一定的浓度下,浓度过高时,则芽的状态不佳,色泽暗沉,成活率不高,因此,选择适当的浓度是得到高质量芽的关键。
活性炭的添加对于不定芽的数目影响不大,而对诱导率有一定的影响,分析原因,可能是因为活性炭吸附了外植体分泌的一些毒性物质,可防止外植体褐化,同时可以模仿植物体自然的生长状态下的土壤环境,有利于不定芽的诱导。
光照条件对于藠头的不定芽诱导率有显著性的影响,当光照充足时,诱导率明显增加,然而,若培养初期光照过强或时间过长,则不定芽的状态较差,且较易褐化。有报道显示,在用光诱导器官形成时,并不要求很强的光,对多数植物来说,每天16 h的光照是适宜的[11]。因此,本研究采取以下方法,培养初期的48 h为黑暗培养,此时为不定芽诱导初始的关键时期,黑暗培养可有助于芽器官的形态建成,之后转到光照8 h/黑暗16 h下培养,此时的弱光照可起到光诱导的作用,使得芽的形态进一步形成,一周后,转到光照16h/黑暗8h下培养,长成的芽可在充足的光照下旺盛生长,采用此方法可诱导出质量较高的不定芽。
[1]谭可安,陈光荣.薤白的临床疗效观察[J].白求恩医科大学学报,1989,15(2):211.
[2]高敏,刘佳,吴克枫,等.野生薤白对小鼠免疫功能的影响[J].贵州医药,2004,28(10):932-933.
[3]怡悦.关于天然药物资源预防化学致癌的研究(II)[J].国外医学(中医药分册),1996,18(6):40.
[4]姜勇,王乃利,姚新生,等.薤中抗凝和抗癌活性成分的结构鉴定[J].药学学报,1998,33(5):355-361.
[5]Sadhana A S,Rao A R,Kucheria K,etal.Inhibitory action of garlicoilontheinitia-tionofbenzo[a]pyrene-inducedskin carcino genesis in mice[J].Cancerlett,1988,40:193-198.
[6]孙运军,柏建山,陈宇,等.藠头中抗菌活性成分的抑癌作用及机理研究[J].食品科学,2004,25(11):295-299.
[7]Schaffer EM,Liu JZ,Green J,et al.Garlic and associated allyl sulfur components inhibit N-methyl-N-nitrosourea induced ratmammary carcinogenesis[J].Cancer Lett,1996,102:199-206.
[8]Hong JY,Wang ZY,Smith TJ,etal.Inhibitory effects of diallyl sulfide on the metabolism and tumori-genicity of the tobacco-specific carcinogen 4-(methyl-lnitrosamino)-1-(3-pyridyl)-1-butanone(NNK)in A/Jmouse lung[J].Carcinogenesis,1992,13:901-912.
[9]黄钊,向长萍.藠头脱毒快繁技术研究初报[J].长江蔬菜,2006,(2):40-41.
[10]傅德明,余宏斌,付琼玲,等.藠头一步成苗组培快繁技术研究[J].中国种业,2006,(6):39-40.
[11]黄学林,李筱菊.高等植物组织离体培养的形态建成及其调控[M].北京:科学出版社,1995.

