人A组轮状病毒结构蛋白VP7原核表达及其卵黄抗体效价的研究
李丙超,李再新,胡卫东,黄永生,唐文才,张 智
(1.四川理工学院 a.生物工程学院;b.化学与制药工程学院,四川 自贡 643000;2.富顺县人民医院,四川 自贡 643000)
引 言
轮状病毒属于呼肠孤病毒科轮状病毒属,其中人A组轮状病毒是引起婴幼儿急性胃肠炎的最主要病原体,可造成严重脱水甚至危及生命。全球每年约有1.4亿人发生轮状病毒腹泻,并导致大约80万儿童死亡[1]。人A组轮状病毒为双链RNA病毒,含有11个分节段的基因片段,共有 6 种结构蛋白(VPl,VP2,VP3,VP4,VP6,VP7)和5 种非结构蛋白(NSPI,NSP2,NSP3,NSP4,NSPS)[2]。其中轮状病毒VP7蛋白是该病毒的一个重要的结构蛋白,在激发机体体液免疫产生特异性抗体方面发挥极为重要的作用[3]。为此,本研究拟通过原核表达获得轮状病毒VP7的重组抗原,将纯化的重组抗原免疫产蛋鸡,进一步应用水稀释-盐析法提取分离高效价含抗VP7的卵黄抗体,为轮状病毒感染性腹泻的靶向性药物研发奠定基础。
1 材料和方法
1.1 材料与试剂
基因工程菌株E.coli DH5α和E.coli BL21(DE3),以及原核表达质粒pET28a(+)均为四川理工学院化学制药实验室保存。含野生型A组轮状病毒(诊断为G4血清型),粪便样品和对照样品均由自贡某医院提供。T4 DNA连接酶购于NEB公司;E×Taq DNA聚合酶、限制性核酸内切酶EcoR I和Xho I等购于TaKaRa公司;DNA片段回收试剂盒和质粒抽提试剂盒购于北京博大泰克公司;HRP标记的兔抗鸡IgY、弗氏完全佐剂、弗氏不完全佐购于Sigma公司;Bradford蛋白定量试剂盒购于Bio-rad公司;其余试剂均为国产分析纯。含VP7全长序列的模板由北京中科院微生物研究所陈晓英老师提供(来源于A组轮状病毒株T114)。海蓝褐蛋鸡,湖北省宜昌市种鸡厂购买。
1.2 方法
1.2.1 引物设计及合成
参考GenBank中A组轮状病毒VP7的DNA序列,根据提供的VP7序列设计VP7原核表达引物,在一对引物的5'端加上EcoRI和XhoI酶切位点,VP7扩增引物序列如下(下划线者为酶切位点):
上游引物:5'-CCGGAATTCTTGCCAATTACTGGATCTAT-3';下游引物:5'-CCGCTCGAGCATTCGTTCTGTTTGTGGA-3'。为保证酶切效率,酶切位点前加上了保护碱基。引物由深圳华大基因公司合成,预期扩增片段长度约为730 bp。
1.2.2 VP7的PCR扩增与原核及真核表达载体构建
取5 ngVP7全长DNA序列作为模板,PCR扩增VP7基因,扩增条件为:变性94℃ 45 s;退火53℃ 35 s;延伸72℃ 1 min,共32个循环,凝胶电泳鉴定。将PCR产物按DNA片段回收试剂盒说明书进行回收,EcoR I和Xho I双酶切回收产物,与同样经过双酶切处理的原核表达载体pET28a(+)进行连接[4]。重组质粒命名为pET28a-VP7,按常规方法酶切及PCR鉴定重组质粒,进行基因测序。
1.2.3 VP7重组蛋白的诱导表达
将鉴定正确的重组质粒pET28a-VP7转化E.coli BL21(DE3)感受态细胞。将转化后的菌在LB固体平板培养基(含卡那霉素)过夜培养,次日挑取单菌落接种于3 mL含卡那霉素的LB液体培养基,于37℃,200 rpm振荡培养;过夜培养后,按1:200接种扩大培养,待菌液OD600值为0.6~0.8时加入终浓度为0.5 mM IPTG 诱导(同时设不加IPTG诱导或空载体相关对照),6 h后取样离心收集菌体,SDS-PAGE电泳分析。
1.2.4 包涵体蛋白的洗涤与复性
确定表达后,扩大菌体培养。离心收集菌体,用PBS重悬洗涤2次,按照菌体﹕裂解液体积比1∶10加入裂解缓冲液(包含溶菌酶浓度为10 mg/mL的PBS溶液),冰浴1 h,采用3次反复冻融法裂解菌体,12000 rpm离心5 min,收集包涵体沉淀。先用包含0.1%Triton的2 M尿素洗涤包涵体沉淀一次,12000 rpm离心10 min,收集沉淀用2 M尿素洗涤包涵体2次;离心收集沉淀,并用含8 M尿素的0.05 M Tris缓冲液(pH 8.0)按照50∶1包涵体体积比溶解包涵体20 min;12000 rpm离心10 min,收集上清液按照50:1体积比进行尿素梯度透析复性。初始透析液为含5 M尿素的Tris缓冲液(Tris缓冲液配方:pH 8.1,50 mM Tris,0.5 mM EDTA,50 mM NaCL,5%甘油,1%Gly)。然后逐步透析复性:弃1/5体积透析液,加入新的等体积透析液,透析4 h,共透析6次;最后用PBS透析2 h,2次。12000 rpm离心10 min,收集上清液,并应用Bradford法和SDS-PAGE对复性的重组蛋白进行检测分析。
1.2.5 免疫产蛋鸡
使用考马斯亮蓝G-250法测定纯化蛋白浓度,适当调节蛋白浓度,初次免疫时使用完全弗氏佐剂与纯化VP7重组抗原完全混匀并充分乳化,每只鸡免疫量为400 μg。分别于初次免疫后第2、4周加强免疫,加强免疫时使用不完全弗氏佐剂,免疫剂量为250 μg,每次免疫均采用三点肌肉注射免疫。初次免疫一周后每周收集鸡蛋一次,4℃保存备用。
1.2.6 卵黄抗体提取
将蛋清与蛋黄分离,将蛋黄上蛋清液去除干净;按照卵黄﹕超纯水为1:7(V/V)比例用超纯水稀释卵黄液,混匀。用冰醋酸调节卵黄稀释液pH至5.0,4℃静置6 h或过夜;次日4℃下10000 rpm离心15 min。收集上清液,缓缓加入NaCl(终浓度为8.8%),调节PH至4,4℃静置2 h;4℃下10000 rpm离心15 min,收集沉淀;沉淀中加入50 mL 30%(NH4)2SO4重悬,静置2 h;10000 rpm低温离心15 min,收集沉淀,用超纯水溶解。然后将溶液装入透析袋用超纯水透析8 h,并每2 h换水一次。将透析后的溶液在4℃下10000 rpm离心15 min,收集上清液进行冷冻干燥,即为纯化的IgY抗体成品,并按Bradford法进行蛋白定量。
1.2.7 ELISA 分析 IgY 滴度
将纯化的VP7重组蛋白用包被液稀释至1 mg/mL,ELISA板每孔包被100 μL,4℃过夜;PBST洗板3次后加入终浓度为5 mg/mL的BSA溶液,每孔100 μL,室温封闭2 h;PBST洗板3次后加入不同稀释倍数的纯化IgY(1∶100~1∶200000),室温孵育2 h;PBST 洗板4次,加入1∶10000稀释的辣根过氧化物酶(HRP)标记的羊抗鸡IgY(100 μL/孔),37℃孵育2 h;PBST洗板3次,加 TMB(100 μL/孔)显色,37 ℃避光作用10 min;每孔加入100 μL 4 mol/L H2SO4终止液终止反应;酶标自动分析仪450 nm波长测定其光吸收值(OD450)。实验中设相应对照,吸光度OD值2倍以上为阳性标准,测定抗体滴度。
1.2.8 SDS-PAGE 分析 IgY 抗体
分别取5 μg的IgY于2个EP管中,分别加入变性和非变性的蛋白电泳上样缓冲液,通过SDS-PAGE电泳检测IgY纯度;并应用Bradford法对IgY进行蛋白定量分析。
1.2.9 Dot blot点杂交
将含野生型A组轮状病毒粪便粗提液(诊断为G4血清型)和对照腹泻粪便粗提液(诊断为非轮状病毒腹泻),用PBS溶液按10倍倍比稀释粗提液,并用微量加样器点1 uL于NC膜上,置37℃恒温箱2 h。5%BSA室温摇床上封闭2 h,将纯化的VP7重组蛋白进行SDS-PAGE凝胶电泳,利用蛋白电转移系统将蛋白转至NC膜,5%BSA室温摇床上封闭2 h,加纯化的IgY抗体作一抗(1∶1000),室温作用2 h或4℃过夜,TBST洗涤3次,每次10 min,加入1∶10000稀释的二抗(HRP标记的羊抗鸡IgY),室温作用90 min,TBST洗涤3次,每次10 min,DAB 显色。
2 结果
2.1 VP7的PCR扩增及其重组质粒的鉴定
经VP7序列特异性引物PCR扩增后,出现约为0.73 kb片段(图1),大小与预期相符。将VP7克隆到pET28a载体上形成重组质粒pET28a-VP7,将重组质粒基因测序,测序结果与预期结果一致。

图1 VP7基因PCR扩增
2.2 VP7重组蛋白的诱导表达与包涵体处理
将鉴定正确的重组质粒pET28a-VP7转化E.coli BL21(DE3),0.5 mM IPTG 诱导,SDS-PAGE 结果表明,特异表达出约33 kD的融合蛋白(图2A),大小与预期的融合VP7蛋白相符;且在30℃ ~37℃条件下VP7主要以包涵体形式表达。收集包涵体,通过对包涵体的洗涤和梯度透析复性,包涵体复性回收效率达到90%;将回收的VP7分别经透析粗纯化及Ni-柱细纯化后能得到纯度较高的VP7;经过SDS-PAGE检测结果表明最后得到了纯度较高的VP7重组蛋白(图2B)。
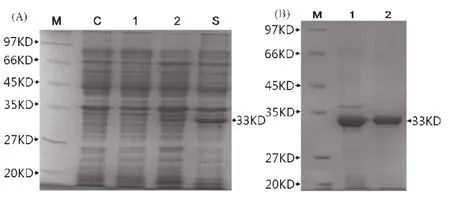
图2 VP7重组蛋白的诱导表达和纯化
2.3 卵黄抗体(IgY)的提取与纯化
按水稀释法粗提的卵黄抗体IgY,SDS-PAGE电泳发现,所提取的IgY水粗提取液(WSF)中含有大量杂蛋白;WSF再经过(NH4)2SO4盐析和超滤纯化后,其纯度提高。在非还原状态下,IgY分子量为170 kDa左右,电泳结果显示为一条170 kDa左右的特征性条带(图3);在还原状态下,电泳结果表明在65 kDa及25 kDa处可见清晰的2条特征性条带,分别是 IgY的重链和轻链(图3)。最后定量结果表明,卵黄抗体IgY的产量可达8 mg/mL蛋黄,纯度可达90%。

图3 卵黄抗体(IgY)SDS-PAGE电泳图
2.4 Anti-VP7 IgY的滴度分析
用间接ELISA方法检VP7特异性IgY的抗体效价变化规律。如图4所示,蛋鸡初免约1周后蛋黄中可检测到特异性卵黄抗体,加强免疫后特异性IgY效价呈明显的增长趋势,第二次加强免疫后抗体滴度上升达到较高水平,抗体滴度可达1∶100000。并且在两次加强免疫后IgY能在较长的时间内保持较高的滴度。

图4 抗VP7卵黄抗体的动态特征
2.5 Dot blot点杂交
以纯化的IgY作为一抗分析该卵黄抗体识别和结合病毒的能力。结果如图5所示,将含病毒粗提液稀释到100倍时,制备的Anti-VP7 IgY亦能检测到较强信号,而对照样品检测不到信号。表明免疫获得的IgY抗体具有识别和结合病毒抗原的活性。

图5 anti-VP7 IgY点杂交结果
3 讨论
人A组RV衣壳蛋白VP7是一种能够结合钙离子的糖蛋白,通过低钙作用诱导病毒颗粒从三层同心圆的衣壳蛋白包被向二层同心圆衣壳蛋白包被转化[5],与细胞表面的整合素受体 α2β1 和 α4β1 结合,使RV黏附、进入细胞[6]。因此,将 VP7作为药靶通过其抗体结合抑制RV病毒颗粒转化和细胞黏附,抑制RV对婴幼儿小肠绒毛的感染是理想的选择之一。虽然RV灭活疫苗已在澳大利亚、墨西哥和巴西使用,但后续临床观察表明此疫苗与发生肠套叠相关而停止[7]。在发展中国家,可能是区域内婴幼儿遗传、免疫发育和身体健康状况等差异,临床试验也未得到理想的效果,RV感染性腹泻时常反复发生,造成该疫苗在发展中国家和地区难以得到普及,限制了疫苗对RV引起腹泻的预防[7-10]。
卵黄抗体(IgY)及其鸡蛋易获得、不能激活补体和胃肠道细胞Fc段受体、对人体无毒副作用和可以阻止胃肠道病毒感染的优点,现已成为消化道感染的一种很有前途的候选药物。相对于常规治疗,口服抗RV抗体均能显著缩短患儿的病程,提高抗RV的能力[11-13],但是临床上在国内一直缺乏针对人RV高效价卵黄抗体的应用。目前的抗RV卵黄抗体,均以分离的RV全毒株为免疫原,免疫产蛋鸡获得卵黄抗体,但该抗体效价低(试验结果待发表),制备过程需要RV病毒培养、纯化和灭活等过程,且制备过程技术要求高、灭活不彻底、散毒和病毒残存等风险,如葛兰素史克GSK公司生产的疫苗Rotarix因被检出动物病毒污染而于2010年被迫暂停使用。相对于已有人A组RV卵黄抗体的制备方法,本文以人A组RV的VP7为靶点,通过基因工程技术实现了VP7重组抗原在基因工程菌中的大量表达,并纯化出VP7重组抗原,进而免疫产蛋鸡,制备了成本低、滴度高、稳定性好且能特异性识别和结合野生型人A组RV的IgY卵黄抗体,为后期开展轮状病毒感染性腹泻的诊断、治疗和预防用口服抗体药物制剂的开发奠定了基础。
[1] Vesikari T.Rotavirus vaccination:a concise review[J].Clin Microbiol Infect,2012,18(5):1-7.
[2] Patton J T.Structure and function of the rotavirus RNA-binding proteins[J].J Gen Virol,1995,76(11):2633-2644.
[3] Pesavento J B,Crawford S E,Estes M K,et al.Rotavirus proteins:structure and assembly[J].Curr Top Microbiol Immunol,2006,309:189-219.
[4]姜琳琳,张孝云,马 莉,等.基因工程抗体抗CD19(Fab)LDM的制备及生物学活性研究[J].中国药理学通报,2013,10:1363-1368.
[5] Ludert J E,Ruiz M C,Hidalgo C,et al.Antibodies to rotavirus outer-capsid glycoprotein VP7 neutralize infectivity by inhibiting virion decapsidation[J].J Virol,2002,76:6643-6651.
[6] Zárate S,Romero P,Espinosa R,et al.VP7 Mediates the Interaction of Rotaviruses with Integrin αvβ3 through a Novel Integrin-Binding Site[J].J Virol,2004,78:10839-10847.
[7]江保明,杨晓明,徐德启.轮状病毒疫苗的现状和发展动向[J].中国生物制品学杂志,2012(2):251-253.
[8] Niraj C,Patel M D,Paula M,et al.Vaccine-acquired rotavirus in infants with severe combined immunodeficiency[J].N Engl J Med,2010,362:314-319.
[9] Patel M M,Steele D,Gentsch J R,et al.Real-world impact of rotavirus vaccination[J].Pediatr Infect Dis J,2011,30:1-5.
[10] Vesikari T.Rotavirus vaccination:a concise review[J].Clin Microbiol Infect,2012,18(5):57-63.
[11] Liu Y,Huang P,Tan M,et al.Rotavirus VP8:Phylogeny,host range,and interaction with histo-blood group antigens[J].JVI,2012,18:9899-9910.
[12]陈六英,黄雄七,胡永红,等.抗A组轮状病毒鸡卵黄免疫球蛋白的临床评价[J].中国实用儿科杂志,1998,13:225-226.
[13] Rahman S,Higo M K,Htun K W,et al.Randomized placebo-controlled clinical trial of immunoglobulin Y as adjunct to standard supportive therapy for rotavirus-associated diarrhea among pediatric patients[J].Vaccine,2012,30(31):4661-4669.

