非梗阻性不育患者精子超微结构的研究
葛少钦王 然郭明申刘淑卓殷慧颖
1. 河北大学基础医学院(保定 071000); 2. 河北大学生命科学学院; 3. 河北大学附属医院
·研究简报·
非梗阻性不育患者精子超微结构的研究
葛少钦1王 然1郭明申2刘淑卓3殷慧颖1
1. 河北大学基础医学院(保定 071000); 2. 河北大学生命科学学院; 3. 河北大学附属医院
当今社会中不孕不育夫妇数量正逐步增加[1]。据统计,全世界大约有15%~20%的育龄夫妇存在生育障碍,其中男性原因导致不育的比例占40%~50%[2]。
精子形态异常、精子畸形率增加是导致男性不育的重要原因[3]。近几年来研究发现不育男性精子不仅存在光镜形态学异常,而且精子的超微结构也发生了病理性改变。鉴于诸多精子超微结构研究过程中,存在精子超微结构特征描述不系统、不同形态精子超微结构描述不全面等问题,本文利用透射电镜技术对临床非梗阻性不育患者精液精子进行观察,努力发现患者不同形态精子超微结构的细微缺陷,在精子超微结构水平分析患者不育原因,预测男性潜在的生育能力,从而指导临床诊断,为病人选择最佳的治疗方案[4]。
材料与方法
一、受试对象
受试对象为结婚2年,女方生殖系统功能正常,非梗阻性男性不育患者6例,按男性病实验诊断标准检测;正常对照组为结婚2年,孕育有孩子,正常生育男性3例。
二、标本采集和处理
禁欲一周后,在室温25~30℃的实验室内,由供精者按摩取精。待精液自动液化后,缓慢注入离心管中,以1 850×g,离心10min,用吸管轻轻吸出精浆,沉淀精子用琼脂糖进行预包埋,戊二醛固定液固定1h后,PBS缓冲液(pH=7.2)洗涤3次,每次10min,锇酸固定1h,然后用Epon812环氧树脂包埋,半薄切片用甲苯胺蓝染色,光镜下进行半薄定位,切超薄切片用铅铀双染,透射电镜下观察。
三、观察指标
透射电镜下主要观察精子的质膜、顶体、精子核、精子颈部、线粒体和微管等病理性改变。
结 果
通过透射电镜观察,正常精子的质膜和顶体双层膜结构完整清晰(图1A、图1B),精子核呈梨状形,核染色质电子密度均匀一致,尾部线粒体大小形态一致,排列规律(图1C),精子尾部微管9+2结构完好(图1D)。
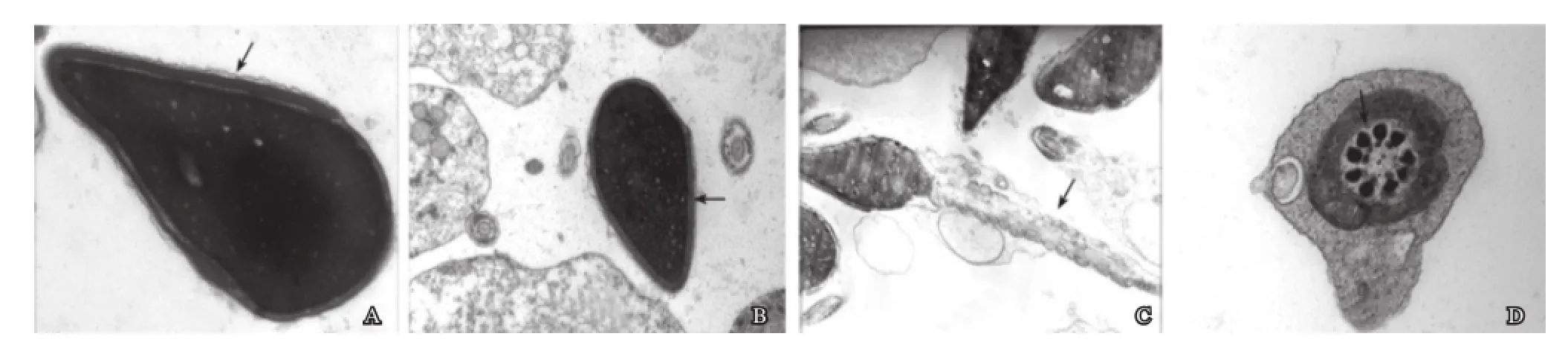
图1 正常形态精子的超微结构
在这6例男性不育患者的精液中几乎都可见精子超微结构不同程度的结构异常,正常精子极其少见。畸形精子不仅仅是存在一种病变,大多数是多种结构异常并存。
一、质膜的异常
患者精子质膜大多出现了病变,表面粗糙。质膜边缘可与顶体前膜融合变得模糊不清(图2A),质膜肿胀破损(图2B),多处出现大小不等的囊泡(图2C)甚至质膜缺失(图2D)等。
二、顶体的异常
有些精子顶体肿胀变形及产生褶皱,顶体双层膜结构可呈不平行或波浪状改变(图3A),外膜弯曲和不连贯,严重者顶体内外层膜破损,内容物溢出,有些顶体内容物疏松呈低电子密度(图3B),顶体后环部分缺失(图3C),顶体边缘卷曲,顶体下间隙增大,远离精子核(图3D)等。
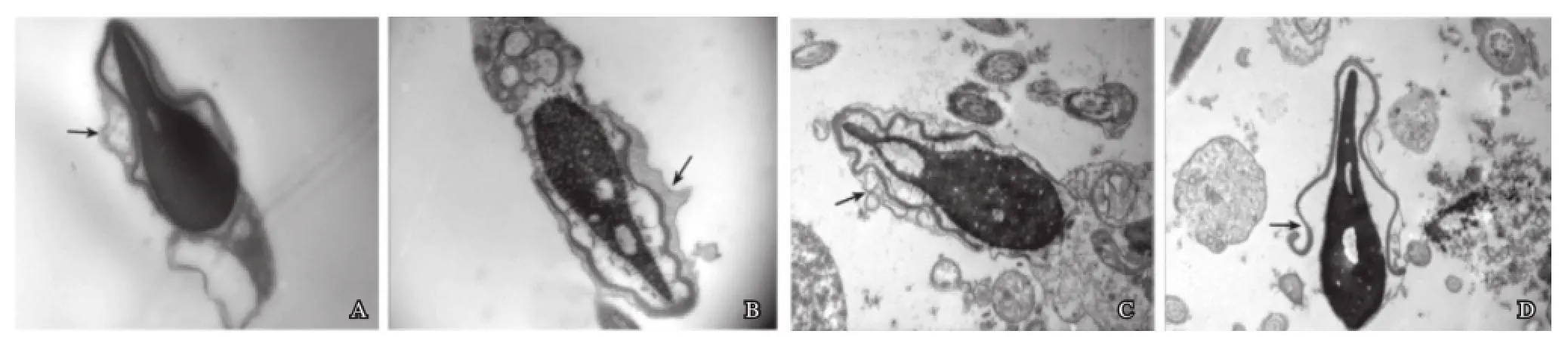
图2 精子质膜的异常
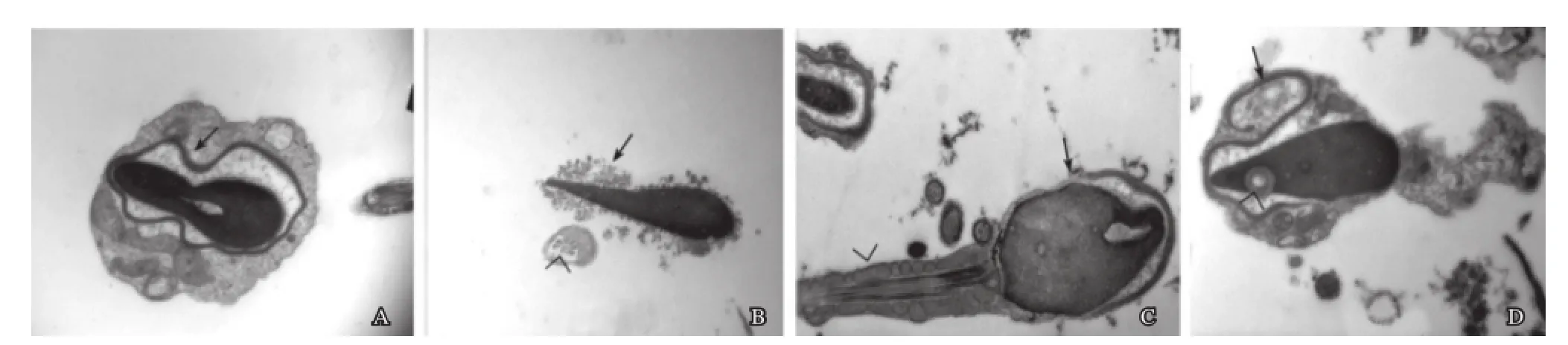
图3 精子顶体的异常
三、精子核的异常
精子核异常的精子经常表现为头部形态的异常,在本例患者中锥形头畸变精子居多(图4A)。核浓缩异常,电子密度增高,核周出现囊性空泡,空泡与顶体内膜相融合(图4C),个别精子细胞核出现巨型空泡(图4B),空泡间有膜性结构(图4D)。另外,在观察到的未发育成熟精子中可见未分离的多核精子(图5A)。
四、精子颈部的异常
头部畸形的精子伴有颈部变形肿胀,存在胞质小滴(图5B)等。
五、线粒体的异常
多数精子可见其尾部轴丝两侧的线粒体数减少,线粒体分布不均,大小不一,疏密不均(图3C、图5C);不育患者精子线粒体肿胀变形,严重肿胀的线粒体发生线粒体内空泡化,形成微囊,囊内可见高电子密度膜状物(图5D);出现双层或三层重叠线粒体围绕于轴丝(图6A、图6B)等。
六、微管异常
尾部横断面见微管系统错位,模糊不清,有些微管与纤维鞘融合呈高电子密度,轴丝异常2+9结构紊乱异常,周围微管或中央微观有缺失(图3B、图6C、图6D)等。
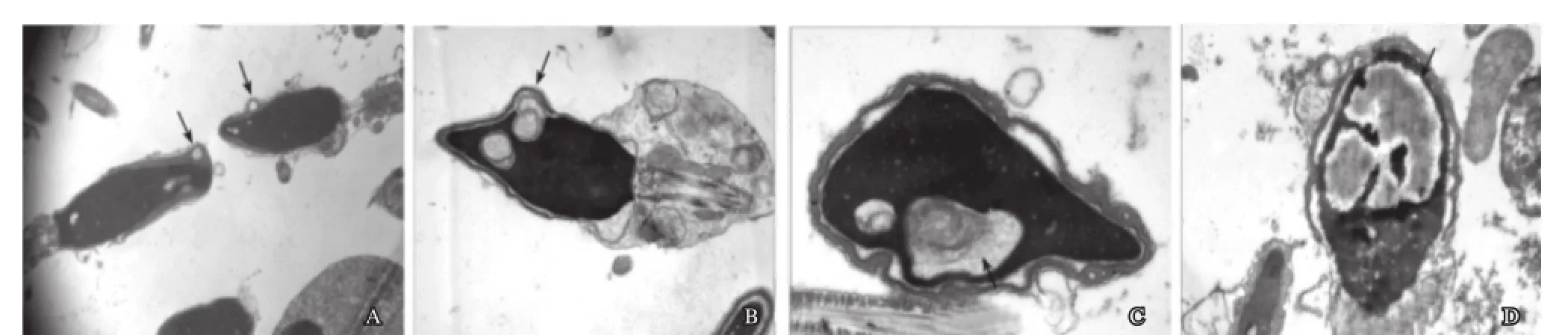
图4 精子核的异常
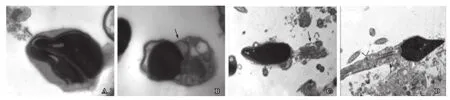
图5 精子核、颈部及线粒体的异常
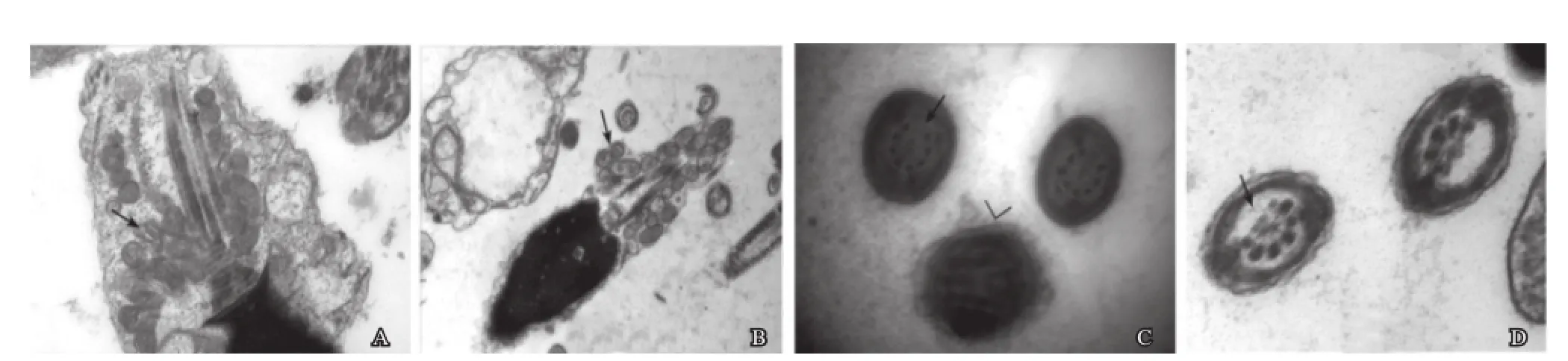
图6 精子线粒体、微观的异常
讨 论
通过电镜与正常生育男性精液中精子的形态相比较,发现非梗阻性不育患者精液精子以锥形头居多,且超微结构几乎都有不同程度的损伤,这与常规精液检查中其精子畸形率偏高相一致。更值得注意的是,畸形精子不仅仅是存在一种病变,大多数是多种结构异常并存,而发生单一病变者比较少见。精子结构的正常是保证受孕的基础,严重头部畸形精子可导致低受精率、着床率和妊娠率[5],精子超微结构的异常与男性不育密不可分。精子的质膜、顶体、精子核、线粒体、微管等任何一个结构发生病变都将会影响受精。
完整的质膜在把信息从精子外传到精子内的过程中,起着重要作用。一般认为精子头的前半部分精子膜参与顶体反应,顶体后区的精子膜能识别卵子,并能与卵子的细胞膜相结合。电镜下观察到的质膜的肿胀、破损、缺失等病变(图2A~图 2D),会影响精子受精。
顶体在受精过程中扮演着非常重要的角色,它是一种特化的溶酶体,内含多种酶类如透明质酸酶、乳酸脱氢酶等。当精子和卵细胞相遇时顶体通过小孔释放透明质酸酶,降低宫颈黏液的黏度,使精子能穿透卵细胞的放射冠和透明带进入细胞内,完成受精过程[6]。在电镜下观察到不育男性患者的一些精子在顶体结构方面受到严重损伤,精子顶体肿胀变形、内外膜破损严重(图3A、图3B),会使酶系统受到抑制,顶体丧失了正常生理功能。另外还发现有的精子顶体后环有部分缺失(图3C),顶体后环相应部分的精子膜有识别卵细胞膜的功能,并与之相融合,缺乏顶体后环,即使精子与卵细胞相遇也达不到受精的目的,这可能是导致该男性不育的又一重要原因。
精子核是遗传物质的所在地,对受精卵的发育是非常重要的。在电镜下可观察到患者的精子核增长,锥形头多见(图4A)。尽管精子核增长的机制尚未阐明,研究人员认为其有可能与染色体的异常,如染色质凝聚状态的改变、染色体的异倍性改变有关[7]。另外发现某些精子细胞核内有空泡形成(图4B~图4D),核内空泡是在染色质浓缩过程中形成,一般不会影响精子的受精能力,但是我们在电镜下发现病人精子核内出现巨型空泡(图4D),体积约占核的2/3,空泡体积增大可能是染色质正常排列发生明显畸变的结果,且被视为精子染色质成熟度和浓缩异常[8],可增加精子成熟障碍,影响精子的受精能力。
胞质小滴是生殖细胞胞浆残余物,大部分被睾丸支持细胞吞噬。在电镜下可观察到精子颈部肿胀,存有残留物(图5B)。过多残留物的存在与精子的不成熟特别是活性氧的产生有关[9],进而导致精子DNA损伤、内分泌激素异常和畸形精子的生成[10,11],可导致精子功能下降,引起男性不育。
线粒体的功能是通过氧化磷酸化合成ATP,为精子的运动提供能量,在电镜下可观察到患者的精子的线粒体排列不均,大小不一,发生肿胀变形、空泡样等病变(图5C、图5D、图6A和图6B)。当精子线粒体发生异常后,将影响线粒体内ATP能量的合成和线粒体自身复制的正确性,同时伴随着各种能量代谢酶的改变,如琥珀酸脱氢酶、细胞色素氧化酶等含量的改变,导致精子能量正常供应受影响,精子活动力减弱,进一步影响精子的存活[12],另有研究表明缺乏活动力的精子其受孕率仅21%[13],因此认为线粒体的异常是影响男性不育的主要原因之一。
微管通过肌动蛋白和肌球蛋白的滑动来操控精子尾部运动[14],微管是精子运动的物质基础,可为精子提供动力,保证精子能顺利到达受孕处。在电镜下可观察到不育患者的精子微管存在损伤、缺失,尾部横断面可以清晰可见9+2结构有缺失,微管系统模糊不清(图3B、图6C图和图6D),这会导致精子运动能力不足,这也是男性不育的一个重要原因[15]。
总之,男性不育与精子的超微结构的改变密切相关,本实验对非梗阻性男性不育患者精液进行电镜观察,与正常生育男性精液进行比较,结果显示男性不育患者精子超微结构存在多处病变,表明精子超微结构异常系非梗阻性男性不育原因之一。
目前临床不育检查以精液常规检查结果为主,在光镜下观察,仅对精子的形态进行分类,只能对精子质量有大致了解,通过电镜的观察,能了解精子内部许多亚细胞结构的变化与缺陷,可进一步分析不育患者的成因,因此电镜是目前精子形态学检测最客观可信的依据[16]。通过电镜观察精子的超微结构,不仅有助于结束患者长期盲目的不育治疗和检查,提高临床诊断和治疗的水平,而且还能为精子内部超微结构的变化与男性生育力强弱间的关系提供基础理论依据[17]。
男性不育; 精子/超微结构
1 Marchesi DE, Feng HL. Sperm DNA integrity from sperm to egg.J Androl2007; 28(4): 481-489
2 朱健生, 季钢, 张玲, 等. 卵胞浆内单精子显微注射技术在男性不育症中的临床应用. 中国优生与遗传杂志2008; 16(9): 106-107
3 Yu JJ, Xu YM. Ultrastructural defects of acrosome in infertile men.Arch Androl2004; 50(6): 405-409
4 王贺, 周亮, 石敏, 等. 不育男性精子形态与体外受精妊娠结局的相关性研究. 中国男科学杂志 2012; 26(1): 23-26
5 Lo Monte G, Murisier F, Piva I,et al. Focus on intracytoplasmic morphologically selected sperm injection (IMSI): a mini-review.Asian J Androl2013; 15(5): 608-615
6 黄宇烽, 许瑞吉主编. 男科诊断学. 上海第二军医大学出版社, 1999; 153-240
7 Siddighi S, Patton WC, Jacobson JD,et al. Correlation of sperm parameters with apoptosis assessed by dual f uorescence DNA integrity assay.Arch Androl2004; 50(4): 311-314
8 Celik-Ozenci C, Sahin Z, Ustunel I,et al. The Fas system may have a role in male reproduction.Fertil Steril2006; 85 Suppl 1: 1168-1178
9 Novotny J, Oborna I, Brezinova J,et al. The occurrence of reactive oxygen species in the semen of males from infertile couples.Biomed PaP Med Fac Univ Palacky Olomouc Czech Repub2003; 147(2): 173-176
10 Cooper TG. Cytoplasmic droplets: the good, the bad or just confusing.Hum Reprod2005; 20(1): 9-11
11 Rago V, Bilinska B, Palma A,et al. Evidence of aromatase localization in cytoplasmic droplet of human immature ejaculated spermatozoa.Folia Histochem Cytobiol2003; 41(1): 23-27
12 Allen JF. Separate sexes and the mitochondrial theory of aging.J Theor Biol1996; 180(2): 135-140
13 Nagy ZP, Verheyen G, Tournaye H,et al. Special applications of intracytoplasmic sperm injection: the inf uence of sperm count, motility, morphology, source and sperm antibody on the out come of ICSI.Hum Reprod1998; 13 Suppl 1: 143-154
14 Gopalkrishnan K, Padwal V, Dsouza S,et al. Severe asthenozoospermia: a structural and functional study.Int J
15 Chemes HE, Olmedo SB, Carrere C,et al. Ultrastructural pathology of the sperm f agellum: association between f agellar pathology and fertility prognosis in severely asthenozoospermic men.Hum Reprod1998; 13(9): 2521-2526
16 Baccetti B, Collodel G, Piomboni P. Apoptosis in human ejaculated sperm cells (notulae seminologicae 9).J Submicrosc Cytol Pathol1996; 28 (4 ): 587-596
17 Chemes HE. Phenotypes of sperm pathology: genetic and acquired forms in infertile men.J Androl2000; 21(6): 799-808
(2013-10-28收稿)
10.3969/j.issn.1008-0848.2014.03.016
R 698.2

