Adv-HIF-1αmu转染内皮祖细胞对CXCL12表达影响的研究
赵 辉,刘丹平,齐 鑫,张解元,李 谌
辽宁医学院附属第一医院,辽宁锦州 121001
Adv-HIF-1αmu转染内皮祖细胞对CXCL12表达影响的研究
赵 辉,刘丹平,齐 鑫,张解元,李 谌
辽宁医学院附属第一医院,辽宁锦州 121001
目的研究转染低氧诱导因子1α突变型(hypoxia inducible factor 1αmu,HIF1αmu)后的外源性内皮祖细胞(endothelial progenitor cells,EPCs)中CXCL12的表达情况及对EPCs的影响。方法密度梯度离心结合差速贴壁法分离、培养EPCs并进行鉴定;以Adv-HIF-1αmu的最佳转染指数转染EPCs,获得含有目的基因处理的EPCs细胞,设为A组。B组为单纯转染Adv的EPCs。设未转染Adv-HIF-1αmu的EPCs为C组。Western Blot检测转染后的EPCs中HIF-1的表达,检测转染后的EPCs培养液上清液中的CXCL12浓度及其对外源性EPCs迁移的影响。结果密度梯度离心结合差速贴壁法获得的EPCs能够结合UEA-1和摄取ac-LDL,并具有成血管作用;转染Adv-HIF-1αmu的EPCs表达的HIF-1及CXCL12高于单纯转染Adv的EPCs及未转染Adv-HIF-1αmu的EPCs(P<0.05),且能诱导外源性EPCs的迁移。结论密度梯度离心结合差速贴壁法能够分离、培养符合特征的EPCs,转染Adv-HIF-1αmu的EPCs能够在常氧条件下高表达HIF-1及CXCL12,并诱导外源性EPCs的迁移。
内皮祖细胞;低氧诱导因子-1αmu;腺病毒;趋化因子CXCL12
内皮祖细胞(endothelial progenitor cells,EPCs)是一类来源于骨髓,存在于外周血循环中,在生长因子的作用下可分化为内皮细胞(endothelial cells,ECs)的前体细胞[1-2]。低氧诱导因子1(hypoxia inducible factor1,HIF1)是一种广泛存在于哺乳动物和人体内的在低氧条件下表达的转录因子,可促进血管再生和微血管形成,提高组织和细胞在缺血环境下的生存能力[3-5]。而HIF-1α被证明可以上调局部的趋化因子CXCL12[3],通过CXCL12/ CXCR4生物学轴的作用促进含有其受体CXCR4的EPCs的趋化及归巢作用并增强改善缺血能力[6-7]。因此,若两者能在缺血局部共同发挥作用,可以更好地促进局部血管形成,改善缺血部位的血运,促进恢复。但HIF-1α在常氧环境中极易降解失活,而经过PCR技术突变后在常氧环境中不被氧化且转录高表达活性[5],记作HIF1αmu。利用这一思路,我们将成功构建的能够在常氧条件下表达的突变体Adv-HIF1αmu转染EPCs,观察转染后EPCs内的CXCL12表达情况。
材料和方法
1 主要材料 1周龄雄兔1只,体质量310 g,由辽宁医学院动物实验中心提供、Adv-HIF1αmu由辽宁医学院刘丹平等构建。M199培养液(Hyclone)、表皮生长因子(英国PeproTech)、血管内皮生长因子(英国PeproTech)、碱性成纤维细胞生长因子(英国PeproTech)、淋巴细胞分离液(天津灏洋生物公司)、FITC标记的荆豆凝集素(美国Sigma)、DiI标记的乙酰低密度脂蛋白(美国Vector)、人纤维连接蛋白(美国Chemicon)、HIF-1α单克隆抗体(美国NOVUS)等。
2 EPCs的体外分离培养 取兔四肢长骨,密度梯度离心法提取单个核细胞。DMEM完全培养液重悬细胞,接种于培养瓶里培养48 h后首次换液,获取未贴壁的细胞,然后重悬在M199培养基中。接种在预先包被有人纤维连接蛋白的培养瓶中。3 d后首次换液,去除其中不贴壁细胞,后每隔3 ~4 d换液1次。
3 骨髓来源的EPCs鉴定 原代细胞传代后,培养至第10天,取消化培养的细胞,离心后去上清,PBS漂洗2 min,2次;加入5 ml DIL-ac-LDL(10 μg/ml),37℃孵育1 h;PBS漂洗2次;2%多聚甲醛固定细胞10 min;PBS漂洗2次;加入5 ml FITC-UEA-l (10 μg/ml),37℃孵育1 h。用激光共聚焦显微镜观察。DIL-ac-LDL和FITC-UEA-1双染色阳性细胞被认为是EPCs。
4 EPCs成血管能力检测 以EPCs小管形成实验来检测EPCs体外血管新生能力。据Matrigel的使用说明,检测EPCs体外小管形成能力。细胞重排为毛细血管样的结构即定义为小管形成。以5 μg/ml的浓度加入钙黄绿素染活细胞,荧光显微镜下观察小管形成的长度,Image-Pro Plus计算机软件进行分析。
5 转染EPCs 经检测Adv-HIF1αmu转染EPCs的最佳转染指数(multiple of infection,MOI)为150,以MOI=150转染EPCs,获得含有目的基因处理的EPCs细胞,设为A组。B组为单纯转染Adv的EPCs。设未转染Adv-HIF1αmu的EPCs为C组(即空白组)。各组细胞培养10 d。
6 Western Blot检测HIF-1的表达 培养第10天,各组按要求胰酶消化后取1×106个细胞,加入4℃裂解缓冲液中,冰上孵育30 min。4℃12 000 r/min离心5 min。取上清液加等倍SDS上样缓冲液,沸水浴10 min,放于-20℃保存待用。常规灌胶,上样,采用电转仪装置恒流200 mA,于4℃转膜1 ~1.5 h。使用Tween-20 PBS稀释一抗(羊抗兔单克隆抗体),二抗(辣根过氧化物酶标记的驴抗羊IgG)与滤膜共温浴,显色。用凝胶成像系统分析膜上目的条带和内参照(β-actin),测定吸光度(A)值。
7 ELISA检测CXCL12表达 取A、B、C组细胞于2 d、4 d、8 d的培养液上清,按照ELISA试剂盒说明步骤进行操作,检测CXCL12浓度并绘制不同时间的浓度曲线,各组进行比较。
8 转染后细胞悬液对外周EPCs的迁移的影响 用0.25%胰酶(含0.02% EDTA)消化贴壁的EPCs成单细胞悬液,以1×105/ml浓度的EPCs重悬于含1% FBS的M199培养基中,取100 μl加到上层小室中,小室下层分别加600 μl的A、B、C 3组的细胞悬液,37℃、5% CO2培养箱中培养过夜。24 h后从培养箱中取出小室,甲醇固定5 min,Giemsa染液(原液1∶10稀释)染色15 min,清水脱色后光镜下观察滤膜外侧面的细胞。100倍随机8个视野计数,取平均值。
9 统计学方法 采用SPSS18.0统计软件进行分析。数据以-±s表示,组间比较采用单因素方差分析,两两比较采用t检验;检验水准α=0.05。
结 果
1 EPCs的分离培养及形态变化 EPCs于接种后48 h开始贴壁,可见有梭形或不规则三角形细胞贴附于培养皿底部。培养第4天换液后可见细胞集落形成,成漩涡状排列。培养10 ~ 15 d可见EPCs呈“鹅卵石”样特异性表现。见图1。
2 骨髓来源EPCs的特征性鉴定 在激光共聚焦显微镜下,Dil标记的ac-LDL为红色荧光,而FITC标记的UEA-1为绿色荧光,红、绿荧光重叠双染的细胞即为EPCs,见图2。
3 EPCs的成血管能力检测 在Matrigel上能够形成血管样结构,见图3。
4 Western Blot检测HIF-1的表达 A组HIF-1α蛋白表达明显高于B组和C组(P<0.05)(图4),其结果灰度值比较见表1。
5 ELISA检测CXCL12的浓度变化 各组细胞培养液CXCL12浓度呈先上升后下降的趋势,浓度高峰出现在培养后第4天。转染Adv-HIF1αmu的EPCs(A组)的CXCL12浓度明显高于B组和C组,见图5。
6 转染后细胞悬液对外周EPCs的迁移的影响转染Adv-HIF1αmu后的EPCs上清液能趋化更多外周EPCs迁移。EPCs穿过滤膜数A组为61.3± 10.3,B组为32.5±11.5,C组为28.6±9.6(P<0.05) (图6)。

图 1 EPCs镜下特点(倒置相差显微镜×100) A: 培养4 d, 出现集落; B: 10 ~ 15 d, 可见铺路石样表现Fig. 1 Inverted microscopy showing colony (A) and pebbles (B) of EPCs 4 and 10-15 days after culture (×100)
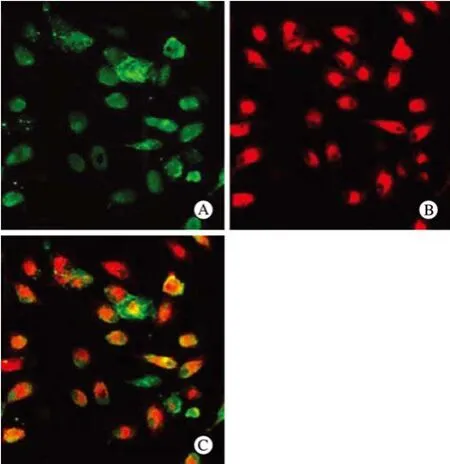
图 2 骨髓来源的EPCs鉴定A: FITC标记的UEA-1(×200); B: Dil标记的ac-LDL(×200); C : 红、绿荧光重叠双染(×200)Fig. 2 Identification of FITC-marked UEA-I (A), Dil-marked ac-LDL (B), red and green fuorescence-stained bone marrow-derived EPCs (C)(×200)
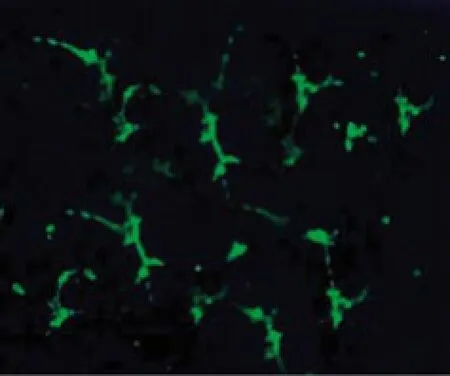
图 3 EPCs在Matrigel上形成血管样结构Fig. 3 Formation of vascular structure in Matrigel of EPCs

图 4 Western Blot检测HIF-1α的表达Fig. 4 Western blot showing expression of HIF –1α
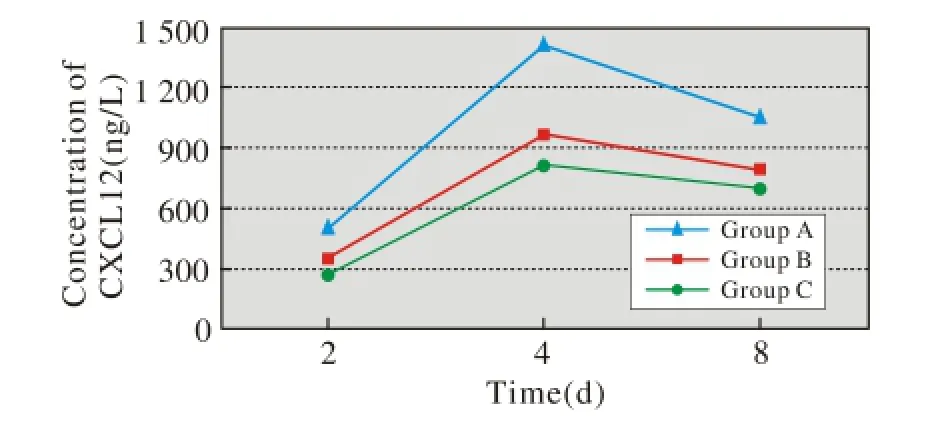
图 5 ELISA检测CXCL12表达2 d时A组CXCL12浓度(513±14) ng/L, 4 d的EPCs培养液上清中CXCL12浓度(1 414±72) ng/L, 8 d时的浓度为(1 055± 37) ng/L,明显高于同时间B组及C组EPCs培养液上清中CXCL12浓度Fig. 5 ELISA revealing expression of CXCL12 The CXCL12 concentrations were significantly higher in the supernatant of group A (513±14) ng/L on day 2, and (1 414±72 ng/L) on day 4, (1 055±37) ng/L on day 8 , than in those of group B and group C
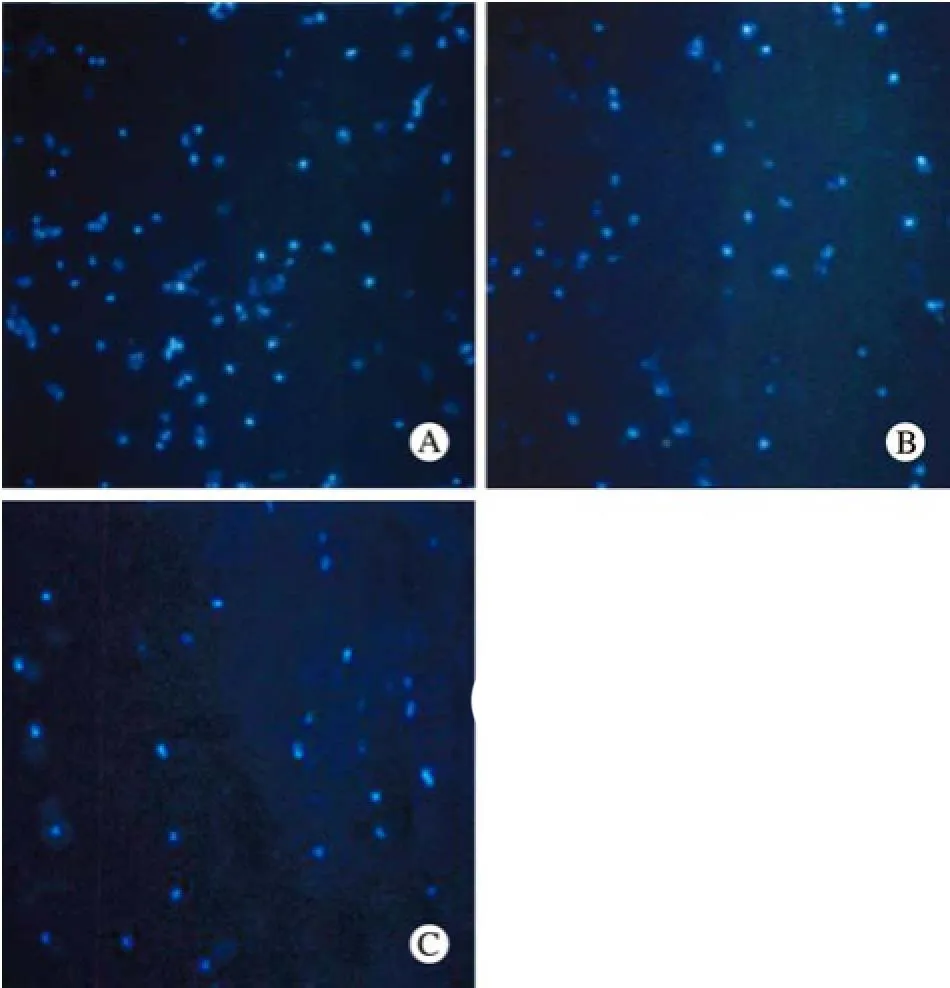
图 6 转染后的细胞上清液对外周EPCs的迁移的影响迁移数量A组明显多于B组及C组(P<0.05),B组与C组差异无统计学意义(P>0.05)Fig. 6 Effect of transfected EPCs supernatant on migration of exogenous EPCs The number of migrated EPCs was significantly greater ingroup A than in groups B and C (P<0.05) with no signifcantdifference found between group B and group C (P>0.05)
表1 Western blot灰度值比值Tab. 1 Western blot showing gray value ratio of HIF-1α (-±s, n=5)
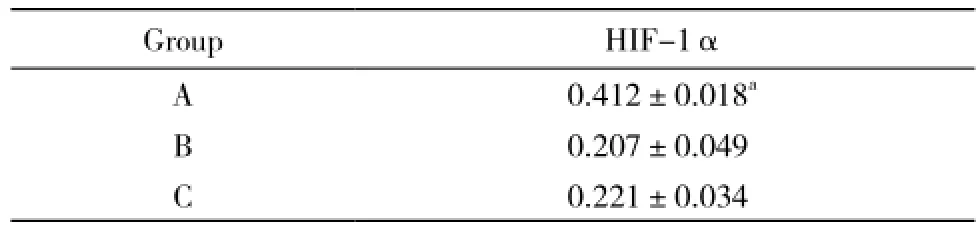
表1 Western blot灰度值比值Tab. 1 Western blot showing gray value ratio of HIF-1α (-±s, n=5)
aP<0.05, vs group B and group C
GroupHIF-1α A 0.412±0.018aB 0.207±0.049 C 0.221±0.034
讨 论
内皮祖细胞是一类能够定向分化为成熟血管内皮细胞的前体细胞,在胚胎或成年后缺血、创伤等病理状态下参与血管的新生[1,8]。自从1997年由日本研究者Asahara发现后,其作用越来越受到学者的广泛关注。低氧诱导因子-1α是在低氧环境中起细胞调控作用的关键基因,在缺血造成的低氧中发挥重要作用[2]。但是HIF-1α在常氧环境中极易降解失活[5]。为了使其能够在低氧及常氧条件下均能表达,我们前期使用基因技术成功构建了能够在常氧条件下表达的突变体Adv-HIF1αmu[8]。
EPCs表面存在着一种趋化因子受体CXCR4,其配体为CXCL12[9-10],这种配体可在EPCs[7]、基质细胞等细胞及组织分泌,并在CXCL12/CXCR4生物学轴的作用下促进EPCs趋化、归巢至缺血部位继而发挥成血管作用而改善局部缺血情况[11-13]。既往的研究发现,CXCL12在维持造血干细胞存活方面也起重要作用[14-15]。而HIF-1α被证明可以上调局部的CXCL12[5],促进EPCs的趋化及归巢作用并增强改善缺血能力。利用这一思路,我们将成功构建的能够在常氧条件下表达的突变体Adv-HIF1αmu转染EPCs,观察转染后EPCs内的CXCL12表达情况。
本实验中,利用EPCs与骨髓间充质细胞(bone marrow stromal cells,BMSCs)贴壁时间差异[16]即EPCs在培养48 h后贴壁,而BMSCs通常在48 h内贴壁,观察细胞形态。并通过检测其结合UEA-1和摄取ac-LDL的能力及成管能力检测进行细胞鉴定。以最佳转染复数MOI=150转染EPCs,10 d后Western Blot检测HIF-1的表达,结果表明,A组(即转染Adv-HIF1αmu)的EPCs能够表达HIF-1,而B组(未转染Adv-HIF1αmu的EPCs)和C组(单纯转染Adv的EPCs)未表达HIF-1。而ELISA结果表明转染Adv-HIF1αmu的EPCs中CXCL12的表达较其他两组有明显上调,未转染Adv-HIF-1αmu的EPCs和单纯转染Adv的EPCs中CXCL12表达无明显差异。通过对比3组细胞上清液对EPCs的趋化迁移作用,证实转染Adv-HIF-1αmu的细胞可以促进外周EPCs向其迁移。综上所述,将Adv-HIF-1αmu转染入EPCs后可以上调细胞CXCL12的表达并促进外周EPCs的趋化迁移。
缺血性疾病,包括股骨头坏死、心肌梗死、肢体缺血坏死等,是当今世界的一大难题,而随着干细胞移植技术的快速发展,让人们看到了解决这一难题的希望。本实验的结果证实,转染Adv-HIF-1αmu的EPCs可以通过HIF-1的表达而上调局部CXCL12的表达,进而通过CXCL12/CXCR4生物学轴的作用诱导、趋化其他干/祖细胞归巢至缺血部位,发挥各自的再生作用,进而改善和逆转缺血状态。为治疗缺血性疾病提供新的思路。
1 Atesok K, Li R, Schemitsch E. Endothelial progenitor cells: a novel cell-based therapy in orthopaedic surgery[J]. J Am Acad Orthop Surg, 2012, 20(10): 672-674.
2 Sun XT, Yuan XW, Zhu HT, et al. Endothelial precursor cells promote angiogenesis in hepatocellular carcinoma[J]. World J Gastroenterol, 2012, 18(35): 4925-4933.
3 Ruan C, Shen Y, Chen R, et al. Endothelial progenitor cells and atherosclerosis[J]. Front Biosci(Landmark Ed), 2013, 18:1194-1201.
4 Hoenig MR, Bianchi C, Sellke FW. Hypoxia inducible factor-1 alpha, endothelial progenitor cells, monocytes, cardiovascular risk,wound healing, cobalt and hydralazine: a unifying hypothesis[J]. Curr Drug Targets, 2008, 9(5):422-435.
5 Ceradini DJ, Gurtner GC. Homing to hypoxia: HIF-1 as a mediator of progenitor cell recruitment to injured tissue[J]. Trends Cardiovasc Med, 2005, 15(2): 57-63.
6 Dalloul A. Hypoxia and visualization of the stem cell niche[J]. Methods Mol Biol, 2013, 1035:199-205.
7 Zaruba MM, Franz WM. Role of the SDF-1-CXCR4 axis in stem cell-based therapies for ischemic cardiomyopathy[J]. Expert Opin Biol Ther, 2010, 10(3): 321-335.
8 李谌,靳云龙,胡亮,等.突变型低氧诱导因子-1α腺病毒载体的构建及常氧表达[J].中华实验外科杂志,2011,28(9):1539-1540.
9 尹扬光,黄岚,赵晓辉,等.内皮祖细胞分泌SDF-1及其抗内皮祖细胞凋亡作用[J].心脏杂志,2007,19(4):391-394.
10 Liekens S, Schols D, Hatse S. CXCL12-CXCR4 axis in angiogenesis,metastasis and stem cell mobilization[J]. Curr Pharm Des, 2010,16(35):3903-3920.
11 Zhuo W, Jia L, Song N, et al. The CXCL12-CXCR4 chemokine pathway: a novel axis regulates lymphangiogenesis[J]. Clin Cancer Res, 2012, 18(19): 5387-5398.
12 Oh YS, Kim HY, Song IC, et al. Hypoxia induces CXCR4 expression and biological activity in gastric cancer cells through activation of hypoxia-inducible factor-1α[J]. Oncol Rep, 2012, 28(6):2239-2246.
13 Kim KL, Meng Y, Kim JY, et al. Direct and differential effects of stem cell factor on the neovascularization activity of endothelial progenitor cells[J]. Cardiovasc Res, 2011, 92(1): 132-140.
14 Lataillade JJ, Clay D, Dupuy C, et al. Chemokine SDF-1 enhances circulating CD34(+) cell proliferation in synergy with cytokines:possible role in progenitor survival[J]. Blood, 2000, 95(3):756-768.
15 Wang Y, Luther K. Genetically manipulated progenitor/stem cells restore function to the infarcted heart via the SDF-1α/CXCR4 signaling pathway[J]. Prog Mol Biol Transl Sci, 2012, 111:265-284.
16 Li SC, Acevedo J, Wang L, et al. Mechanisms for progenitor cellmediated repair for ischemic heart injury[J]. Curr Stem Cell Res Ther, 2012, 7(1): 2-14.
Effect of Adv-HIF-1αmu-transfected endothelial prognostic cells on expression of CXCL12
ZHAO Hui, LIU Dan-ping, QI Xin, ZHANG Jie-yuan, LI Chen
First Affliated Hospital of Liaoning Medical College, Jinzhou 121000, Liaoning Province, China
LIU Dan-ping. Email: liudanping2009@sohu.com
ObjectiveTo study the effect of HIF1αmu-tansfected exogenous endothelial progenitor cells (EPCs) on expression of CXCL12.MethodsEPCs were isolated, cultured and identifed by density gradient centrifugation in combination with differential velocity adherent technique. Adv-HIF- 1αmuwas transfected into EPCs with the optimum multiplicity of infection (MOI). EPCs containing the purpose gene served as group A, Adv-transfected EPCs served as group B, and non Adv-HIF-1αmu-transfected EPCs served group C. Expression of HIF-1 in transfected EPCs was detected by Western blot. Effect of CXCL12 concentration in transfected EPCs supernatant on migration of exogenous EPCs was assayed.ResultsThe EPCs isolated by density gradient centrifugation in combination with differential velocity adherent technique can bind to UEA-1 and uptake ac-LDL, and are thus angiogenic. The expression level of HIF-1 and CXCL12 in Adv-HIF-1αmu-transfected EPCs was signifcantly higher in group A than in groups B and C(P<0.05) and can induce the migration of exogenous EPCs.ConclusionDensity gradient centrifugation in combination with differential velocity adherent technique can isolate and culture the characteristic EPCs. Adv-HIF-1αmu -transfected EPCs can highly express HIF-1 and CXCL12 and induce the migration of exogenous EPCs.
endothelial progenitor cells; hypoxia inducible factor 1αmu; adenovirus; CXCL12
R-322
A
2095-5227(2014)01-0085-04
10.3969/j.issn.2095-5227.2014.01.027
时间:2013-09-29 10:55
http://www.cnki.net/kcms/detail/11.3275.R.20130929.1055.006.html
2013-08-05
辽宁省卫生厅“百千万人才工程”资助课题(2010921045)
赵辉,男,在读硕士。研究方向:骨组织工程。Email: 276056908@qq.com
刘丹平,男,博士,教授。Email: liudanping2009@sohu.com

