瘦素减轻6-羟基多巴胺诱导的SH-SY5Y细胞损伤
韩 铭,邓子辉,薛 辉,李永明,颜光涛
解放军总医院 基础所生化室,北京 100853
基础研究
瘦素减轻6-羟基多巴胺诱导的SH-SY5Y细胞损伤
韩 铭,邓子辉,薛 辉,李永明,颜光涛
解放军总医院 基础所生化室,北京 100853
目的探讨瘦素对6-羟基多巴胺(6-hydroxydopamine,6-OHDA)所诱导的人神经母细胞瘤细胞(SH-SY5Y)凋亡的抑制作用。方法建立6-OHDA诱导的SH-SY5Y细胞损伤模型,用瘦素进行干预,采用倒置显微镜观察细胞形态,MTT法检测细胞活性,LDH法检测细胞损伤,台盼蓝检测细胞死亡率,流式细胞术检测细胞凋亡率,并用免疫荧光检测active caspase-3的荧光强度,Western blot检测Bcl-2和Bax的表达水平。结果成功建立了6-OHDA诱导的SH-SY5Y细胞损伤模型。在模型的基础上,瘦素干预后,细胞凋亡率降低约15%,细胞存活率提高约14%,细胞损伤降低率和死亡率,active caspase-3的浓度下降,Bcl-2/Bax的比值显著提高(P<0.05)。结论瘦素对6-OHDA诱导的SH-SY5Y细胞凋亡具有一定的抑制作用,这对瘦素可能参与帕金森病的保护作用提供了证据。
6-羟基多巴胺;SH-SY5Y细胞;细胞损伤;瘦素
帕金森病(Parkinson's disease,PD)是一种常见的神经退行性疾病,其发病人数仅次于阿尔茨海默病,55岁以上老年人发病率在1% ~ 2%。PD的主要发病原因是黑质多巴胺能神经元选择性死亡、丢失,导致多巴胺(dopamine,DA)水平下降。因此,保护神经元是目前众多研究的重点[1-3]。瘦素(leptin)是由定位于染色体7q31的肥胖基因(obese gene,OB)编码的一种蛋白类激素。帕金森患者血液中瘦素的浓度较低,多半患者都伴有体质量减轻现象。国外有研究提示瘦素在阿尔茨海默病、脑缺血、癫痫等神经疾病中发挥保护作用[4-9]。SH-SY5Y细胞系是一种分化程度较低的肿瘤细胞,具有许多多巴胺能神经元的特点,包括合成多巴胺和去甲肾上腺素和表达多巴胺转运蛋白(dopamine transporter,DAT)。DAT通过特定的摄取和封存多巴胺的方式调节多巴胺的动态平衡,是近年来被用作PD研究的神经元模型[2]。6-羟基多巴胺(6-hydroxydopamine,6-OHDA)通过自身及产生的氧自由基对黑质多巴胺能神经元产生毒性作用,引起神经元的退行性变[10]。因此6-OHDA通常作为诱导帕金森模型的神经毒素。但瘦素对于帕金森病的保护作用研究不多,本实验拟在建立6-OHDA诱导SH-SY5Y细胞PD模型的基础上,观察瘦素对该细胞损伤模型的保护。
材料和方法
1 材料 人神经纤维母细胞瘤细胞系SH-SY5Y (本实验室保藏);DMEM培养基、胎牛血清、0.25%胰蛋白酶(Gibico公司);MTT、台盼蓝(sigma公司);LDH试剂盒(南京建成生物工程有限公司);细胞凋亡检测试剂盒(凯基公司);人重组瘦素(peprotech公司);三羟甲基氨基甲烷(Tris碱)(北京益利精细化学品公司);Western blot超敏发光液、RIPA裂解液、BCA蛋白定量试剂盒(北京普利莱基因技术公司);一抗:active caspase-3和Bcl-2抗体(Cell signaling technology公司),β-actin(Santa Cruz公司),Bax(Epitomics公司);二抗:山羊抗兔IgG/cy3标记(武汉博士德生物工程公司),山羊抗兔IgG/辣根过氧化物酶(北京中杉金桥公司)。
2 MTT检测6-OHDA诱导的SH-SY5Y细胞的存活率 将处于对数生长期的SH-SY5Y细胞(6×104/ml) 200 μl接种于96孔板,每组设12个平行孔,培养24 h后,加入6-OHDA,使终浓度达到0、25、50、100、200 μmol/L,继续培养24 h,其中浓度为0的为对照组,另设空白对照组继续孵育24 h (6-OHDA用0.1% Vit c溶解,Vit c终浓度为0.002%,下同)。然后每孔加入20 μl MTT(5mg/ml),继续培养4 h,每孔加入150 μl DMSO,继续培养直至紫色化合物全部溶解,振荡器上振荡10 min后,酶标仪570 nm,对比波长650 nm,测定吸光值,存活率均相对于空白对照组,之后的实验,除MTT的相关实验,其他均只设对照组。
3 LDH法检测6-OHDA诱导的SH-SY5Y细胞的损伤 将处于对数生长期的SH-SY5Y细胞以2×105个/孔(1ml)种于24孔板中,设4个平行孔,处理同方法2。然后取细胞培养液,按照试剂盒要求处理,酶标仪450 nm,测定吸光值,相对值均与对照组相比。
4 细胞形态学观察 培养SH-SY5Y细胞丰度达到60%,倒掉原有培养基,然后加入含有6-OHDA(100 μmol/L)含血清的DMEM高糖培养基诱导24 h,建立模型。在6-OHDA诱导前2 h加入浓度为2 μg/ml瘦素对SH-SY5Y进行预保护。将处于对数生长期的细胞以1×106个/孔种于6孔板中,待瘦素预处理和模型建立之后,置于倒置显微镜下观察,100×倍数下拍照。
4.1 MTT法检测SH-SY5Y细胞存活率 待瘦素预处理和模型建立之后,采用MTT法检测其存活率变化,方法同2。
4.2 LDH法检测SH-SY5Y细胞损伤 待瘦素预处理和模型建立之后,采用LDH法检测其损伤变化,方法同3。
5 台盼蓝法检测细胞死亡率 以2×105个/孔将对数生长期的SH-SY5Y细胞种于24孔板中,设8个平行孔,待瘦素预处理和模型建立之后,消化并制备单细胞悬液,适当稀释后,将细胞悬液与0.4%台盼蓝溶液以9∶1混合混匀(终浓度0.04%)。在3 min内,分别计数活细胞和死细胞。镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状。细胞死亡率=死活细胞总数/(活细胞总数+死细胞总数)。
6 流式细胞术检测SH-SY5Y细胞凋亡率 将处于对数生长期的细胞以5×105个/孔种于6孔板中,设3个平行孔,待瘦素预处理和模型建立之后,参照凯基公司的细胞凋亡检测试剂盒方法,测定早期凋亡率和晚期凋亡率,3次独立实验求平均值。
7 免疫荧光检测凋亡分子active caspase-3 按照方法3分组,以2×105个/孔的密度接种SH-SY5Y细胞于Confocal专用小皿中,待瘦素预处理和模型建立之后,50%的羊血清封闭1 h,加入active caspase-3的一抗过夜,PBS洗3遍,每次5 min,然后加入cy3标记的二抗孵育,PBS再洗3遍,每次5 min,置于荧光显微镜下观察拍照,呈红色荧光。
8 Western blot检测Bcl-2和Bax 按照方法3分组,用RIPA蛋白裂解液提取总蛋白,BCA法蛋白定量。蛋白上样量为50 μg,在质量分数为10%的SDS-PAGE上进行垂直电泳,然后电转移到PVDF膜上(100 V,110 min),5%脱脂奶粉(TBST溶解,下同)封闭1 h,然后一抗,Bcl-2(1∶1000)、Bax (1∶2 000)、β-actin(1∶500)。4℃封闭过夜,TBST漂洗膜3次,每次10 min,然后二抗(1∶4 000),37℃孵育40 min,TBST漂洗3次,每次10 min,最后曝光显影。扫描后,使用Image Plus 6.0软件,分析其灰度值,3次独立实验求平均值。
9 统计学方法 采用Stata7.0软件统计进行统计学分析,数据以-±s表示,组间比较用t检验,P<0.05为差异有统计学意义。
结 果
1 PD细胞模型的建立 MTT法检测SH-SY5Y细胞存活率显示,6-OHDA诱导组在100 μmol/L、200 μmol/L存活率在50%以下,与空白对照组比较差异有统计学意义(aP<0.05),见图1A。LDH法检测SH-SY5Y细胞存活率显示,6-OHDA诱导组在100 μmol/L、200 μmol/L损伤的相对活力明显高于正常组(aP<0.05),见图1B。因为200 μmol/L 6-OHDA诱导的细胞死亡过于严重,PD细胞模型的建立采用100μmol/L 6-OHDA诱导SH-SY5Y细胞建立。
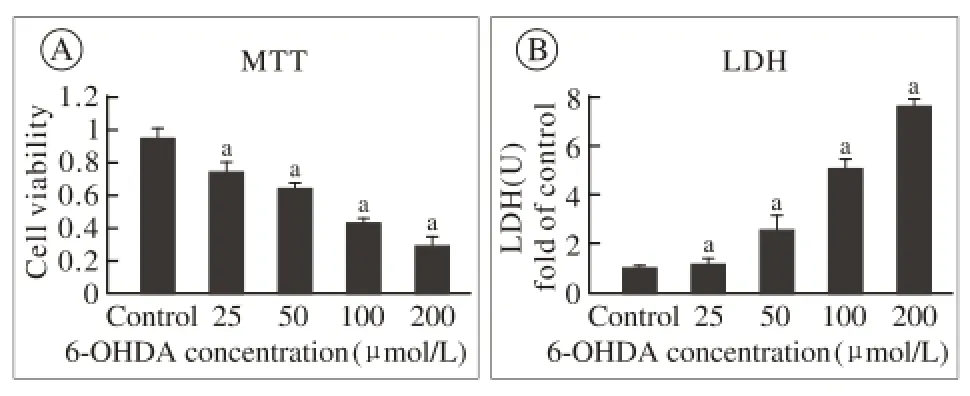
图 1 PD模型的建立(aP<0.05, 与对照组比较)Fig. 1 Model of PD cells(aP<0.05, vs control group)
2 瘦素对于PD模型细胞形态的影响 细胞形态学观察(100×下观察),正常SH-SY5Y细胞在接种贴壁后呈梭形状(图2A),100 μmol/L模型组细胞皱缩破损(图2B),在100 μmol/L 6-OHDA诱导之前加入2 μg/ml瘦素组(图2C),其细胞相对于不加瘦素组,状态有所改善,皱缩的细胞减少。

图 2 倒置显微镜下SH-SY5Y细胞形态(100×)A: 对照组; B: 6-OHDA组; C: 6-OHDA+瘦素组Fig. 2 Morphology of SH-SY5Y cells under inverted microscope(100×)A: Control group; B: 6-OHDA group; C:6-OHDA+leptingroup
3 瘦素减轻PD模型细胞损伤 MTT法检测SHSY5Y细胞存活率,LDH法检测SH-SY5Y损伤率,台盼蓝检测SH-SY5Y死亡率,结果显示,相对于100 μmol/L 6-OHDA诱导的模型组,2 μg/ml瘦素预处理SH-SY5Y的存活率提高了约14%(图3A),减轻了对细胞的损伤(图3B),死亡率降低了约13%(图3C),差异有统计学意义(P<0.05)。
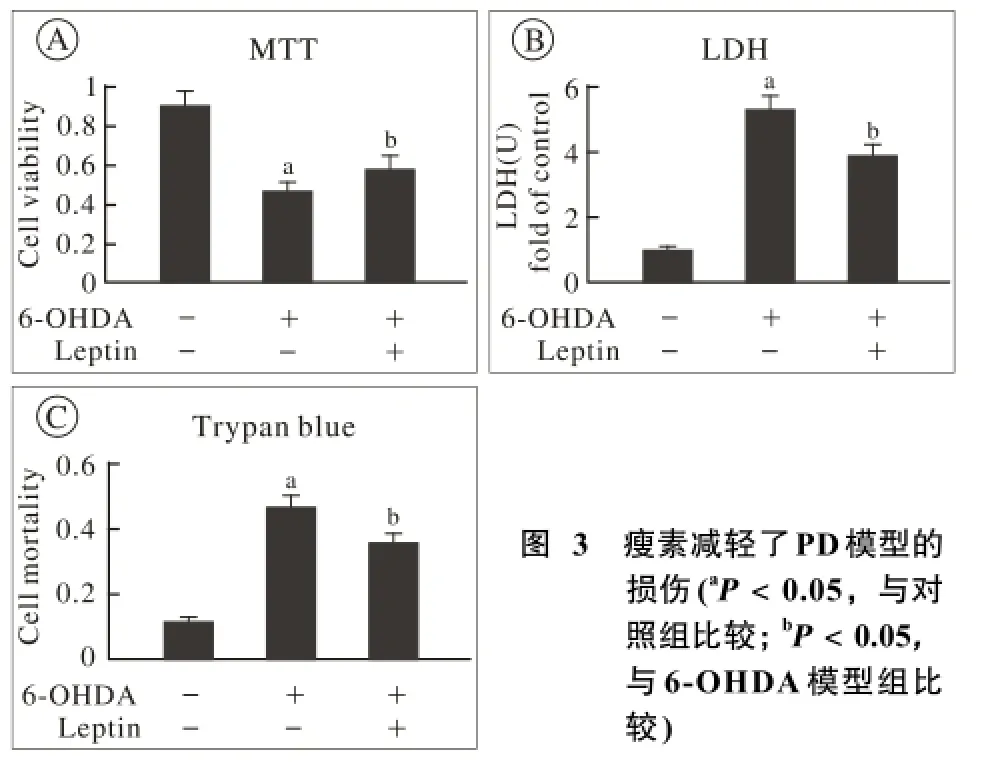
图 3 瘦素减轻了PD模型的损伤(aP<0.05,与对照组比较; bP<0.05,与6-OHDA模型组比较)Fig. 3 Alleviated PD model damage after leptin treatment(aP<0.05,vs control group; bP<0.05, vs 6-OHDA group )
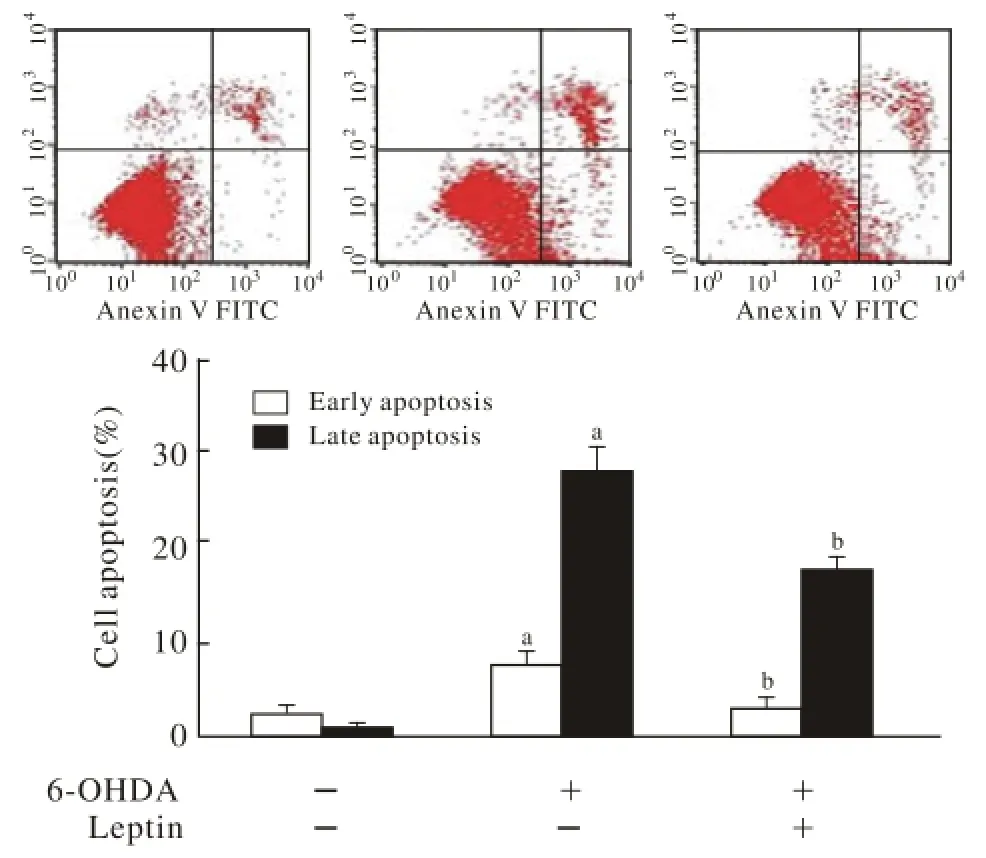
图 4 瘦素降低了PD模型的凋亡(aP<0.05,与对照组比较;bP<0.05,与6-OHDA模型组比较)Fig. 4 Decreased apoptosis of PD model after leptin treatment(aP<0.05, vs control group;bP<0.05, vs 6-OHDA group )
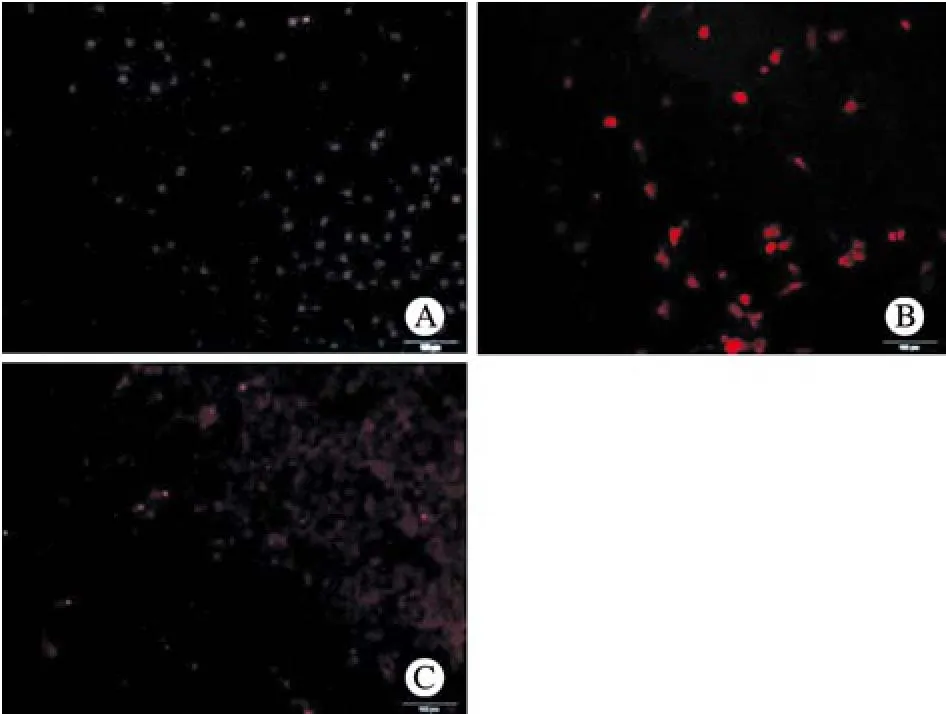
图 5 瘦素减弱了PD模型active caspase-3的激活A: 对照组; B: 6-OHDA组; C: 6-OHDA+瘦素组Fig. 5 Improved active caspa-se-3 activation in PD model afterleptin treatmentA: Control group; B: 6-OHDA group; C:6-OHDA+leptingroup
4 瘦素降低PD模型细胞的凋亡 流式细胞术检测结果显示,相对于100 μmol/L 6-OHDA诱导的模型组,2 μg/ml瘦素预处理使早期凋亡率和晚期凋亡率都有所下降(图4),总凋亡率降低了约15%,差异有统计学意义(bP<0.05)。
5 瘦素减弱了PD模型active caspase-3的激活 免疫荧光检测,在模型建立之后,100 μmol/L 6-OHDA诱导的SH-SY5Y细胞的模型组荧光强度强(图5B),正常组active caspase-3的荧光强度较弱(图5A),而瘦素预处理后,荧光减弱(图5C),从凋亡蛋白的角度进一步证明了瘦素减轻了6-OHDA诱导SH-SY5Y的损伤。
6 瘦素预处理后Bcl-2和Bax蛋白表达变化 Western blot结果显示,6-OHDA诱导SH-SY5Y细胞的模型组Bcl-2/Bax相对于正常组显著降低,瘦素预处理后,Bcl-2/Bax相对于模型组显著升高(P<0.05),见图6。

图 6 瘦素提高了PD模型Bcl-2/Bax的比值(aP<0.05,与对照组比较;bP<0.05, 与6-OHDA模型组比较)Fig. 6 Increased Bcl-2/Bax ratio in PD model after leptin treatment(aP<0.05, vs control group;bP<0.05, vs 6-OHDA group)
讨 论
帕金森病是多巴胺能神经元退行性病变导致的疾病,其发病与多巴胺能神经元数量的减少有关,这些神经元细胞位于与控制运动相关的黑质纹状体内。而瘦素是一种主要由脂肪组织分泌并释放入血的多肽类激素,其可通过中枢神经系统调节体质量和能量平衡。近年来随着研究的深入,越来越多的证据表明瘦素能够促进脑的发育和成熟,并且在脑损伤和神经退行性病变过程中能够对神经元细胞发挥抗凋亡和保护作用,这些都突显出瘦素在神经修复领域较好的应用前景[11-12]。
先前已有研究证明瘦素缺陷性小鼠中脑多巴胺能神经元的多巴胺含量降低,导致神经传递能力降低;肥胖者纹状体中D2类型的多巴胺受体数量减少;另一方面较高体质量指数往往与脑内较低的瘦素生物学活性关联,帕金森患者都伴有体质量减轻和瘦素水平降低的现象。这些都提示了瘦素与帕金森疾病的内在关联性[13-15]。
帕金森疾病自身发病的机制与凋亡密切相关,同时有研究显示Bcl家族成员与细胞凋亡密切相关,是生理性或病理性神经元死亡的关键因子,而active caspase-3属于凋亡分子,是由procaspase-3激活而成,它的增多预示着凋亡的发生。抗凋亡蛋白Bcl-2可与促凋亡蛋白Bax拮抗,抑制细胞色素C自线粒体释放至胞质,阻止细胞色素C对Caspase蛋白酶(包括procaspase-3)的激活,从而抑制凋亡。Bcl-2和Bax比值(Bcl-2/Bax)能提示是否发生凋亡[16-17]。
本研究中,建立了6-OHDA诱导的SH-SY5Y的PD模型,并在模型的基础上从存活、凋亡、损伤、细胞形态以及凋亡分子的免疫荧光、Western blot等多个角度出发,外源性给予瘦素,降低了6-OHDA诱导的SH-SY5Y细胞的损伤和凋亡,提高其存活率,细胞形态有了较大的改善,凋亡分子active caspase-3的荧光强度也有了相应减弱,Bcl-2/Bax的比值显著提高,证明了瘦素具有减轻6-OHDA诱导的SH-SY5Y细胞的损伤的功能。其机制可能是瘦素通过升高Bcl-2/Bax的比值和降低active caspase-3活化发挥其抗损伤作用,提示瘦素可能作为帕金森病治疗的新方向。
1 Lees AJ, Hardy J, Revesz T. Parkinson's disease[J]. Lancet,2009, 373(9680):2055-2066.
2 Xie HR, Hu LS, Li GY. SH-SY5Y human neuroblastoma cell line:in vitro cell model of dopaminergic neurons in Parkinson's disease [J] . Chin Med J, 2010, 123(8): 1086-1092.
3 陈欢意,牛平.帕金森病动物模型的研究进展[J].解剖科学进展,2005,11(4):362-366.
4 Tang BL. Leptin as a neuroprotective agent[J]. Biochem Biophys Res Commun, 2008, 368(2):181-185.
5 Doherty GH, Oldreive C, Harvey J. Neuroprotective actions of leptin on central and peripheral neurons in vitro[J]. Neuroscience, 2008,154(4): 1297-1307.
6 Lorefält B, Toss G, Granérus AK. Weight loss, body fat mass, and leptin in Parkinson's disease[J]. Mov Disord, 2009, 24(6):885-890.
7 Fiszer U, Michałowska M, Baranowska B, et al. Leptin and ghrelin concentrations and weight loss in Parkinson’s disease[J]. Acta Neurol Scand, 2010, 121(4): 230-236.
8 Zhang J, Deng Z, Liao J, et al. Leptin attenuates cerebral ischemia injury through the promotion of energy metabolism via the PI3K/Akt pathway[J]. J Cereb Blood Flow Metab, 2013, 33(4): 567-574.
9 Greco SJ, Hamzelou A, Johnston JM, et al. Leptin boosts cellular metabolism by activating AMPK and the sirtuins to reduce tau phosphorylation and β-amyloid in neurons[J]. Biochem Biophys Res Commun, 2011, 414(1): 170-174.
10 苏雅茹,蒋雨平.6-羟多巴胺在帕金森病发病中的作用[J].中国临床神经科学,2002,10(3):312-314.
11 司艺玲,颜光涛.瘦素神经保护作用的研究进展[J].感染、炎症、修复,2009,10(1):56-58.12 Wang GJ, Volkow ND, Logan J, et al. Brain dopamine and obesity[J]. Lancet, 2001, 357(9253):354-357.
13 Signore AP, Zhang F, Weng Z, et al. Leptin neuroprotection in the CNS: mechanisms and therapeutic potentials[J]. J Neurochem,2008, 106(5): 1977-1990.
14 Zhang F, Chen Y, Heiman M, et al. Leptin: structure, function and biology[J]. Vitam Horm, 2005, 71:345-372.
15 Roseberry AG, Painter T, Mark GP, et al. Decreased vesicular somatodendritic dopamine stores in leptin-deficient mice[J]. J Neurosci, 2007, 27(26): 7021-7027.
16 吴建军,肖清,刘凯,等.细胞凋亡学说在帕金森病发病机制的理论探索[J].中国老年学杂志,2009,29(16):2135-2137.
17 徐评议, 林健文. 神经细胞凋亡的分子调控[J]. 国外医学(内科学分册),1997,24(10):419-421.
Leptin alleviates damage of 6-OHDA-induced SH-SY5Y cells
HAN Ming, DENG Zi-hui, XUE Hui, LI Yong-ming, YAN Guang-tao
Biochemistry Laboratory, Basic Medical Institute, Chinese PLA General Hospital, Beijing 100853, China
YAN Guang-tao. Email: yan301@263.net
ObjectiveTo study the inhibitory effect of leptin on 6-OHDA-induced apoptosis of SH-SY5Y cells.MethodsA 6-OHDA-induced SH-SY5Y cells damage model was established and treated with leptin. Morphology of SH-SY5Y cells was observed under inverted microscope, viability of SH-SY5Y cells was assayed by MTT, damage of SH-SY5Y cells was detected by LDH, death rate of SH-SY5Y cells was tested with trypan blue staining, apoptosis of SH-SY5Y cells was detected by flow cytometry, fuorescence intensity of active caspase-3 was measured by immunofuorescence and expression levels of Bcl-2 and Bax were measured by Western blot.ResultsThe 6-OHDA-induced SH-SY5Y cells damage model was successfully established. The apoptosis of SH-SY5Y cells was about 15% lower, the survival rate of SH-SY5Y cells was about 14% higher, the damage and death of SH-SY5Y cells and the active caspase-3 concentration were higher, and the Bcl-2/Bax ratio was signifcantly lower after leptin treatment than before leptin treatment (P<0.05).ConclusionLeptin can inhibit 6-OHDA –induced apoptosis of SH-SY5Y cells, which provides the evidence for leptin in prevention of Parkinson's disease.
6-OHDA; SH-SY5Y cells; cell damage; leptin
R 34
A
2095-5227(2014)01-0070-05
10.3969/j.issn.2095-5227.2014.01.023
时间:2013-09-10 14:57
http://www.cnki.net/kcms/detail/11.3275.R.20130910.1457.002.html
2013-07-19
科技基础性工作专项项目(2011FY130100);国家科技支撑计划项目(2012BAK25B01)
Supported by National Basic Research Development Program of the Ministry of Science and Technology of China (2011FY130100); Supported by the National Key Technology R&D Program (2012BAK25B01)
韩铭,男,在读硕士。研究方向:神经退行性疾病的治疗。Email: hm299792458@126.com
颜光涛,男,副所长,主任,研究员,博士生导师。Email: yan301@263.net

