Toll样受体4拮抗剂防治兔蛛网膜下腔出血后迟发型血管痉挛
易 帅,霍晓川,甄 为,罗俊生
辽宁医学院,辽宁锦州 121001
基础研究
Toll样受体4拮抗剂防治兔蛛网膜下腔出血后迟发型血管痉挛
易 帅,霍晓川,甄 为,罗俊生
辽宁医学院,辽宁锦州 121001
目的探讨Toll样受体4(Toll like receptor 4,TLR4)拮抗剂依立托仑四钠(E5564)防治蛛网膜下腔出血(subarachnoid hemorrhage,SAH)后迟发性脑血管痉挛(delayed cerebral vasospasm,DCV)的作用。方法新西兰大白兔60只随机分为3组,每组20只。模型组枕大池二次注血法建立SAH模型。对照组枕大池内注入0.9%氯化钠注射液。E5564组SAH模型建立后,E5564静脉给药。血管造影及经颅多普勒评估血管痉挛情况,造模后第7天取材,HE染色观察基底动脉痉挛情况。免疫组化和Western blot方法检测基底动脉Toll受体4的表达。结果SAH后血管痉挛模型造模成功,模型组与对照组比较基底动脉直径明显降低(P<0.01);E5564组基底动脉直径较模型组明显增加(P<0.01);免疫组化及Western blot显示E5564组基底动脉TLR4表达较SAH组明显减少(P<0.05)。结论蛛网膜下腔出血后迟发型脑血管痉挛可能与Toll样受体4信号通路有关,E5564可以明显降低SAH后基底动脉TLR4表达,缓解SAH后迟发型脑血管痉挛。
蛛网膜下腔出血;迟发型脑血管痉挛;Toll样受体4;依立托仑四钠;IL-8;兔
蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是神经外科常见病,其致残率、致死率较高,预后不良的主要原因是迟发性脑血管痉挛[1]。SAH引起脑血管痉挛的机制复杂,目前仍缺少有效的方法来控制,SAH后脑血管痉挛的病理机制仍然不清楚,有待进一步研究[2-3]。有关研究表明炎症反应是蛛网膜下腔出血后迟发性脑血管痉挛的重要环节。Toll样受体4是发现最早的Toll样受体(Toll like receptor,TLR)亚型之一,由于TLR4在识别细菌脂多糖(lipopolysaccharide,LPS)及介导的炎症反应信号传导中的重要作用,其在炎症相关疾病中的作用受到强烈关注[4]。本实验通过复制兔SAH模型,观察TLR4对兔SAH后脑血管痉挛的影响,以探讨TLR4信号通路在SAH后脑血管痉挛中的作用,寻求SAH后脑血管痉挛治疗的新途径。
材料和方法
1 动物与分组 取新西兰纯种健康清洁级大白兔60只,由辽宁医学院实验动物中心提供,雌雄不限,4 ~ 6个月月龄,体质量2.5 ~ 3.0 kg。随机分为对照组(枕大池注入0.9%氯化钠注射液0.5 ml/kg,n=20)、蛛网膜下腔出血组(n=20)和依立托仑四钠(E5564)组(n=20)。
2 兔SAH后迟发性脑血管痉挛(delayed cerebral vasospasm,DCV)模型的制作 采用枕大池二次注血法制备兔蛛网膜下腔出血模型。3%硫喷妥钠经兔耳缘静脉(1 mg/kg)麻醉动物,麻醉成功后,将其俯卧于兔台上,剪掉颈枕部体毛,暴露枕大池。碘伏局部皮肤消毒,皮试针小心刺破硬膜,有突破感后再将针头继续深入1 ~ 2 mm,缓慢向回抽取1 ml的脑脊液后,再按0.18 ml/kg从兔耳中央动脉快速抽取动脉血,并慢慢注射入枕大池,3 min内注完。将兔保持头低位30° 30 min,以避免蛛网膜下腔血液扩散速度太快,尽量积聚在基底池附近。用0.9%氯化钠注射液稀释的庆大霉素冲洗伤口后加压包扎。48 h后重复上述操作完枕大池二次注血。给药组每次枕大池注血后立即静脉注射E5564 1次,剂量为1.5 mg/kg[5]对照组操作同SAH组,但注入的是0.9%氯化钠注射液。
3 神经功能评分 观察建模后7 d内神经缺损症状进行功能性评分。按Endo标准[6]将兔神经功能缺损症状分为4级:1级无神经功能缺损,评0分;2级轻度或者可疑神经功能缺损(嗜睡活动减少),评1分;3级中度神经功能缺损(肢体无力跛行),评2分;4级重度神经功能缺损(划圈运动或行走困难)评3分。
4 经颅多普勒(transcranial doppler,TCD)分析 为了避免造影剂的干扰,在第3天血管造影之前进行经颅多普勒超声。脉冲4-MHz探头,以一定的角度置于兔子头部,直到发现最清晰的血液信号。记录基底动脉的平均血流速度(mean flow velocity,MFV)和收缩期峰值流速(peak systolic velocity,PSV)。
5 血管造影分析 3%的硫喷妥钠(1 ml/kg)注入耳缘静脉麻醉。然后让兔子取仰卧位,用5-F导管通过股动脉插入到主动脉弓。再注入5 ml照影剂(三碘三酰苯),2 min内注完。采图速率为6张/min。分析软件处理血管造影片。选取5点(在基底动脉中心点,距离中心点1 mm处,距离中心点2 mm处)对基底动脉管径进行测量。计算出5点的平均直径。所有血管造影片为同一个研究员采集,基底动脉直径通过盲法测定。血管造影分别在造模前(T1),造模后第3天(T2)和第7天(T3)执行。
6 标本采集及病理 造模成功后第7天,在麻醉状态下将其处死,原位灌注兔后留取基底动脉,取基底动脉1/2段行苏木精-伊红(hematoxylineosin,HE)染色,光镜检查。
7 免疫组织化学检测 石蜡切片脱蜡至水,微波修复抗原后,滴加5%山羊血清封闭液,适量PBS稀释的一抗(兔抗TLR4和IL-8,1∶100稀释),-4℃冰箱内过夜(或37℃2 h左右)。然后加入加生物素化山羊抗兔IgG,37℃恒温箱内孵育20 min。进行DAB显色。染色后的切片放在显微镜下观察,以胞质或胞核显现棕黄色为阳性,未显现棕黄色记为阴性。阴性反应组用DPS缓冲液代替一抗。用IPP软件观察和分析每个组织点的5个随机视野。染色范围被分为4级:+染色范围小于1/4视野;++染色范围在1/4到1/2视野;+++染色范围在1/2到3/4视野;++++染色范围大于3/4视野。分为4个染色等级:弱阳性(+),中等阳性(++),强阳性(+++)。染色范围和染色等级被转换成染色指数。染色指数=染色范围×染色等级。+为1分,++为2分,+++为3分,++++为4分。
8 Western blot检测TLR4和IL-8表达水平 制作基底动脉组织蛋白匀浆,用蛋白裂解液进行凝胶电泳,将其转膜到硝酸纤维素薄膜上,用TBST浸洗,加入封闭液体对其进行封闭,与一定比例稀释的一抗混合孵育。TBST浸洗后与二抗室温混合孵育。TBST再次浸洗后加入发光显色剂进行显色。条带光密度应用JD801图像分析系统进行分析。
结 果
1 Endo神经功能评分 对照组术后未见神经功能异常评0分。SHA组(2.3±0.71)分,E5564组(1.4±0.21)分,E5564组与SHA组差异有统计学意义(P<0.05)。
2 TCD检测 SAH组与对照组相比,平均MFV和PSV明显升高(P<0.05)。E5564组与SAH组相比平均MFV和PSV明显降低(P<0.05),见图1。
3 基底动脉直径 SAH组和E5564组基底动脉平均管径在T2和T3较对照组基底动脉平均管径明显减小,SAH组基底动脉平均管径较E5564组减小,差异具有统计学意义(P<0.01),E5564明显抑制了脑出血后的血管痉挛,见表1。
4 HE染色 SAH组血管明显痉挛,管壁增厚,内膜皱褶,部分基底膜断裂,明显的炎性细胞浸润,对照组血管痉挛和炎症反应轻,见图2。
5 免疫组化 与对照组相比SHA组TLR4和IL-8表达水平明显增高,两组差异有统计学意义(P<0.05)。与SHA组相比E5564组TLR4和IL-8表达水平明显降低,两组差异有统计学意义(P<0.05),见表2。
6 Western blot检测 与对照组比较SAH组的TLR4和IL-8表达水平明显增高(P<0.05);与SAH组相比E5564组的TLR4和IL-8表达水平明显降低(P<0.05),见图3,图4,表3。

表1 基底动脉直径Tab. 1 Diameter of basilar artery(mm)

表2 TLR4和IL-8的免疫组化检测(染色指数)Tab. 2 Immunohistochemistry showing expression of TLR4 and IL-8
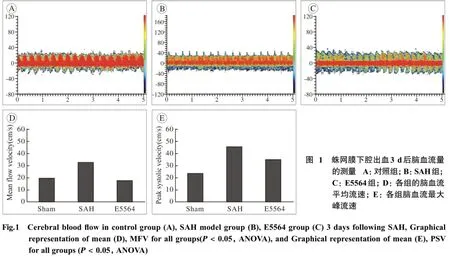
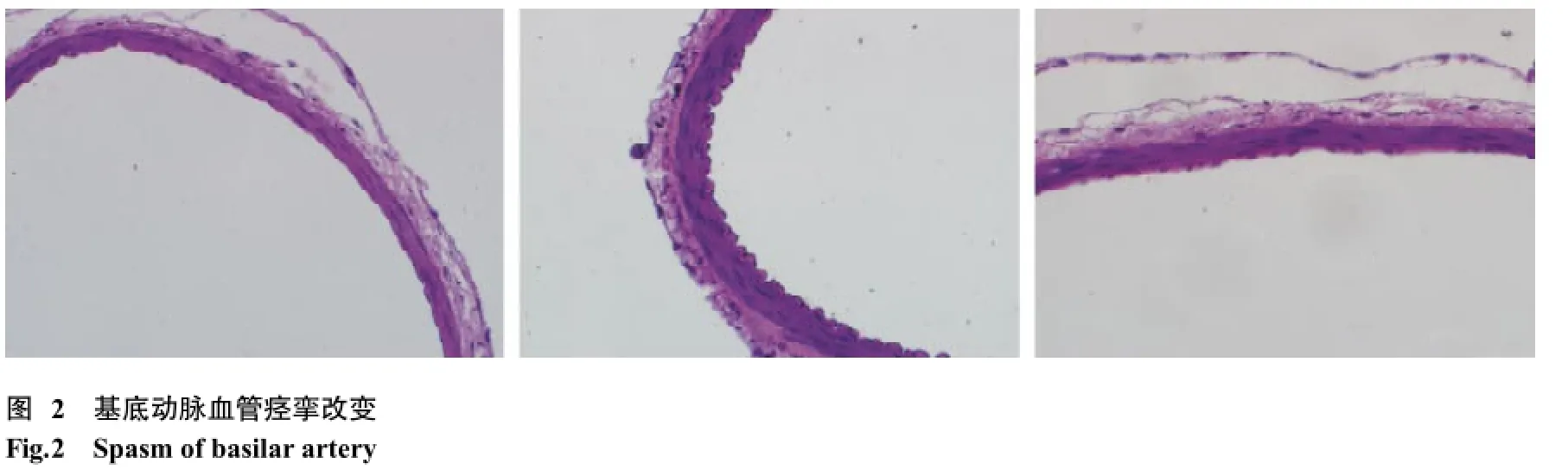
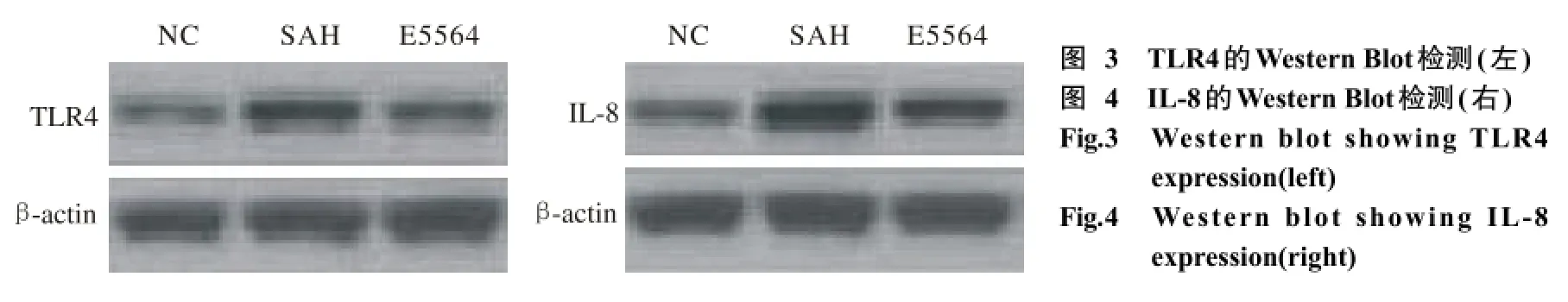

表3 基底动脉TLR4和IL-8蛋白表达(光密度比)Tab. 3 Expression of TLR4 and IL-8 protein in basilar artery
讨 论
我们所用的Chan所创立的家兔二次枕大池注血模型已成为研究脑血管痉挛发生机制的常用动物模型[7]。此模型的脑血管痉挛程度能经血管造影证实,而且其形态学改变也与人极为相似。本实验在第一次注血7 d后将大鼠处死,观察到SAH组和E5564组动物基底池和基底动脉周围均有少量血块聚积。实验中SAH组大鼠的基底动脉直径较对照组明显减小(P<0.01),说明模型反应良好。
Toll样受体属于模式识别受体,它在炎症反应和固有免疫起着关键性的作用。13种哺乳动物的TLR已经被发现,其中11种在人类被发现。它们识别来自不用器官的病原分子模式,包括细菌病毒,真菌,分枝杆菌和寄生虫[8]。此外TLR还识别破坏相关分子模式并且中介主要的损伤性炎症反应。TLR存在一类胞外区含有许多亮氨酸高度重复序列,并且其胞内区与IL-1受体的胞内区同源,该胞内区称为TIR(TIRIL-R1 homologous region)区的跨膜受体。TLR可通过依赖接头分子髓系分化因子88(myloid differentiation factor 88,MyD88)和非依赖的含有TIR结构能诱导干扰素β的接头分子(domain containing adaptor inducing interferon,TRIF)两类信号通路进行信号传导[9]。通过白细胞介素-1受体相关激酶(启动炎症级联反应的中介产物)家族成员的聚集来激活TLR信号从而活化核因子NF-κB,而后者是激活型I型干扰素的转录,从而触发下游的炎症反应。研究发现TLR4介导的信号通路包括依赖MyD88及非依赖MyD88的两种途径。我们研究发现SAH组TLR4在脑基底动脉表达明显增高,这提示脑血管痉挛有可能是通过TLR4介导的。
据报道在鼠颅内出血模型中TLR4被内在的配体,例如脑出血后产生的亚铁血红素和纤维蛋白原等活化上调,从而导致严重的后果[10]。本实验发现SAH组的TLR4和IL-8的表达都高于对照组,说明脑出血后可能产生某种或某类配体,这些配体与TLR4结合介导炎症反应,通过信号传导使IL-8高表达,IL-8可能参与脑血管痉挛的发生。
依立托仑四钠是TLR4的特异性拮抗剂,它是一种合成型的脂质-A类似物,能拮抗LPS的生理生化活性,阻止NF-κB的转移[11]。研究表明,E5564对患有脓毒血症的鼠有治疗作用,能降低血压并且修复血管。Shimamoto等已经证明,E5564预治疗能降低梗死面积。国外已有其在心脏,肺方面的研究[12]。目前已安全用于败血症的治疗和冠状动脉旁路移植术中心肌保护等方面[13-14]。
据多数文献报道,脑血管痉挛导致炎症渗出,脑水肿和细胞凋亡,最终导致血脑屏障的破坏和大量脑细胞死亡[15-16]。所以我们采用静脉注射E5564观察其对脑血管痉挛的影响,E5564组在给药后第5天时抑制血管痉挛最明显,5 d后效果不显著,这可能与SAH后血脑屏障的自行修复或脑启动某种血管保护机制有关。
本实验发现E5564组的TLR4和IL-8的表达水平明显下降,这可能与E5564抑制TLR4受体,减少下游IL-8的表达有关,进一步说明了TLR4信号通路在脑血管痉挛中的重要地位。通过抑制TLR4通路可以有效地抑制脑血管痉挛。这可能与IL-8的表达降低有关系。
1 Connolly ES, Rabinstein AA, Carhuapoma JR, et al. Guidelines for the management of aneurysmal subarachnoid hemorrhage: a guideline for healthcare professionals from the American Heart Association/ American Stroke Association[J]. Stroke, 2012, 43(6): 1711-1737.
2 Chang CZ, Wu SC, Lin CL, et al. Purine anti-metabolite attenuates nuclear factor κB and related pro-inflammatory cytokines in experimental vasospasm[J]. Acta Neurochir (Wien), 2012, 154(10): 1877-1885.
3 Chang CZ, Lin CL, Kassel NF, et al. 6-Mercaptopurine attenuates adhesive molecules in experimental vasospasm[J]. Acta Neurochir(Wien), 2010, 152(5): 861-867.
4 Bell MT, Puskas F, Agoston VA, et al. Toll-like receptor 4-dependent microglial activation mediates spinal cord ischemiareperfusion injury[J]. Circulation, 2013, 128(26 Suppl 1):152-156.
5 王超,杨智勇,路华,等.Toll样受体4信号通路在蛛网膜下腔出血后早期脑损伤中的机制研究[J].国际神经病学神经外科学杂志,2012,39(1):25-28.
6 Yu JM, Mo YC, Liang DD, et al. Effects of nimodipine on rabbits with symptomatic cerebral vasospasm[J]. Zhonghua Yi Xue Za Zhi, 2011, 91(5):345-349.
7 Titova E, Ostrowski RP, Zhang JH, et al. Experimental models of subarachnoid hemorrhage for studies of cerebral vasospasm[J]. Neurol Res, 2009, 31(6):568-581.
8 Frazão JB, Errante PR, Condino-Neto A. Toll-Like Receptors’Pathway Disturbances are Associated with Increased Susceptibility to Infections in Humans[J]. Arch Immunol Ther Exp(Warsz),2013. [Epub ahead of print]
9 Frantz S, Ertl G, Bauersachs J. Toll-like receptor signaling in the ischemic heart[J]. Front Biosci, 2008, 13:5772-5779.
10 Shao Z, Li J, Zhao Z, et al. Effects of tetramethylpyrazine on nitric oxide/cGMP signaling after cerebral vasospasm in rabbits[J]. Brain Res, 2010, 1361(1361): 67-75.
11 Fujii M, Yan J, Rolland WB, et al. Early Brain Injury, an Evolving Frontier in Subarachnoid Hemorrhage Research[J]. Transl Stroke Res, 2013, 4(4):432-446.
12 Carr KR, Zuckerman SL, Mocco J. Inflammation, Cerebral Vasospasm, and Evolving Theories of Delayed Cerebral Ischemia[J/ OL]. http://www.hindawi.com/journals/nri/2013/506584/ref/
13 Kang Z, Wang Q, Zhang H, et al. Construction of a stress-induced system in Escherichia coli for efficient polyhydroxyalkanoates production[J]. Appl Microbiol Biotechnol, 2008, 79(2): 203-208.
14 Aronowski J, Zhao X. Molecular pathophysiology of cerebral hemorrhage: secondary brain injury[J]. Stroke, 2011, 42(6):1781-1786.
15 Cho WS, Kang HS, Kim JE, et al. Intra-arterial nimodipine infusion for cerebral vasospasm in patients with aneurysmal subarachnoid hemorrhage[J]. Interv Neuroradiol, 2011, 17(2): 169-178.
16 Aminmansour B, Ghorbani A, Sharifi D, et al. Cerebral vasospasm following traumatic subarachnoid hemorrhage[J]. J Res Med Sci,2009, 14(6): 343-348.
Effect of Toll-like receptor 4 inhibitor on delayed cerebral vasospasm following subarachnoid hemorrhage
YI Shuai, HUO Xiao-chuan, ZHEN Wei, LUO Jun-sheng
Liaoning Medical College, Jinzhou 121001, Liaoning Province, China Corresponding author: LUO Jun-sheng. Email: luojunshengljs@sina.com
ObjectiveTo study the effect of Toll-like receptor 4 (TLR4) inhibitor E5564 on delayed cerebral vasospasm (DCV) following subarachnoid hemorrhage (SAH). MethodsSixty New Zealand rabbits were randomly divided into SAH model group, control group and E5564 group (20 in each group). Blood was injected into the animal cisterna magna of SAH model group, saline was injected into the animal cisterna magna of control group, and E5546 was injected into the animal vein of E5564 group after the SAH model was established. DCV was assessed by angiography and TCD, respectively. Basilar artery spasm was observed with HE staining 7 days after the SAH model was established. Expression of TLR4 in basilar artery was detected by immunohistochemistry and Western blot, respectively. ResultsThe diameter of basilar artery was significantly shorter in SAH model group than in control group and signifcantly longer in E5564 group than in SAH model group (P<0.01). Immunohistochemistry and Western blot showed that the expression level of TLR4 in basilar artery was significantly lower in E5564 group than in SAH model group (P<0.05). ConclusionDCV following SAH may be associated with the TLR4 signal pathway. E5564 can signifcantly inhibit the expression of TLR-4 in basilar artery, thus alleviating DCV following SAH.
subarachnoid hemorrhage; delayed cerebral vasospasm; Toll-like receptor 4; E5564; IL-8; rabbits
R 743.35
A
2095-5227(2014)02-0157-05
10.3969/j.issn.2095-5227.2014.02.018
2013-11-13 11:51
http://www.cnki.net/kcms/detail/11.3275.R.20131113.1151.001.html
2013-09-07
国家自然科学基金项目(81171111);辽宁省自然科学基金项目(2013022016);辽宁省教育厅科学研究项目(L2012298);辽宁医学院校长基金项目(XZJJ20130211)
Supported by the National Natural Science Foundation of China(81171111); Liaoning Natural Science Foundation of China(2013022016)
易帅,在读硕士。研究方向:脑血管病的基础研究。Email: 286649706@qq.com
罗俊生,博士后,教授,博士生导师。Email: luojunsheng ljs@sina.com

