胶质瘤合并癫痫的诊疗体会
殷 实,马晓东,韩国庆,余鹏霄,张 猛
解放军总医院 神经外科,北京 100853
胶质瘤合并癫痫的诊疗体会
殷 实,马晓东,韩国庆,余鹏霄,张 猛
解放军总医院 神经外科,北京 100853
目的 总结胶质瘤合并癫痫的诊疗经验。方法对我院2011年8月- 2012年7月入院、初次手术并证实为胶质瘤的病人的性别、年龄、临床症状、影像学表现及病理类别等资料进行回顾分析。结果共收治胶质瘤合并癫痫63例,其中男性39例,女性24例。同期胶质瘤病人中癫痫发病率达到30.4%,男女发病率差异无统计学意义(P>0.05),年龄15 ~65(40.11±11.33)岁。发作形式以全身强直-痉挛发作最多见(35例,55.6%),好发于额叶(45例,71.4%)、多累及脑皮质(59例,93.7%),病理以低级别胶质瘤为主(37例,58.7%)。手术辅以放化疗可以有效控制癫痫发作。结论胶质瘤合并癫痫宜行手术治疗并辅以放化疗。
胶质瘤;癫痫
胶质瘤起源于神经上皮细胞,占全部脑肿瘤的35.26% ~ 60.96%,是发病率最高的脑内肿瘤,而癫痫是胶质瘤最常见的症状[1]。有报道称胚胎发育不良性神经上皮胶质瘤癫痫发病率达到100%;60% ~ 85%的低级别胶质瘤患者发生过癫痫,而30% ~ 50%高级别胶质瘤患者有合并性癫痫[2-9]。癫痫机制仍未明确,一般认为是多种因素共同作用的结果[10]。癫痫发作本身及抗癫痫药物的使用均会损害患者认知,严重影响病人生活质量[11]。尤其是低级别胶质瘤,病人生存期相对较长,癫痫发作妨碍其正常生活,所以控制合并性癫痫意义较大。本文回顾性分析63例胶质瘤并合并癫痫病例,浅谈术前肿瘤致痫的相关因素,并分享我们的治疗经验。
对象和方法
1 对象 入选条件:1)2011年8月1日- 2012年7月31日入院;2)术前已出现癫痫症状;3)诊断为胶质瘤;4)能够完成手术切除、放化疗及抗癫痫治疗,接受至少半年术后随访;5)除外曾受过严重脑外伤、行脑手术等其他可能导致癫痫的情况。
2 方法 回顾性分析患者临床资料,包括性别、年龄、临床症状、影像学资料、病理类型及相关病史等。
3 统计学方法 采用SPSS17.0统计软件,统计方法采用χ2检验,P<0.05为差异有统计学意义。
结 果
1 一般资料 行手术的胶质瘤病人207例,男性131例,女性76例。其中满足入选条件的有63例,男性39例,女性24例。同期胶质瘤病人中癫痫发病率达到30.43%,男女发病率差异无统计学意义(P>0.05)。年龄15 ~ 65(40.11±11.33)岁。
2 临床症状 所有患者均以癫痫为首发症状,其中46例(73.02%)癫痫为唯一的症状;其他症状有头痛头晕、肌力减弱、记忆力明显下降、视物模糊或言语不清。依照癫痫发作的国际分类(1981),全身强直-痉挛发作35例为最多,单纯部分发作20例,复杂部分发作4例,失神发作4例。术前病程1 d ~ 88个月。
3 影像学特点 所有病例均行CT平扫、MRI平扫及钆喷酸葡胺增强扫描。CT主要呈低密度影49例(77.78%),9例(14.29%)不均一低密度与高密度混杂,5例(7.94%)病灶中有钙化灶,术后病理显示均为少突胶质细胞瘤。MRI扫描T1WI低信号或不均一低信号,T2WI高信号或混杂信号,10例环形强化,1例不规则强化。病变累及额叶最多,其次是颞叶和顶叶(表1)。59例(93.65%)累计脑皮质或浅层脑组织。未见幕下胶质瘤合并癫痫的病例。

表1 肿瘤位置Tab. 1 Tumor location
4 手术方式 患者入院后完善术前相关检查,依照国际抗痫联盟(ILAE)指南(2006年)给予抗癫痫药物治疗,择期行手术治疗。手术方式分为术中核磁导航辅助下手术(A组),导航辅助下手术(B组),术中核磁导航结合术中皮层电刺激辅助下手术(C组),导航结合术中皮层电刺激辅助下手术(D组),详见表2。在制定术前计划时,存在明显强化区域的划定强化区域为“病变”;肿瘤未见明显强化的,依据MRI中T2FLAIR项划定。切除体积百分比判定依据为:使用术中核磁扫描的依照术中末次扫描结果与术前影像对比;未使用术中核磁扫描的依据术后首次复查核磁与术前影响对比。扩大切除应用于远离功能区病变,范围包括瘤周1 cm范围。本组病例全切率(包括扩大切除,下同)达到77.8%。其中,单纯应用导航技术手术(B组、D组)全切率为72.4%,应用术中核磁导航技术手术(A组、C组)全切率达到82.4%,应用皮层电刺激技术手术(C组、D组)全切率达到85.7%。
5 并发症 10例出现对侧肢体肌力下降,其中1例伴有不完全运动性失语,1例术后出现头皮坏死。
6 术后病理 依照WHO分级标准,Ⅰ、Ⅱ级胶质瘤为低级别胶质瘤。63例病例术后病理等级及病理类型见表3,病理级别分布上以低级别胶质瘤为主(37例,58.7%),其中WHO Ⅱ级胶质瘤33例,占52.38%。病理类型上少突细胞瘤最多,其次为星形细胞瘤。

表2 手术方式及切除情况Tab. 2 Surgical options and results (n, %)

表3 病理等级及病理类型(WHO)Tab. 3 Tumor pathology (WHO)
7 术后治疗及随访 WHO Ⅲ级或Ⅳ级者给予替莫唑胺同步放化疗继以周期性化疗治疗。所有术后治疗建议均严格遵守中国恶性胶质瘤治疗共识及NCCN指南。依照国际抗痫联盟(ILAE)指南(2006年)给予抗癫痫药物治疗。术后2例患者肌力情况及1例患者语言功能较术前改善。在术后6个月及12个月对患者癫痫情况进行随访复查,并依据Engle疗效等级进行评定,结果见表4。
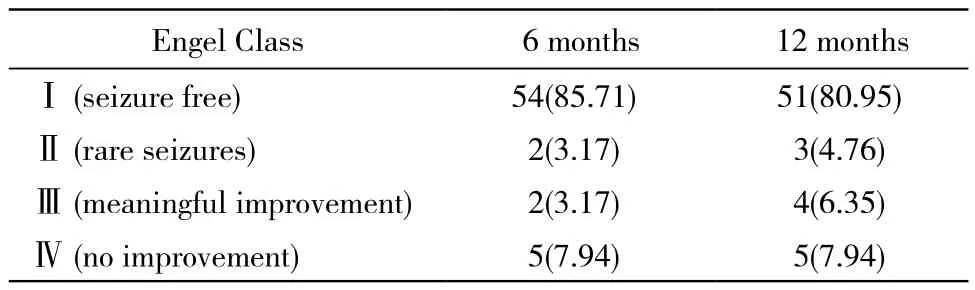
表4 胶质瘤术后病人癫痫控制情况随访结果Tab. 4 Seizure status in 6 and 12 months after surgery (n, %)
讨 论
肿瘤的位置及病理类型是其重要的致痫危险因素。本组病例中肿瘤累及额叶、颞叶及顶叶的病变更易导致癫痫,相对来说枕叶肿瘤致痫率极低。其中额叶胶质瘤合并癫痫发病率最高,可能是由于以下因素导致:1)额叶体积最大,胶质瘤发病率高;2)额叶与基底节区、丘脑及胼胝体等区域联系密切,异常放点容易扩散到上述部位,引起癫痫发作。同时,病变主要累及皮层及浅表脑组织,而很少破坏白质纤维,这就保存了癫痫灶放电的传播途径。
胶质瘤合并癫痫与肿瘤病理关系密切。据报道胚胎发育不良性神经上皮瘤发病率可达100%,而少突胶质细胞瘤达到86.7%,本组病例有相似结果[12]。与高级别胶质瘤相比,低级别胶质瘤合并癫痫比例较大(P<0.05),少突细胞瘤合并癫痫的比例明显高于其他病理类型(P<0.05)。Lynam等[13]证实肿瘤等级越高,癫痫发生率越低。这与高级别胶质瘤生长迅速、快速侵犯传导纤维有关。少突胶质细胞瘤和少突星形细胞瘤相较于星形细胞瘤更容易发生癫痫,这也可能与前者更多的累及皮层所致,或者与不同类型胶质瘤致痫机制不同有关。
胶质瘤合并癫痫的病人生存时间相对较长,这与癫痫发作多为早期症状,并促进患者及早就医有关[14]。癫痫对病人身心影响极大,所以控制癫痫亦是整个治疗过程中的重要组成部分。胶质瘤合并癫痫的治疗措施主要有手术、放疗及化疗(包括抗肿瘤化疗及抗癫痫药物治疗)。一项回顾773例病人的研究证实是否行手术全切病灶是影响癫痫预后最主要的因素之一[15]。由于瘤周组织大多是癫痫灶,所以安全切除范围尽可能达到明显肿瘤病变外1 cm;在功能区,手术原则是在尽可能保护神经功能的前提下争取彻底切除肿瘤及异常放电灶,应用fMRI、DTI、神经导航、超声、等辅助手术可以保证控制癫痫疗效的同时大大减少对功能区正常脑组织负损伤[16-18]。经典的放疗对癫痫的控制已得到认可,欧洲癌症治疗与研究组织对22 845例胶质瘤病例观察1年的结果显示,25%的术后辅以放疗的病人出现癫痫发作,而未接受放疗出现癫痫比例达到41%[19]。其机制与放疗对癫痫灶微环境改变及破坏癫痫传导途径有关。化疗方面,服用替莫唑胺使50% ~ 60%的胶质瘤患者减少了癫痫发作频率,20% ~ 40%患者癫痫消失,即在控制肿瘤的同时控制癫痫[20]。对术前有癫痫的患者,术后应继续进行抗癫痫治疗。
综上所述,手术辅以放化疗治疗胶质瘤合并癫痫是十分有效而且必要的,手术中可通过应用神经导航、皮层电刺激等辅助手段提高全切率的同时减少对增长脑组织的负损伤,更好控制癫痫的同时减少出现并发症的概率。
1 Lee JW, Wen PY, Hurwitz S, et al. Morphological characteristics of brain tumors causing seizures[J]. Arch Neurol, 2010, 67(3):336-342.
2 Van Breemen MS, Wilms EB, Vecht CJ. Epilepsy in patients with brain tumours: epidemiology, mechanisms, and management[J]. Lancet Neurol, 2007, 6(5): 421-430.
3 Duggal N, Taylor R, Zou GY, et al. Dysembryoplastic neuroepithelial tumours: clinical, proliferative and apoptotic features[J]. J Clin Pathol, 2008, 61(1): 127-131.
4 Van den Bent MJ, Reni M, Gatta G, et al. Oligodendroglioma[J]. Crit Rev Oncol Hematol, 2008,66(3):262-272.
5 Chang EF, Potts MB, Keles GE, et al. Seizure characteristics and control following resection in 332 patients with low-grade gliomas [J] . J Neurosurg, 2008, 108(2): 227-235.
6 Van Breemen MS, Vecht CJ. Optimal seizure management in brain tumor patients[J]. Curr Neurol Neurosci Rep, 2005, 5(3):207-213.
7 Herman ST. Clinical trials for prevention of epileptogenesis[J]. Epilepsy Res, 2006, 68(1): 35-38.
8 Glantz MJ, Cole BF, Forsyth PA, et al. Practice parameter:anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Report of the Quality Standards Subcommittee of the American Academy of Neurology[J]. Neurology, 2000, 54(10):1886-1893.
9 Pasquier B, Péoc'H M, Fabre-Bocquentin B, et al. Surgical pathology of drug-resistant partial epilepsy. A 10-year-experience with a series of 327 consecutive resections[J]. Epileptic Disord,2002, 4(2):99-119..
10 Rüegg S, Roelcke U. Brain tumor-associated seizures: glutamate,transporters, and an old drug[J]. Neurology, 2012, 79(9):844-845.
11 董晓书,王翔,刘艳辉,等.成人幕上低级别胶质瘤(WHOⅡ级)患者术后生活质量相关因素评估[J].华西医学,2011,26(5):674-678.
12 刘爱军,李安民,傅相平,等.幕上胶质瘤致癫因素分析[J].中国临床神经外科杂志,2006,11(8):467-469.
13 Lynam LM, Lyons MK, Drazkowski JF, et al. Frequency of seizures in patients with newly diagnosed brain tumors: a retrospective review[J]. Clin Neurol Neurosurg, 2007, 109(7):634-638.
14 You G, Sha ZY, Yan W, et al. Seizure characteristics and outcomes in 508 Chinese adult patients undergoing primary resection of lowgrade gliomas: a clinicopathological study[J]. Neuro Oncol,2012, 14(2): 230-241.
15 Englot DJ, Berger MS, Barbaro NM, et al. Predictors of seizure freedom after resection of supratentorial low-grade gliomas. A review[J]. J Neurosurg, 2011, 115(2): 240-244.
16 朱侗明,章文斌,刘翔,等.成人低级别致痫性胶质瘤的手术治疗[J].中华神经外科疾病研究杂志,2010,9(6):539-541.
17 詹彦,石立,石全红,等.功能区附近以癫痫为主要症状的低级别胶质瘤的手术治疗[J].重庆医学,2013,42(27):3239-3241.
18 林和璞,马晓东,郭胜利,等.多模态功能神经导航辅助下的术中磁共振在脑功能区胶质瘤手术中的应用[J].临床神经外科杂志,2013,10(2):97-99.
19 Chalifoux R, Elisevich K. Effect of ionizing radiation on partial seizures attributable to malignant cerebral tumors[J]. Stereotact Funct Neurosurg, 1997, 67(3/4): 169-182.
20 Pace A, Vidiri A, Galiè E, et al. Temozolomide chemotherapy for progressive low-grade glioma: clinical benefits and radiological response[J]. Ann Oncol, 2003, 14(12): 1722-1726.
Experience of diagnosis and treatment of epilepsy induced by glioma
YIN Shi, MA Xiao-dong, HAN Guo-qing, YU Peng-xiao, ZHANG Meng
Department of Neurosurgery, Chinese PLA General Hospital, Beijing 100853, China Corresponding author: MA Xiao-dong. Email:xiaodongm@hotmail.com
ObjectiveTo summarize the experiences of early diagnosis and treatment of epilepsy induced by glioma.MethodsClinical data (including gender, age, clinical symotom, imaging findings and pathological categories) of patients who enrolled in our department from August 2011 to July 2012 and underwent resection of glioma were retrospectively analyzed.ResultsOf the 207 glioma patients in this series, 63 (30.4%, male 39, female 24, with the age of 15-65 (mean, 40.11±11.33) years) presented with seizures. There was no sex predominance (P>0.05). Generalized tonoclonic seizure was the main form of attack (35, 55.6%). Factors more commonly associated with preoperative seizures were frontal lobe (45, 71.4%), involvement and cortical location (59, 93.7%), and low grade glioma pathology (37, 58.7%). Surgery followed by radiation and chemotherapy could control epilepsy effectively.ConclusionPatients with epilepsies induced by glioma are advised to be treated with surgery combined with radiotherapy and chemotherapy.
glioma; epilepsy
R 739.41
A
2095-5227(2014)07-0704-04
10.3969/j.issn.2095-5227.2014.07.016
时间:2014-03-19 09:24
http://www.cnki.net/kcms/detail/11.3275.R.20140319.0924.002.html
2014-02-18
殷实,男,在读硕士。研究方向:胶质瘤。Email:yin51shi51@163.com
马晓东,男,博士,硕士生导师。Email:xiaodongm@hotmail.com

