肾血管平滑肌脂肪瘤中间充质干细胞的分离培养及鉴定
孙圣坤,许 勇,宋尔霖,郭 刚,陈光富,符伟军,徐阿祥,张 旭
解放军总医院 泌尿外科,北京 100853
肾血管平滑肌脂肪瘤中间充质干细胞的分离培养及鉴定
孙圣坤,许 勇,宋尔霖,郭 刚,陈光富,符伟军,徐阿祥,张 旭
解放军总医院 泌尿外科,北京 100853
目的 明确经典型肾血管平滑肌脂肪瘤组织中是否存在间充质干细胞。方法收集8例肾血管平滑肌脂肪瘤手术切除的标本,剪碎后PBS洗涤,以胶原酶水解,贴壁培养后传代,流式细胞术检测细胞表型,并行体外成骨、成脂肪分化检测。结果从8例肾血管平滑肌脂肪瘤组织中均分离出具有间充质干细胞形态特征的贴壁细胞,该细胞不表达CD14、CD31、CD34、CD45、CD144等造血细胞或内皮细胞表面标志,而表达间充质干细胞表面标志如CD29、CD44、CD73、CD90、CD105等。在体外诱导后具有向骨、脂肪组织分化的能力。结论肾血管平滑肌脂肪瘤组织中存在具有间充质干细胞形态、表型和功能特征的一群细胞,间充质干细胞可能与肾血管平滑肌脂肪瘤的发生具有密切关系。
肾脏;血管平滑肌脂肪瘤;间充质干细胞;病因学;细胞分化;错构瘤
肾血管平滑肌脂肪瘤(renal angiomyolipoma,RAML)是肾最常见的良性肿瘤。近年来,随着医学影像学的发展和人们对健康体检的重视,其检出率逐渐升高。文献报道其发生率为0.3% ~ 3%,其中80%为散发型,与遗传无关,其余20%与结节性硬化和散发型淋巴管肉瘤有关[1-3]。RAML是肾的良性病变,通常不会发生转移,但其进行性生长会破坏正常肾组织,损害肾功能。此外由于肿瘤血管不成熟,组织结构较脆弱,在轻微外力作用下即可发生破裂。直径>4 cm的肿瘤合并破裂出血的危险性大大增加,绝大部分患者需要急诊行血管介入栓塞治疗,甚至被迫切除肾,严重时会危及患者生命。目前RAML的病因不明,由于瘤体的主要组成成分血管、平滑肌、脂肪组织均为间质成分,可由间充质干细胞(mesenchymal stem cells,MSC)分化而来,这提示我们,该肿瘤可能是一种干细胞起源性疾病。本研究旨在对RAML组织中的干细胞进行分离、培养并鉴定。
材料和方法
1 材料 8例标本来自2009年3月- 2011年5月解放军总医院泌尿外科手术切除的RAML,其中男性2例,女性6例,年龄16 ~ 48(42.6±14.4)岁。术后病理HE染色确认为经典型RAML。
2 自RAML标本中分离、培养细胞 无菌条件下获取新鲜的RAML标本,去除肿瘤表面的组织,将肿瘤切碎成1 ~ 3 mm3大小,PBS充分洗涤,在组织培养皿中将组织研磨,37℃以5 ml 0.075%Ⅰ型胶原酶(Sigma-Aldrich,St. Louis,MO,USA)消化30 min,同时搅拌。加入相同体积的含10% FBS的Dulbecco改良的Eagle培养基(DMEM)终止消化。将消化后的单细胞悬液以培养液进行培养,培养液为不含核糖核苷和脱氧核苷的α-MEM(Invitrogen,Carlsbad,CA,USA),并含10% FBS、0.45 mmol/L硫代甘油(MTG;Sigma-Aldrich)、100 U/ml青霉素(Hyclone,Logan,UT,USA)、100 ng/ml链霉素(Hyclone)、1 ng/ml bFGF(R&D Systems,Minneapolis,MN,USA),隔日更换培养液,当贴壁细胞生长至80% ~90%融合时,胰酶消化细胞并按照1∶3传代扩增。
3 流式细胞术 取对数生长期3×105个细胞以PBS洗涤3次,分别加入相应抗体,4℃孵育30 min,按照说明书操作,使用BD FACSCalibur(BD Biosciences,San Jose,CA,USA)进行检测。FITC或PE标记的抗人单克隆抗体CD14、CD19、CD34、CD73、CD105、CD166、HLA-DR购自BD公司,CD29、CD44购自BioLegend(San Diego,CA,USA)公司,CD31、CD144购自eBioscience(San Diego,CA,USA)公司。
4 成骨分化及检测 细胞按照104个/孔的密度接种于6孔板中,待细胞生长至对数生长期时,弃去培养液,分为诱导组和对照组,诱导组加入成骨细胞培养液(含10%的高糖DMEM+0.2 mmol/L维生素C+10-7mol/L地塞米松+10 mmol/L β甘油磷酸钠),对照组仅加入普通培养液。每组设3复孔,每3 d换液1次,培养2周后,以PBS洗涤,甲醛固定,碱性磷酸酶染色评价成骨分化。
5 脂肪分化及检测 细胞按照104个/孔的密度接种于6孔板中,待细胞生长至对数生长期时,弃去培养液,分为诱导组和对照组,诱导组加入脂肪细胞培养液(含10% FBS的高糖DMEM+10%马血清+10-6mol/L地塞米松+0.5 μmol/L甲基黄嘌呤+ 5 ng/ml胰岛素+60 μmol/L吲哚美辛+10-4mol/L氢化可的松),对照组仅加入普通培养液,培养1周后,PBS洗涤,以10%多聚甲醛固定,加入1 ml油红O工作液,用60%异丙醇去除多余染液,蒸馏水洗涤5 min后,显微镜下观察。
结 果
1 组织切片 石蜡包埋组织后切片,进行HE染色,显示肿瘤由大量脂肪细胞、厚壁血管及平滑肌组成,符合经典型RAML的组织学特点,见图1。
2 细胞形态 贴壁培养1 d后,去除培养液中的悬浮细胞,即可见小簇状生长的细胞,培养4 d后,细胞即达到90%融合,1代后细胞形态即均一,显示为典型的纺锤样外观。见图2。
3 细胞表型 对数生长期的细胞抗体标记后进行流式细胞术检测,该细胞不表达CD14、CD31、CD34、CD45、CD144等造血细胞或内皮细胞表面标志,而表达间充质干细胞表面标志如CD29、 CD44、CD73、CD90、CD105等。见图3。
4 细胞多向分化功能 成骨诱导后,细胞逐渐由纺锤样外观转变为扁平形状,胞体宽大,碱性磷酸酶染色可见大量细胞内碱性磷酸酶表达,对照组为阴性。细胞进行脂肪诱导分化后,细胞内逐渐出现细小脂滴,1周后油红染色可见明显细胞内脂滴形成,对照组为阴性。见图4。
讨 论
间充质干细胞是来源于中胚层的具有自我更新和多向分化潜能的干细胞,几乎存在于人体所有组织。MSC具有向成骨细胞、软骨细胞及脂肪细胞分化的能力,此外还能分化产生成肌细胞、内皮细胞、周细胞、成纤维细胞等间质细胞,最近研究认为MSC甚至可以向非间质性细胞分化,如分化成上皮细胞、肝细胞、神经细胞[4]。本研究从手术切除的标本中分离培养出的贴壁细胞具备传统MSC的形态特征,细胞表型分析与骨髓来源的MSC类似。多向分化功能是MSC重要的功能特征,体外分化研究表明,该类细胞经成骨分化培养液诱导后,能够表达碱性磷酸酶,在脂肪诱导分化培养体系中细胞内会出现脂滴,表明此类细胞具有向成骨、脂肪细胞分化的潜能,符合MSC的多向分化功能特征。由于MSC的多向分化性,并且其产生的间质是肿瘤的重要组成部分,因此其与肿瘤的发生、生长的关系受到重视。研究发现,MSC产生的间质促进肿瘤的生长、转移,全身注射MSC会向肿瘤部位聚集并通过自分泌和旁分泌方式促进肿瘤生长、转移[4]。值得注意的是,MSC本身即具有致瘤作用,比如Ewing's肉瘤就起源于MSC,因为肿瘤来源的细胞能够分化成骨、脂肪组织[5]。此外,Wilms瘤细胞系也与MSC表型高度类似,并同样具有MSC的多样分化功能[6]。体外培养的食蟹猴MSC在长期传代后可以发生自发转化。转化后的MSC具有很强的致瘤性,注射入非肥胖糖尿病/重症联合免疫缺陷(NOD/SCID)小鼠皮下后会形成肿瘤[7]。
目前,MSC研究主要集中在恶性肿瘤发生发展、组织工程、组织器官移植、造血发育等方面,很少关注其在良性肿瘤中的存在以及发挥的作用[8]。既往研究发现几乎所有成体组织中的MSC都位于血管旁,甚至有研究发现血管周细胞即具有MSC的表型和功能特征,如周细胞体内和体外可以分化为血管平滑肌细胞、成纤维细胞、脂肪细胞、软骨细胞、成骨细胞[9-11]。因此我们推测,RAML中的MSC可能位于血管壁中,研究发现,MSC可以通过多种途径促进新生血管形成进而促进肿瘤生长。MSC能够产生、分泌多种血管生成因子如VEGF-A、血管生成素、EGF、KGF、IGF-1、凝集素-1等,并通过募集内皮细胞促进新生血管成熟[12-13]。此外,MSC自身可以分化为内皮样细胞,直接参与肿瘤血管的形成[14]。

图 1 RAML石蜡切片(HE, ×40)图 2 RAML组织中分离的贴壁细胞(×10)Fig. 1 HE-stained paraffin sections of renal angiomyolipoma(HE, ×40)Fig. 2 Adherent cells isolated from renal angiomyolipoma tissue(×10)

图 3 流式细胞术检测细胞表型Fig. 3 Flow cytometry showing MSC phenotypes
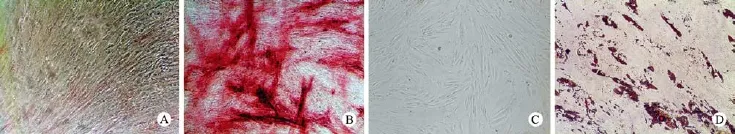
图 4 细胞成骨分化和脂肪分化(×20) A:成骨分化对照ALP染色; B: 成骨分化ALP染色; C: 脂肪分化对照; D: 脂肪分化油红O染色Fig. 4 ALP staining showing osteogenesis (A, B) and adipogenesis (C), and oil red-O staining showing adipogenesis(D)
目前已在正常肾组织中发现了多种干细胞。自妊娠晚期的肾发生区域可分离出多能的胚胎干细胞,从人类胚胎和正常啮齿类肾中发现了具有间质表型的干细胞[15-16]。正常成人肾皮质中分离出的CD133+肾细胞表达胚胎肾标志PAX-2,表明其来源于肾。这类细胞能够扩增并具有一定的自我更新能力,在体外可以分化为上皮或内皮细胞,接种SCID小鼠体内可形成肾小管样结构,表达肾上皮标志[17]。Sagrinati等[18]自肾小囊中分离出多能的CD133+/CD24+细胞,具有自我更新潜能和很强的克隆形成能力,可以被诱导产生成熟的功能性肾小管细胞、成骨细胞、脂肪细胞、神经元细胞,植入急性肾衰的SCID小鼠体内可再生肾小管样结构。
自肾癌组织中发现的CD133+/CD34-细胞,其数量很少,不到整个肾癌组织的1%[19]。但肾癌的肿瘤干细胞并非来源于正常肾的CD133+细胞,而是源于分化阶段更早期的具有间质表型的细胞,其具有自我更新能力、克隆形成能力、体内成瘤能力,并具有多向分化功能,不仅能产生肿瘤的上皮成分,也能产生肿瘤的内皮细胞[20]。自肾癌组织中分离出的CD105+细胞,在SCID小鼠体内具有100%成瘤功能,并且表达CD44、CD90、CD146、CD73、CD29、波形蛋白等MSC标志,以及Nanog、Oct4、Musashi、Nestin、Pax2等干细胞标志,体外可以分化为上皮和内皮细胞,因此认为肾癌干细胞具备MSC表型特征,这也与肾的间质起源相符合[21]。2010年Park研究小组发现肾包膜组织中存在MSC样细胞,该细胞群在肾包膜中的密度为0 ~ 10个/mm2,其具有自我更新能力并能多向分化,能够向缺血的肾间质以30μm/h的速度移动,体外传代50代以上仍保持增殖能力。研究认为,肾包膜中的MSC样细胞在肾损伤修复中发挥作用[22]。我们注意到,临床上几乎所有RAML均为外生性生长(即肿瘤大部分体积突出于肾包膜)。这提示我们,RAML很可能从肾包膜或者浅表肾皮质发生,而这一区域经Park证实为富含MSC的区域,这与我们的发现不谋而合,因此我们推测,RAML的发生可能起源于MSC。
综上所述,自RAML中分离出的MSC可能在RAML形成中发挥重要作用。明确RAML的发病原因,能够为RAML的预防及治疗提供新的思路。但MSC的来源以及在RAML中的定位,其具体在RAML发生中的作用,都需要进一步的研究。
1 Steiner MS, Goldman SM, Fishman EK, et al. The natural history of renal angiomyolipoma[J]. J Urol, 1993, 150(6): 1782-1786.
2 Eble JN. Angiomyolipoma of kidney[J]. Semin Diagn Pathol,1998, 15(1):21-40.
3 Lienert AR, Nicol D. Renal angiomyolipoma[J]. BJU Int, 2012,110(S4):25-27.
4 Cuiffo BG, Karnoub AE. Mesenchymal stem cells in tumor development: emerging roles and concepts[J]. Cell Adh Migr,2012, 6(3): 220-230.
5 Johann PD, Vaegler M, Gieseke F, et al. Tumour stromal cells derived from paediatric malignancies display MSC-like properties and impair NK cell cytotoxicity[J]. BMC Cancer, 2010, 10: 501.
6 Li H, Fan X, Kovi RC, et al. Spontaneous expression of embryonic factors and p53 point mutations in aged mesenchymal stem cells: a model of age-related tumorigenesis in mice[J]. Cancer Res, 2007,67(22): 10889-10898.
7 Ren Z, Wang J, Zhu W, et al. Spontaneous transformation of adult mesenchymal stem cells from cynomolgus macaques in vitro[J]. Exp Cell Res, 2011, 317(20): 2950-2957.
8 孙圣坤,徐阿祥,张旭.肾脏血管平滑肌脂肪瘤的诊断及治疗进展[J].微创泌尿外科杂志,2013,2(3):213-216.
9 Crisan M, Yap S, Casteilla L, et al. A perivascular origin for mesenchymal stem cells in multiple human organs[J]. Cell Stem Cell, 2008, 3(3): 301-313.
10 Covas DT, Panepucci RA, Fontes AM, et al. Multipotent mesenchymal stromal cells obtained from diverse human tissues share functional properties and gene-expression profile with CD146+ perivascular cells and fibroblasts[J]. Exp Hematol, 2008, 36(5):642-654.
11 Kida Y, Duffield JS. Pivotal role of pericytes in kidney fibrosis[J]. Clin Exp Pharmacol Physiol, 2011, 38(7): 467-473.
12 Oskowitz AZ, Penfornis P, Tucker A, et al. Drosha regulates hMSCs cell cycle progression through a miRNA Independent mechanism[J]. Int J Biochem Cell Biol, 2011, 43(11): 1563-1572.
13 Suzuki K, Sun R, Origuchi M, et al. Mesenchymal stromal cells promote tumor growth through the enhancement of neovascularization[J]. Mol Med, 2011, 17(7/8): 579-587.
14 Razban V, Lotfi AS, Soleimani M, et al. HIF-1α overexpression induces angiogenesis in mesenchymal stem cells[J]. Biores Open Access, 2012, 1(4): 174-183.
15 Pleniceanu O, Harari-Steinberg O, Dekel B. Concise review:Kidney stem/progenitor cells: differentiate, sort out, or reprogram?[J]. Stem Cells, 2010, 28(9):1649-1660.
16 O’neill JD, Freytes DO, Anandappa AJ, et al. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney[J]. Biomaterials,2013, 34(38): 9830-9841.
17 Bussolati B, Bruno S, Grange C, et al. Isolation of renal progenitor cells from adult human kidney[J]. Am J Pathol, 2005, 166(2):545-555.
18 Sagrinati C, Netti GS, Mazzinghi B, et al. Isolation and characterization of multipotent progenitor cells from the Bowman’s capsule of adult human kidneys[J]. J Am Soc Nephrol, 2006, 17(9):2443-2456.
19 Bruno S, Bussolati B, Grange C, et al. CD133+renal progenitor cells contribute to tumor angiogenesis[J]. Am J Pathol, 2006, 169(6):2223-2235.
20 Bussolati B, Brossa A, Camussi G. Resident stem cells and renal carcinoma[J/OL]. http://dx.doi.org/10.4061/2011/286985
21 Bussolati B, Bruno S, Grange C, et al. Identification of a tumorinitiating stem cell population in human renal carcinomas[J]. FASEB J, 2008, 22(10): 3696-3705.
22 Park HC, Yasuda K, Kuo MC, et al. Renal capsule as a stem cell niche[J]. Am J Physiol Renal Physiol, 2010, 298(5): F1254-F1262.
Isolation and identifcation of mesenchymal stem cells in renal angiomyolipoma
SUN Sheng-kun, XU Yong, SONG Er-lin, GUO Gang, CHEN Guang-fu, FU Wei-jun, XU A-xiang, ZHANG Xu
Department of Urinary Surgery, Chinese PLA General Hospital, Beijing 100853, China
XU A-xiang. Email:xuaxiang301@sina.com
ObjectiveTo establish whether mesenchymal stem cells (MSC) exist in classic renal angiomyolipoma (RAML) tissue.MethodsRAML tissue samples were taken from 8 patients during surgery, washed in PBS, hydrolyzed in collagenase, and incubated in adherent and passage culture. Their phenotype, parallel in vitro osteogenesis, and fat tissue differentiation were detected by fow cytometry.ResultsMSC-characterized adherent cells, isolated from the RAML tissue samples, did not express the surface markers of blood cells or endothelial cells such as CD14, CD31, CD34, CD45, and CD144, but expressed the surface markers of MSC such as CD29, CD44, CD73, CD90, and CD105, and could differentiate into osteogenic and fat tissue after incubated in vitro.ConclusionThere exist a group of cells with morphology phenotype and features of MSC, and MSC are closely related with the development of RAML.
kidney; angiomyolipoma; mesenchymal stem cells; etiology; cell differentiation; hamartoma
R 342
A
2095-5227(2014)07-0751-04
10.3969/j.issn.2095-5227.2014.07.029
时间:2014-03-19 08:31
http://www.cnki.net/kcms/detail/11.3275.R.20140417.1506.009.html
2013-11-04
孙圣坤,男,博士,副主任医师。研究方向:泌尿生殖系统干细胞。Email:ssk301@sina.com
徐阿祥,男,硕士,副主任医师。Email:xuaxiang301@sina.com

