人类白细胞抗原G在宫颈癌组织中的表达及临床意义
王元芬,牛子儒,郭一帆,谷 芳,刘忠宇,姚元庆
解放军总医院 妇产科,北京 100853
人类白细胞抗原G在宫颈癌组织中的表达及临床意义
王元芬,牛子儒,郭一帆,谷 芳,刘忠宇,姚元庆
解放军总医院 妇产科,北京 100853
目的 探讨人类白细胞抗原G(human leukocyte antigen G,HLA-G)在宫颈癌组织中的表达及其临床意义。方法应用S-P免疫组织化学方法检测于2006年1月- 2011年12月就诊我院的98例宫颈鳞癌患者术后病理标本,并分析HLA-G的表达与病理参数之间的关系。结果HLA-G分子在宫颈癌组织中表达率为43.9%(43/98),而在癌旁正常宫颈组织的表达率为0。HLA-G分子表达与淋巴结转移、脉管浸润有相关性(P<0.01)。结论HLA-G分子在宫颈癌组织中表达上调,并与宫颈癌的侵袭性生长相关。HLA-G分子参与肿瘤细胞免疫逃逸过程,促进肿瘤的发生和发展。
宫颈癌;人类白细胞抗原G;免疫组织化学
肿瘤微环境中有多种分子参与肿瘤细胞免疫逃逸过程,例如血管内皮生长因子(vascular endothelial growth factor,VEGF)、白细胞介素-10(interleukin-10,IL-10)、转化生长因子-P(transforming growth factor-p,TGF-p)、前列腺素等[1]。近年来,人白细胞抗原G(human leukocyte antigen G,HLA-G)逐渐成为肿瘤免疫逃逸的研究热点。HLA-G最早发现其特异性表达于母胎界面绒毛膜外滋养层细胞,在妊娠过程中,阻止母体对同种半异体的胎儿进行免疫排斥反应,维持妊娠。近年来多项研究发现,HLA-G分子亦表达于黑色素瘤、乳腺癌、肺癌等30余种肿瘤细胞表面,提示HLA-G分子可能在肿瘤细胞的免疫逃逸中发挥重要作用[2-7]。然而,HLA-G分子在宫颈癌组织中的表达尚不十分清楚。本研究旨在分析HLA-G分子在宫颈癌组织中的表达与病理参数之间的关系。
材料和方法
1 病例及标本来源 98例组织标本均为2006年1月- 2011年12月就诊于本院并行宫颈癌根治术患者,根据2009年国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)指南均诊断为ⅠB ~ ⅡA期,术前未行放、化疗。宫颈癌组织蜡块经病理学证实组织类型为宫颈鳞癌。同时取20例宫颈癌旁3 ~ 5 cm宫颈组织,经病理学证实无癌细胞浸润。HLA-G表达阳性对照标本取自解放军总医院计划生育门诊3例孕妇(孕8 ~ 12周)行人流术后绒毛组织,石蜡包埋成组织蜡块。
2 试剂 鼠抗人HLA-G单抗,购自LifeSpan BioScience公司。即用型小鼠SP-9002检测试剂盒购自北京中杉金桥生物技术有限公司。
3 免疫组织化学S-P法检测HLA-G表达 切片脱蜡,二甲苯(Ⅰ)10 min→二甲苯(Ⅱ)10 min→100%乙醇2 min→95%乙醇2 min→80%乙醇2 min→蒸馏水浸洗2次,将切片放置高压锅中。抗原修复:加热蒸馏水至270℃煮沸,切片置于高压锅中,待安全阀门抬起后,盖上散气阀,待散气阀转动后,降至100℃ 2.5 min,关闭电源,置于冷水中,冷却15 min。蒸馏水浸洗切片2次。消除内源性过氧化物酶:切片置于30% H2O2浸泡15 min,蒸馏水充分浸洗3次。PBS浸洗3次,每次5 min。滴加鼠抗人HLA-G蛋白单克隆抗体(工作浓度:1∶750),4℃过夜。PBS浸洗3次,每次5 min,滴加生物素标记的二抗,37℃孵育20 min,PBS浸洗3次,每次5 min。DAB显色,自来水充分冲洗,苏木素染液,冲冼,水溶性树脂胶进行封片。
4 实验结果判定 将癌细胞膜或细胞质内出现棕黄色显色定为阳性表达,每张切片由两名经验丰富的病理医师分别判定。
5 统计学处理 应用SPSS19.0软件进行处理。计数资料用χ2检验,P<0.05为差异有统计学意义。
结 果
1 HLA-G在组织中的表达 在98例宫颈癌组织中,43例HLA-G分子表达阳性,表达率为43.9% (43/98),主要定位于细胞质或细胞膜上。而在20例癌旁正常宫颈组织中无HLA-G分子的表达。见图1 ~图4。
2 HLA-G分子表达与病理参数之间的关系 98例宫颈癌组织中,HLA-G分子阳性表达率与分化、宫颈肌层浸润无关(P>0.05),与淋巴结转移、脉管浸润相关(P<0.01)。见表1。
讨 论
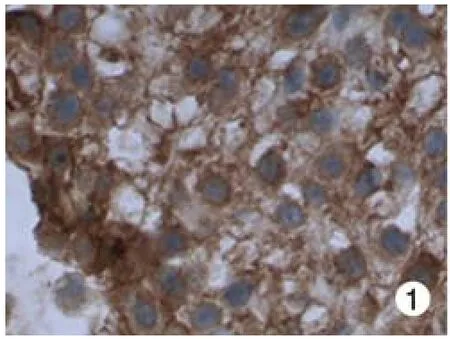
图 1 HLA-G在绒毛膜组织的表达(×200,阳性对照)Fig. 1 Expression of HLA-G in chorionic tissues(×200, positive control group)

图 2 宫颈癌组织中阳性表达(×200)Fig. 2 Positive expression in cervical cancer(×200)

图 3 宫颈癌组织中阴性表达(×200)Fig. 3 Negative expression in cervical cancer(×200)

图 4 正常宫颈组织无表达(×100)Fig. 4 No expression in normal cervical tissues(×100)
多项研究证实某些肿瘤细胞表达HLA-G分子,通过与免疫细胞表面的抑制性受体结合,抑制宿主免疫功能,这可能成为肿瘤免疫逃逸机制之一[8]。目前已发现3种可结合HLA-G分子的杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptor,KIR):免疫球蛋白样转录体2(immunoglobulin-like transcripts ILT2/CD85j/leukocyte immunoglobulin-like receptors LILRB1)、免疫球蛋白样转录体4(ILT4/CD58d/LILRB2)及杀伤细胞抑制性受体(KIR2DL4/CD158d)。这3种受体特异性表达于T淋巴细胞(ILT2)、NK细胞(KIR2DL4和ILT2)、单核细胞、巨噬细胞及抗原提呈细胞(ILT2和ILT4)[9]。HLA-G分子的免疫抑制功能主要有:1)通过Fas/ FasL信号通路,诱导CD8+T细胞及CD8+NK细胞凋亡;2)抑制细胞毒性T细胞及CD8+NK细胞的细胞溶解作用;3)抑制CD4+T细胞增殖以及幼稚CD4+T细胞活化;4)HLA-G分子促使T细胞转化为调节性T细胞(regulatory T cell,Treg cell),在肿瘤中Treg细胞通过细胞间接触或分泌可溶性细胞因子(IL-10、TGF-β等)的途径,抑制肿瘤特异性CD8+CTL和CD4+T细胞的免疫活性,抑制NK细胞的杀伤作用,从而抑制机体免疫功能[10-13]。
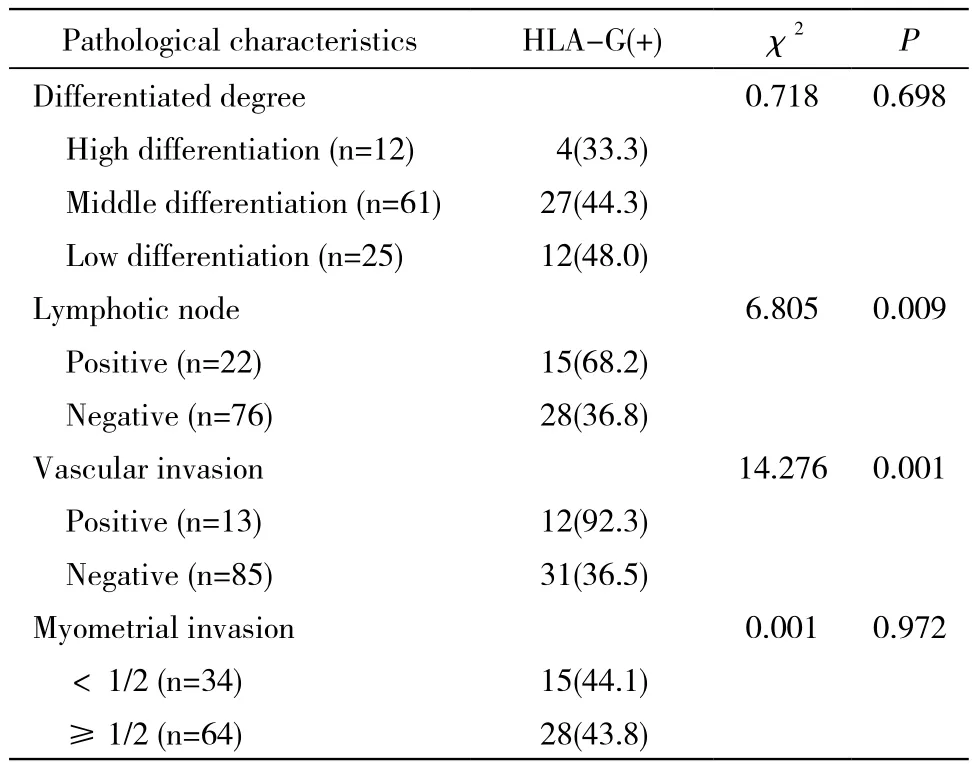
表1 HLA-G分子表达与病理参数的关系Tab. 1 Relationship between HLA-G and clinicopathological characteristics (n, %)
生理状态下,HLA-G分子表达分布具有组织特异性。最早发现HLA-G表达于母胎界面绒毛膜外滋养层细胞,参与母胎界面的免疫耐受过程,抑制母体对同种半异体的胎儿进行免疫排斥反应,维持妊娠[14]。运用RNA印记及RT-PCR证实:HLA-G mRNA广泛存在于成人组织细胞,如皮肤、脾、胸腺等。然而与经典MHC-Ⅰ类分子相比,在多数组织中检测到的HLA-G mRNA数量极少[15]。
1998年,Paul等[16]首次报道恶性黑色素瘤细胞系表达HLA-G分子。并且,在对黑色素瘤患者活检组织的研究中,在原发瘤及转移瘤组织中检测到HLA-G mRNA的转录水平和HLA-G分子表达增高,而癌旁正常皮肤组织及肿瘤坏死部位HLA-G mRNA的水平很低,且未检测到HLA-G蛋白表达。Elliott等[17]的研究中运用RT-PCR方法检测正常乳腺上皮细胞系及乳腺癌细胞系HLA-G mRNA转录水平,结果正常乳腺上皮细胞系未检测到HLA-G mRNA,而在不同的乳腺癌细胞系中HLA-G mRNA转录水平不同。Yie等[18-19]研究中发现90.9%(110/121)食管鳞癌、71%(113/160)胃癌原发部位有HLA-G分子的表达,而在正常组织中HLA-G表达阴性。Jung等[20]研究发现卵巢癌患者中HLA-G mRNA和蛋白表达水平显著高于正常卵巢组织。
本次试验结果证实,在宫颈癌组织中HLA-G分子的阳性表达率为43.9%,而癌旁正常宫颈组织中未发现HLA-G分子的表达。这与之前在其他肿瘤中发现的结论一致。HLA-G分子与宫颈癌病理参数关系研究发现,HLA-G分子的表达与淋巴结转移、脉管浸润相关,这可能成为宫颈癌转移的一个前期信号,同时进一步支持HLA-G分子免疫抑制,促进肿瘤发生、发展的结论。而郑妮等[21]研究中显示,HLA-G在宫颈癌中的表达与肿瘤分化相关,与淋巴结转移相关性无统计学意义。对比两个实验研究,结果不同可能是因为病例选择及例数不同,郑妮等试验中选择54例宫颈鳞癌及腺癌,临床分期为Ⅰ~Ⅳ期,而本实验仅选择了98例早期宫颈鳞癌,临床分期为ⅠB ~ⅡA期。亦可能是不同实验室所使用的单克隆抗体不同或敏感度不同。因此,需要更大标本量的试验进一步研究HLA-G分子在宫颈癌中的表达、作用机制及临床意义。
综上所述,可通过检测宫颈癌患者HLA-G分子的表达,评估患者的病情变化及预后。同时,HLA-G分子可作为免疫治疗的靶点,研发针对HLA-G分子特异性的抗体,阻断HLA-G分子与抑制性受体结合,从而恢复或增强机体抗肿瘤效应,改善患者预后及临床结局。
1 Kim R, Emi M, Tanabe K, et al. Tumor-driven evolution of immunosuppressive networks during malignant progression[J]. Cancer Res, 2006, 66(11): 5527-5536.
2 Mach P, Blecharz P, Basta P, et al. Differences in the soluble HLA-G blood serum concentration levels in patients with ovarian cancer and ovarian and deep endometriosis[J]. Am J Reprod Immunol, 2010, 63(5):387-395.
3 Elliott RL, Jiang XP, Phillips JT, et al. Human leukocyte antigen G expression in breast Cancer: role in immunosuppression[J]. Cancer Biother Radiopharm, 2011, 26(2): 153-157.
4 Zhu CB, Wang CX, Zhang X, et al. Serum sHLA-G levels: a useful indicator in distinguishing colorectal Cancer from benign colorectal diseases[J]. Int J Cancer, 2011, 128(3): 617-622.
5 de Kruijf EM, Sajet A, van Nes JG, et al. HLA-E and HLA-G expression in classical HLA class I-negative tumors is of prognostic value for clinical outcome of early breast cancer patients[J]. J Immunol, 2010, 185(12):7452-7459.
6 Kren L, Valkovsky I, Dolezel J, et al. HLA-G and HLA-E specific mRNAs connote opposite prognostic significance in renal cell carcinoma[J]. Diagn Pathol, 2012, 7:58.
7 Lin A, Zhu CC, Chen HX, et al. Clinical relevance and functional implications for human leucocyte antigen-g expression in non-smallcell lung Cancer[J]. J Cell Mol Med, 2010, 14(9): 2318-2329.
8 Yan WH. Human leukocyte antigen-G in Cancer: are they clinically relevant?[J]. Cancer Lett, 2011, 311(2): 123-130.
9 Yan WH. HLA-G expression in cancers: potential role in diagnosis,prognosis and therapy[J]. Endocr Metab Immune Disord Drug Targets, 2011, 11(1): 76-89.
10 Contini P, Ghio M, Poggi A, et al. Soluble HLA-A,-B,-C and -G molecules induce apoptosis in T and NK CD8+ cells and inhibit cytotoxic T cell activity through CD8 ligation[J]. Eur J Immunol,2003, 33(1): 125-134.
11 Le Gal FA, Riteau B, Sedlik C, et al. HLA-G-mediated inhibition of antigen-specific cytotoxic T lymphocytes[J]. Int Immunol, 1999,11(8): 1351-1356.
12 Bainbridge DR1, Ellis SA, Sargent IL. HLA-G suppresses proliferation of CD4(+) T-lymphocytes[J]. J Reprod Immunol,2000 , 48(1):17-26.
13 Amiot L, Ferrone S, Grosse-Wilde H, et al. Biology of HLA-G in cancer: a candidate molecule for therapeutic intervention?[J]. Cell Mol Life Sci, 2011, 68(3):417-431.
14 侯彩英.可溶性人类白细胞抗原-G在子痫前期患者的表达和临床意义[D]. 西安:第四军医大学,2008.
15 Gobin SJ, Biesta P, de Steenwinkel JE, et al. HLA-G transactivation by cAMP-response element-binding protein (CREB). An alternative transactivation pathway to the conserved major histocompatibility complex (MHC) class I regulatory routes[J]. J Biol Chem, 2002,277(42):39525-39531.
16 Paul P, Rouas-Freiss N, Khalil-Daher I, et al. HLA-G expression in melanoma: a way for tumor cells to escape from immunosurveillance[J]. Proc Natl Acad Sci U S A, 1998, 95(8):4510-4515.
17 Elliott RL, Jiang XP, Phillips JT, et al. Human leukocyte antigen G expression in breast cancer: role in immunosuppression[J]. Cancer Biother Radiopharm, 2011, 26(2):153-157.
18 Yie SM, Yang H, Ye SR, et al. Expression of HLA-G is associated with prognosis on esophageau squamous cell carcinoma[J]. Am J Clin Pathol, 2007, 128(6): 1002-1009.
19 Yie SM, Yang H, Ye SR, et al. Expression of human leukocyte antigen G (HLA-G) correlates with poor prognosis in gastric carcinoma[J]. Ann Surg Oncol, 2007, 14(10): 2721-2729.
20 Jung YW, Kim YT, Kim SW, et al. Correlation of human leukocyte antigen-G (HLA-G) expression and disease progression in epithelial ovarian Cancer[J]. Reprod Sci, 2009, 16(11): 1103-1111.
21 Zheng N, Wang CX, Zhang X, et al. Up-regulation of HLA-G expression in cervical premalignant and malignant lesions[J]. Tissue Antigens, 2011, 77(3):218-224.
Expression and clinical signifcance of human leukocyte antigen G in cervical cancer
WANG Yuan-fen, NIU Zi-ru, GUO Yi-fan, GU Fang, LIU Zhong-yu, YAO Yuan-qing
Department of Gynecology and Obstetrics, Chinese PLA General Hospital, Beijing 100853, China
YAO Yuan-qing. Email:yaoyq@126.com
ObjectiveTo investigate the expression of HLA-G molecule in cervical cancer and its clinical signifcance.MethodsPostoperative pathological samples of 98 patients with cervical cancer admitted to our hospital from January 2006 to December 2011 were detected by immunohistochemical method (S-P method), and the relationship between HLA-G and clinico-pathological characteristics in cervical cancer was analyzed.ResultsThe positive expression rate of HLA-G in cervical cancer was 43.9% (43/98),while no positive expression was found in normal tissues. The expression of HLA-G was correlated with lymphatic metastasis and vascular invasion (P<0.01).ConclusionExpression of HLA-G in cervical cancer tissues is signifcantly higher than that in normal tissues and it relates to the invasive growth of cervical cancer. It is also suggested that HLA-G molecule is closely related to immune evasion which will also promote the development of tumor.
cervical cancer; human leukocyte antigen G; immunohistochemical method
R 737.33
A
2095-5227(2014)07-0741-04
10.3969/j.issn.2095-5227.2014.07.026
时间:2014-04-18 17:38
http://www.cnki.net/kcms/detail/11.3275.R.20140418.1738.001.html
2014-04-02
北京市科技计划项目(Z131100006813023)
Supported by Beijing Science and Technology Program(Z131100006813023)
王元芬,女,硕士。研究方向:妇科肿瘤。Email:wyf1988119@163.com
姚元庆,男,博士,主任医师,教授。Email:yaoyq@126.com

