金港榄香烯与榄香烯脂质体注射液的指纹图谱研究*
谢 恬,李铖璐,徐淑媛,王 宇,杨友剑,赵 宏,刘兴元,于丽红,张涤菲,曾昭武
(1.杭州创新中药标准化研究所有限公司,杭州 310053;2.大连华立金港药业有限公司,大连 116000;3.杭州师范大学,杭州 310012)
·中药研究·
金港榄香烯与榄香烯脂质体注射液的指纹图谱研究*
谢 恬1,2,3,李铖璐3,徐淑媛1,王 宇2,杨友剑2,赵 宏2,刘兴元2,于丽红2,张涤菲2,曾昭武3
(1.杭州创新中药标准化研究所有限公司,杭州 310053;2.大连华立金港药业有限公司,大连 116000;3.杭州师范大学,杭州 310012)
[目的]通过检测金港榄香烯与榄香烯脂质体注射液的指纹图谱,考察它们的质量稳定性。[方法]分别对10批金港榄香烯与榄香烯脂质体注射液,采用气相色谱法检测其指纹图谱,采用中药指纹图谱相似度计算软件计算相似度。[结果]采用气相色谱法检测它们的指纹图谱稳定可靠,发现榄香烯和榄香烯脂质体注射液都有6个共有特征峰,各批次榄香烯和榄香烯脂质体注射液的相似度都不低于0.995。[结论]建立的金港榄香烯和榄香烯脂质体注射液指纹图谱符合要求,为不同批次产品的质量稳定性提供了保证。
榄香烯;脂质体;注射液;气相色谱;指纹图谱
榄香烯(C15H24)是一类单环结构的倍半萜烯类化合物,是从郁金等传统中药中发现的抗肿瘤活性成分[1],其中β-榄香烯是主要活性成分。榄香烯对多种肿瘤具有确切疗效,无明显毒副作用[2]。金港榄香烯脂质体注射液采用循证医学系统评价证实榄香烯脂质体注射液安全有效,且可延长生存期、改善生活质量、抗肿瘤转移复发[3-7]。为了保证榄香烯和榄香烯脂质体注射液的质量并对产品质量实施有效的监控,对金港榄香烯和榄香烯脂质体注射液的指纹图谱进行研究,具有非常重要的实际意义和应用价值。
1 实验材料
1.1 仪器 Agilent6890N气相色谱仪,HP-5(30mm×0.32 mm,0.25 μm)弹性石英毛细管柱,FID检测器(美国Agilent公司),DF-101S集热式恒温加热搅拌器(河南省予华仪器有限公司)。
1.2 试药与试剂 将采自瑞安境内不同地域(下林、岱西、八甲、绿屿、登阳、涂头、东川、四甲、马屿、焦炕村)的温莪术药材提取的莪术油10批进行精馏,获得原料药榄香烯10批。将该10批榄香烯小试制备榄香烯脂质体注射液。药材采集地、榄香烯和榄香烯脂质体注射液编号一一对应。β-榄香烯对照品(纯度97%)、空白制剂与榄香烯脂质体注射液(由大连华立金港药业有限公司提供)。甲醇、乙酸乙酯为色谱纯,无水硫酸钠、丙酮等为分析纯。
2 实验方法与结果
2.1 色谱条件 色谱条件根据指纹图谱技术要求,参考文献[8-17],研究发现,榄香烯、榄香烯注射液的指纹图谱应与温莪术、莪术油指纹图谱具有相关性,由于需要比较这几种物质的相关性,因此4种物质的指纹图谱色谱条件最好尽量一致,经反复的筛选,确定仪器条件如下:HP-5色谱柱(30 mm×0.32 mm,0.25 μm),检测器温度250℃,进样口温度150℃,载气为氮气,氮气流速:1.0 mL/min,氢气:40 mL/min,空气:400 mL/min,分流比为20∶1,柱温采取程序升温,起始温度125℃,保持8 min,以5℃/min的速率升温至90℃,保持14 min,再以10℃/min的速率升温至115℃,然后以1℃/min的速率升温至130℃,保持25 min,以2℃/min的速率升温至140℃,保持30 min,以10℃/min的速率升温至260℃,进样量1 μL,理论板数按β-榄香烯峰计算不得低于10000。
2.2 对照品溶液的制备 将β-榄香烯对照品用甲醇溶解,稀释后进样分析。榄香烯、榄香烯脂质体注射液中主要有效成分是β-榄香烯,且是榄香烯、榄香烯脂质体注射液共有,积分面积在指纹图谱中比例较大而稳定,因此采用β-榄香烯作为参照物。
2.3供试品溶液制备 1)取10批榄香烯作为供试品,分别取100 μL用乙酸乙酯稀释至1 mL,即得榄香烯供试品溶液。定量吸取1 μL后进样分析。2)取各批次榄香烯脂质体注射液2 ml,置10 ml刻度试管中,加无水硫酸钠0.8 g,振摇使溶解,置60℃水浴破乳5 min,取出,放冷至室温,加丙酮至10 mL,强力振摇使完全溶解,静置,取上清液作为榄香烯脂质体注射液供试品溶液。
2.4 空白脂质体注射液溶液和空白溶剂实验 取空白脂质体注射液2 mL,同“供试品溶液制备”项下操作,进样。取空白溶剂丙酮,进样。结果表明,空白注射液在25~47 min间无色谱峰出现,空白注射液在该色谱条件下对供试品指纹图谱无干扰,见图1。丙酮溶剂在25~47 min间无色谱峰,说明丙酮溶剂在该色谱条件下对供试品指纹图谱无干扰,见图2。

图1 空白脂质体溶液气相色谱图谱Fig.1 Gas chromatogram of blank liposome solution

图2 空白溶剂-丙酮气相色谱图谱Fig.2 Gas chromatogram of acetone as blank solvent
2.5 稳定性实验 1)取榄香烯适量,制备供试品溶液,分别于0、2、3、4、5、11 h重复进样5次,记录各共有特征峰保留时间和积分峰面积。以β-榄香烯为参照峰(S),换算出各共有峰的相对保留时间和相对峰面积,结果发现共有特征峰的相对保留时间的相对标准偏差(RSD)分别为0.008%,0.006%,0.000%,0.008%,0.007%,0.007%,相对峰面积的RSD分别为 0.722%,0.878%,0.000%,0.228%,0.427%,0.116%,均小于3%,说明整个检测系统稳定性良好,样品在11 h内稳定,符合要求。2)取榄香烯脂质体注射液供试品溶液,分别于0、1、2、3、4、9、10、11、12 h进样分析。结果表明各共有特征峰的相对保留时间的RSD分别为0.0178%,0.0141%,0.0000%,0.0118%,0.0137%,0.0117%,相对峰面积的RSD分别为0.6952%,0.3412%,0.0000%,0.1782%,0.6593%,0.3548%,RSD均小于3%,说明供试品在12 h内稳定,符合要求。
2.6 精密度实验 取金港榄香烯、榄香烯脂质体注射液,制备供试品溶液,分别连续进样5次,分析。结果表明,榄香烯或榄香烯脂质体注射液共有峰的相对保留时间和相对峰面积基本一致,榄香烯相对保留时间的RSD分别为0.003%,0.003%,0.000%,0.003%,0.003%,0.002%,相对峰面积的RSD分别为0.739%,0.847%,0.000%,0.251%,0.476%,0.116%。榄香烯脂质体注射液相对保留时间的RSD分别为0.018%,0.013%,0.000%,0.012%,0.014%,0.013%,相对峰面积的RSD分别为0.887%,0.344%,0.000%,0.142%,0.886%,0.267%。RSD均小于3%,精密度良好,符合要求。
2.7 重现性实验 取同一批金港榄香烯和榄香烯脂质体注射液各5份,制备供试品溶液后检测,结果发现金港榄香烯和榄香烯脂质体注射液中各共有峰的相对保留时间及相对峰面积基本一致,榄香烯相对保留时间的RSD分别为0.022%,0.019%,0.000%,0.016%,0.022%,0.021%,相对峰面积的RSD分别为0.840%,0.644%,0.000%,0.221%,0.342%,0.216%;榄香烯脂质体注射液相对保留时间的RSD分别为0.046%,0.042%,0.000%,0.039%,0.046%,0.042%,相对峰面积的RSD分别为0.946%,1.396%,0.000%,1.241%,0.838%,0.788%。RSD均小于3%,重现性良好,符合要求。
2.8 指纹图谱选择及特征峰的标定 根据金港榄香烯10批供试品气相色谱图,选择代表样品(3)作为对照指纹图谱。并以10批供试品气相色谱图谱所给出的相关参数,在该色谱条件下得出所有成分的色谱峰,且在47 min内全部出完。比较各批供试品色谱图发现6个色谱峰是各批共有,从而确定它们为共有特征峰。指纹图谱显示共有特征峰应有6个。相对保留时间(峰序号)依次为:0.9061(1),0.9851(2),1(S),1.0439(3),1.0623(4),1.0709(5)。相对峰面积(峰序号)依次为0.0297±0.0131(1),0.0392± 0.0049(2),1.0000(S),0.1153±0.0214(3),0.0155± 0.0109(4),0.0530±0.0320(5)。详见图3。10批供试品,以β-榄香烯峰为参照峰,计算各指纹峰的相对峰面积、相对保留时间,结果表明原料药中β-榄香烯峰面积占80%以上,而其他几个峰均小于10%,因此峰面积比值不作要求,但相对保留时间比较固定,其RSD小于3%,符合要求。

图3 金港榄香烯(3)气相色谱指纹图谱Fig.3 Gas chromatographic fingerprint of Kingkong elemene(3)
同上,根据金港榄香烯脂质体注射液10批供试品气相色谱图,选择代表样品(1)作为对照指纹图谱。比较各批供试品的色谱图发现6个色谱峰是各批样品共有,从而确定它们为共有特征峰,见图4。6个共有特征峰的相对保留时间(峰序号)依次为:0.9063(1),0.9853(2),1.0000(S),1.0440(3),1.0625(4),1.0710(5);相对峰面积(峰序号)依次为:0.0300±0.0134(1),0.0395±0.0049(2),1.0000(S),0.1141±0.0208(3),0.0154±0.0108(4),0.0493± 0.0301(5)。结果表明,注射液主成分中β-榄香烯峰面积占80%以上,而其他几个峰均小于10%,因此峰面积比值不作要求,但相对保留时间比较固定,其RSD小于3%,符合要求。

图4 金港榄香烯脂质体注射液(1)气相色谱指纹图谱Fig.4 Gas chromatographic fingerprint of Kingkong elemene liposomal injection(1)
2.9 指纹图谱相似度及图谱 以共有模式为参照,采用中药指纹图谱相似度计算软件计算,得到各批次金港榄香烯指纹图谱的相似度和图谱,见表1、图5。结果表明各批次金港榄香烯指纹图谱的相似度均大于0.997。同上,计算得到各批次金港榄香烯脂质体注射液指纹图谱相似度和图谱,见表2、图6,结果表明各批次金港榄香烯脂质体注射液指纹图谱的相似度均大于0.997。
3 讨论
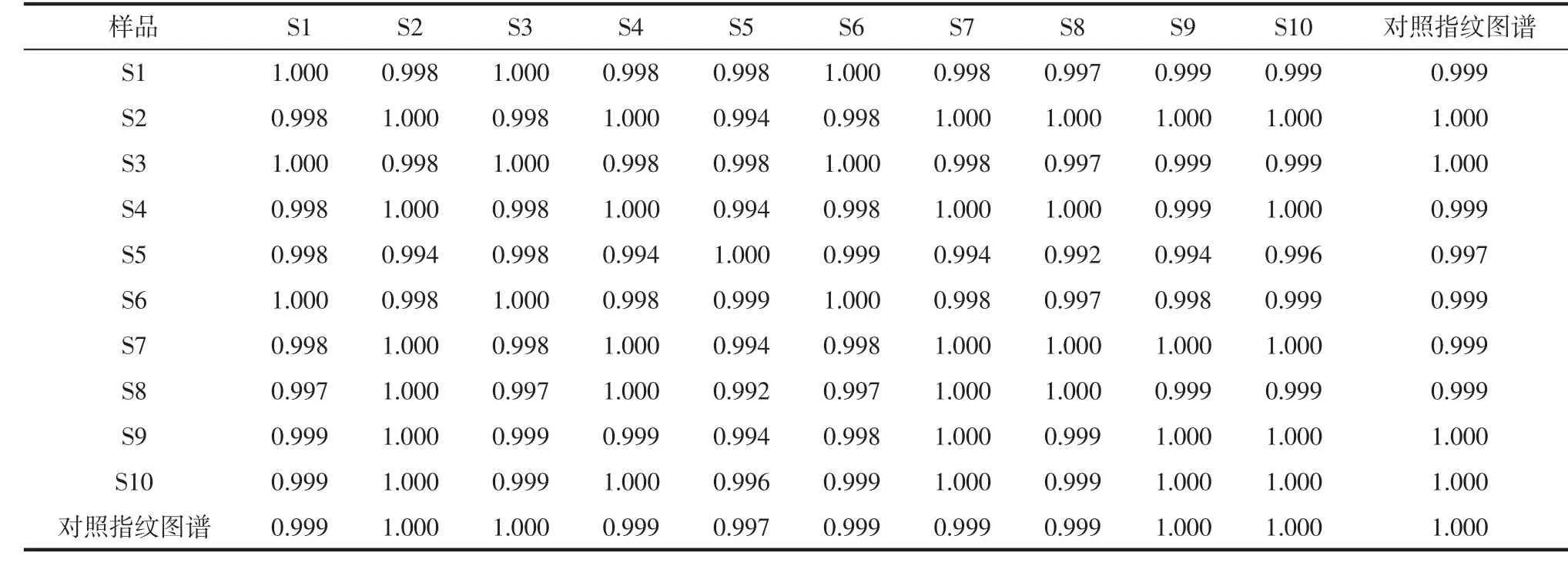
表1 10批金港榄香烯指纹图谱相似度计算结果Tab.1 The results of fingerprint similarity of 10 batches of Kingkong elemene
目前,对榄香烯脂质体注射液中榄香烯的含量测定主要是气相色谱法[18-19]。气相色谱法特别适用于含挥发性成分药材和制剂的指纹图谱研究,具有简单易行、可比性强、灵敏度高、分析速度快、分离度好等优点[20]。根据前期实验研究结果,确定了榄香烯脂质体注射液、榄香烯的最优检测条件、分析方法,采用气相色谱法检测,样品的稳定性、精密度和重现性良好。对金港榄香烯、榄香烯脂质体注射液进行气相色谱分析,结果如图3、4,发现金港榄香烯脂质体注射液各特征峰均可在原料药金港榄香烯指纹图谱中得到追踪,说明具有相关性,证明了金港榄香烯脂质体注射液药物的质量稳定可靠。经大连华立金港药业有限公司质量控制部门跟踪回顾性试验得榄香烯原料药、榄香烯脂质体注射液相似度均在0.996以上。本研究按照《中药注射剂色谱指纹图谱试验研究操作规程指南(试行)》的规定,采用相似度计算软件进行计算,得到能全面、准确地反映榄香烯脂质体注射液、原料药质量情况的指纹图谱,比采用单一成分的含量作为质量控制指标更全面。对榄香烯脂质体注射液、原料药进行质量控制,建立指纹图谱保证产品质量的稳定,为保证不同批次产品的质量控制提供了科学依据,为中药注射制剂规范化生产、走向国际市场奠定了基础。

图6 10批金港榄香烯脂质体注射液气相色谱指纹图谱Fig.6 The gas chromatographic fingerprints of 10 batches of Kingkong elemene liposomal injection
[1]时继慧,李成章,刘德兰,等.温莪术挥发油的实验药理研究β-榄香烯的抗肿瘤作用的研究[J].中药通报,1981,5(6):36-38.
[2] 杨 骅,王仙平,郁琳琳,等.榄香烯抗癌作用与诱发肿瘤细胞凋亡[J].中华肿瘤杂志,1996,18(3):169-172.
[3]谭平国,钟伟健,蔡望清,等.持续灌注榄香烯(elemene)治疗恶性脑肿瘤[J].中国肿瘤临床,2001,28(9):682-686.
[4] 王怀瑾,赵金波,杨晓燕,等.榄香烯治疗脑转移癌的临床疗效观察[J].大连医科大学学报,1999,1(2):111-114.
[5]闫 涛,黄惠玲,杨栓雀.榄香烯乳和放疗联合治疗晚期宫颈癌疗效观察[J].陕西肿瘤医学,1999,7(3):167-169.
[6] 侯菊生,徐英辉,陈玉仁,等.榄香烯治疗颅内恶性肿瘤临床研究[J].中华神经外科杂志,1994,10(4):225-228.
[7] Wang B,Peng XX,Sun R,et al.Systematic review of β-elemene injection as adjunctive treatment for lung cancer[J].Chin J Integr Med.2012,18(11):813-823.
[8]王世勇,宋力飞,黄晓玲,等.郁金的指纹图谱研究[J].中药新药与临床药理,2004,15(6):406-409.
[9] 周玉新.中药指纹图谱研究技术[M].北京:化学工业出版社, 2002:16.
[10]潘赞红.中药指纹图谱质控技术的现状与发展[J].天津中医药,2004,21(1):87-89.
[11]黄海燕.蒲黄及炒蒲黄指纹图谱的初步研究[J].天津中医药,2007,24(2):153-155.
[12]唐 铖,张铁军,刘昌孝.基于PCR技术的中药指纹图谱研究[J].天津中医药大学学报,2007,26(2):23-25.
[13]窦志英.陕西产延胡索药材的HPLC指纹图谱研究[J].天津中医药大学学报,2007,26(3):38-42.
[14]窦志英.炒马钱子的HPLC指纹图谱研究[J].天津中医药大学学报,2005,24(4):201-203.
[15]陈爱瑛,徐世芳,姜丽霞.温郁金指纹图谱共有模式的建立[J].中国现代应用药学杂志,2007,24(4):269-271.
[16]杨丰庆,李绍平,陈 莹,等.中药莪术GC-MS指纹图谱研究[J].药学学报,2005,40(11):1013-1018.
[17]周 欣,陈华国,赵 超,等.蓬莪术药材的指纹图谱研究[J].时珍国医国药,2008,19(6):1359-1360.
[18]孙 弘,廉晓红.β-榄香烯和γ-榄香烯稳定性研究 [J].沈阳化工,1999,28(3):11-12.
[19]李庆民,孙苓苓,刘德君.GC法测定榄香烯注射液中的有效成分[J].沈阳药科大学学报,1997,14(2):118-119.
[20]曾建红.广西莪术挥发油GC-MS指纹图谱的构建及其谱效关系的研究[D].长沙:中南林业科技大学,2007:8-9.
Study on fingerprint of Kingkong Elemene and Elemene liposomal injection
XIE Tian1,2,3,LI Cheng-lu3,XU Shu-yuan1,WANG Yu2,YANG You-jian2,ZHAO Hong2,LIU Xing-yuan2,YU Li-hong2,ZHANG Di-fei2, ZENG Zhao-wu3
(1.Hangzhou Innovation TCM Standardization Research Institute Co.,Ltd.,Hangzhou 310053,China;2.Dalian Holley Kingkong Pharmaceutical Co.,Ltd.,Dalian 116000,China;3.Hangzhou Normal University,Hangzhou 310012,China)
[Objective]To detect the fingerprint of Kingkong Elemene and Elemene liposomal injection for observing their quality stability.[Methods]The fingerprints of 10 batches of Kingkong Elemene and Elemene liposomal injection were detected by gas chromatography(GC),and their similarity was calculated by the fingerprint similarity calculation software of traditional Chinese medicine(TCM).[Results]The GC method for detecting their fingerprint was stable and reliable.Six common characteristic peaks were all found in Kingkong Elemene and Elemene liposomal injection.The fingerprint similarity of these batches of Kingkong Elemene or Elemene liposomal injection was not lower than 0.995.[Conclusion]The resulted fingerprint of Kingkong Elemene and Elemene liposomal injection meet the requirements,and provide a guarantee for the quality stability of different batches of the product.
Elemene;liposome;injection;gas chromatography;fingerprin
R284
:A
:1672-1519(2014)05-0301-05
2013-12-08)
(本文编辑:高 杉,张震之)
10.11656/j.issn.1672-1519.2014.05.17
国家十二五重大新药创制科技重大专项资助项目(2011ZX09201-101-05)。
谢 恬(1961-),男,博士,教授,博士生导师,从事中药新制剂、新技术、制药工程、新药研发、GMP管理等工作。

