青蒿愈伤组织的诱导及化学成分变化规律研究*
郭新荣,李 晋,马 琳,王振中,萧 伟,常艳旭,
(1.天津市现代中药重点实验室,天津中医药大学,天津 300193;2.江苏康缘药业股份有限公司,连云港 222001)
·中药研究·
青蒿愈伤组织的诱导及化学成分变化规律研究*
郭新荣1,李 晋1,马 琳1,王振中2,萧 伟2,常艳旭1,2
(1.天津市现代中药重点实验室,天津中医药大学,天津 300193;2.江苏康缘药业股份有限公司,连云港 222001)
[目的]建立青蒿愈伤组织快速繁殖的适宜培养基,测定其生长过程中次生代谢产物奎宁酸类化合物和香豆素类化合物的含量变化。[方法]无菌条件下切取花序、叶和叶柄为外植体,接种于MS添加不同激素组合的培养基,进行诱导及继代增殖培养,测定奎宁酸类化合物和香豆素类化合物的含量。[结果]建立了青蒿花序、叶和叶柄愈伤组织快速繁殖的适宜培养基,绘制相对应的生长曲线,并确定了生长过程中次生代谢产物奎宁酸类化合物和香豆素类化合物的含量变化及最佳采收期。[结论]通过组织培养方式可以成功获得青蒿愈伤组织生长曲线和生长过程中次生代谢产物的变化规律,对传统中药青蒿培养体系优化及工业化规模生产进行探索提供了一个新途径。
青蒿;组织培养;奎宁酸;香豆素;次生代谢产物
青蒿载于西汉的《五十二病方》,为菊科黄花蒿(Artemisia annua L.)地上全草,广泛分布于中国的重庆、广西、四川、山东、江苏等省份,具有抗虐、抗病毒、抗血吸虫、抗菌,抗内毒素、活血杀菌和消炎镇痛等作用。目前,青蒿的化学成分主要包括香豆素类、奎宁酸类、黄酮类、倍半萜内酯类化合物和挥发油等。香豆素类包括莨菪亭、东莨菪内酯、香豆素、7-甲氧基香豆素等[1-3],具有解热降温等作用。奎宁酸类有绿原酸、隐绿原酸、异绿原酸A和异绿原酸B等[4-5],具有抗氧化、抗菌等作用。挥发油具有清虚热、凉血、除骨蒸、解暑等功效[6-7]。倍半萜内酯青蒿素以其高效、速效、低毒的优点被世界卫生组织称为是世界上唯一有效的抗疟药物。黄酮类化合物具有抗氧化活性等[8-11],可促进青蒿素与血晶素的反应,增强青蒿素的抗疟性。上述研究表明,青蒿化学成分具有较大的开发利用价值。
目前青蒿化学成分主要从药材全株中提取,产量受到地理环境和季节的限制,其需求量大,且有效成分含量低,不能满足市场需求。为解决这一难题,国内外学者对青蒿的育种工作进行了大量探索。其中组织培养技术以其不受自然条件限制,能加速育种进程且不破坏自然资源等优点,对青蒿新品种的培育和推广具有其他方法无法替代的优越性。焦小珂等[12]对青蒿同源四倍体的诱导及农艺性状进行评价,表明应用多倍体育种技术,可以大幅度提高药材产量,四倍体植株农艺性状较二倍体有明显的优越性。对青蒿花药培养加以研究,结果发现青蒿花药培养最适培养基是6-BA 1 mg/L+2,4-D 0.3 mg/L或6-BA1mg/L+NAA0.3mg/L,无需低温前处理和高温后处理,即可通过青蒿花药培养得到单倍体胚[13]。对青蒿丛生芽诱导影响因素加以研究,发现诱导丛生芽的激素组合是6-BA 2.0 mg/L+NAA 0.15 mg/L,青蒿丛生芽的诱导及青蒿素的生物合成可以通过理化因子有效地进行调控[14]。这些对青蒿资源开发、保护和新品种的选育都有重要意义。
本研究拟通过组织培养方式,获得青蒿愈伤组织生长曲线和生长过程中次生代谢产物的变化规律,结合超高效液相色谱(UPLC)方法,同时定量分析青蒿愈伤组织中奎宁酸类化合物和香豆素化合物类化合物,以期为青蒿愈伤组织培养的相关研究提供技术原理和工艺基础,为大规模生产青蒿次生代谢产物创造技术基础条件,同时为今后青蒿培养体系优化和综合利用的产业发展提供借鉴。
1 试剂及方法
1.1实验材料 青蒿种子取自江苏省连云港市,于天津中医药大学室外栽培得到植株。
1.2仪器与试剂 SPX-300I-G型光照培养箱(上海博讯实业有限公司医疗设备厂),LRH-250F生化培养箱(上海一恒科技有限公司),YXQ-LS-50A立式压力蒸汽灭菌器(上海博讯实业有限公司),ZXC型紫外消毒车(江苏巨光光电科技有限公司),SWCJ-2F型双面净化工作台、Waters ACQUITYTMUltra Performance LC(美国Waters公司,包括二元梯度泵、柱温箱、PDA检测器、EMPOWER化学工作站),SB-1000 YDTD超声仪(宁波新芝生物科技股份有限公司)。
新绿原酸、绿原酸、隐绿原酸、东莨菪内酯、异绿原酸B、异绿原酸A、异绿原酸C均购自中国药品生物制品检定所,甲醇(色谱纯)、乙腈(色谱纯)、水(超纯水)、甲酸(色谱级)、6-苄氨基嘌呤(天津市光复精细化工研究所),2-4-二氯苯氧乙酸(上海蓝季科技有限公司,SigmaD7299)。
1.3实验方法
1.3.1愈伤组织消毒 参照文献[15]对青蒿外植体的消毒条件,将田间栽培的青蒿,截取顶端约5~ 10 cm处生长能力较旺盛的带叶茎段及未开放花序,先将其用洗衣粉水轻轻揉搓除去表面污垢,再将其用干净的纱布包裹,置于流动自来水中冲洗2 h左右,紫外灭菌30 min,5%乙醇消毒30 s,带叶茎段用0.1%升汞灭菌10 min,然后在灭菌过的培养皿上将其切成3~5 cm的小段。未开放花序用0.1%升汞灭菌改为5 min[16]。
1.3.2愈伤组织培养 1)愈伤组织的诱导:在无菌条件下将已消毒的青蒿花序、花枝及叶片剪碎,分别接种于含2,4-D 0.1 mg/L+6-BA 0.5 mg/L培养基上[15-17],在25℃条件下避光培养15 d,诱导愈伤组织。2)继代培养:采用2,4-D 0.1 mg/L+6-BA 0.5 mg/L培养基对花愈伤组织进行继代培养,采用2,4-D0.5mg/L+6-BA 1 mg/L培基养对培养叶与叶柄愈伤组织进行继代培养,获得性状稳定的愈伤组织。
1.3.3愈伤组织的鲜质量、干质量生长倍增曲线的绘制 按已确定的最优生长培养基配方配制固体培养基,灭菌分装于培养皿中。将切好的脆散性愈伤组织称质量后接种于编号的培养皿中,记录m1。 25℃下暗培养,每3~4 d取样1次,每次取样3瓶,称取愈伤组织鲜质量,记录m2。将愈伤组织烘干至恒质量,称质量记录m3。每次取样的愈伤组织鲜质量与干质量倍增值的计算方法:
愈伤组织鲜质量倍增值F=(m2-m1)/m1
愈伤组织干质量倍增值D=m3/m2
依据愈伤组织鲜质量与干质量倍增值的平均值绘制生长曲线。
1.4愈伤组织样品处理方法 将样品置于烘箱中,60℃烘至恒重,用瓷乳钵研磨至粉末状。精密称取0.1 g样品,加10 mL 60%的甲醇,超声提取50 min,静置,以14 000 r/min,10 min离心2次,取上清液用UPLC分析方法进行化学成分测定。
1.5标准曲线的制备 精密称取新绿原酸、绿原酸、隐绿原酸、东莨菪内酯、异绿原酸B、异绿原酸A、异绿原酸C标准品,甲醇溶解后,配制各浓度混标,分别取1 μL注入UPLC,记录色谱图。以进样浓度(X)与峰面积(Y)作最小二乘法线性回归,获得回归方程。
2 结果与讨论
2.1诱导培养基的选择 选择以MS为基础培养基[15-16,18],通过对不同比例的2,4-D与6-BA组合优化,以诱导率为指标,考察了不同的培养基对外植体诱导的影响,发现MS+2,4-D0.1mg/L+6-BA0.5mg/L培养基,对青蒿叶片、叶柄和花序的诱导率为100%,见表1。因此选择MS+2,4-D 0.1 mg/L+6-BA 0.5 mg/L作为青蒿不同外植体的诱导培养基。在4~5 d时,叶片在MS+2,4-D 0.1 mg/L+6-BA 0.5 mg/L培养基上开始卷曲,叶柄在接触培养基部位出现膨大现象,花序在接触培养基部出现膨大现象,部分出现淡白色愈伤组织,7~8 d时3种外植体出现淡绿色愈伤组织小团块。
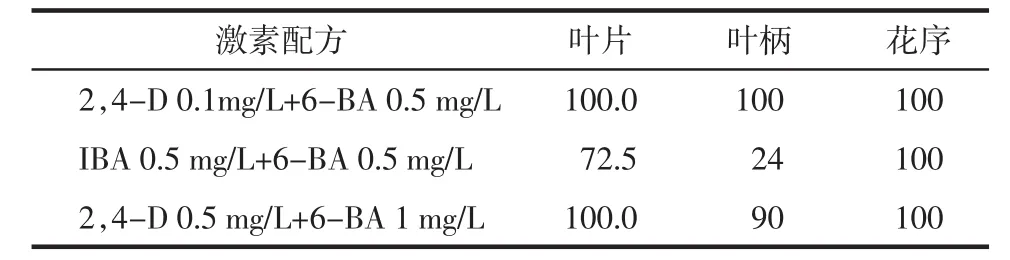
表1 不同培养基对青蒿外植体愈伤组织诱导的影响 %
2.2继代培养基的选择 以愈伤组织褐变率为指标,考察了不同培养基对不同外植体(叶、叶柄和花序)继代培养的影响,结果发现应当采用2,4-D 0.1 mg/L+6-BA 0.5 mg/L最为花序的愈伤组织继代培养基时,几乎无褐变现象,生长状态良好,因此选择2,4-D 0.1 mg/L+6-BA 0.5 mg/L作为花序的愈伤组织继代培养基。对于叶、叶柄在MS+2,4-D 0.5 mg/L +6-BA 1 mg/L培养基中生长相对较好,故选定其为叶和叶柄的继代培养基。
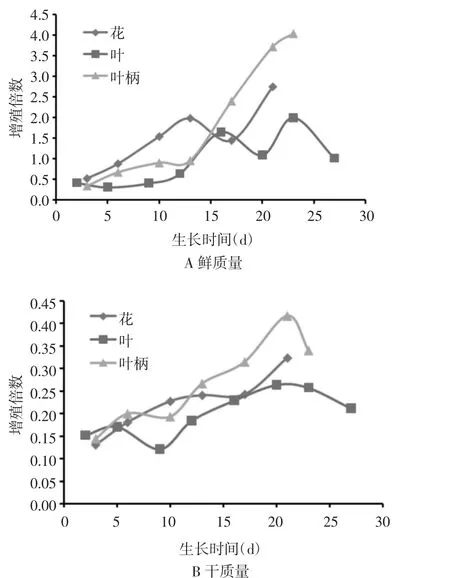
图1 不同培养时间对愈伤组织鲜质量和干质量的影响
2.3愈伤组织生物量变化规律研究 选择长势较好1.0 g淡黄色的愈伤组织,接种培养上,每3~4 d取样1次,称鲜质量和干质量。以愈伤组织鲜质量增殖系数、干质量生长倍增值的平均值为纵坐标,取样时间为横坐标,绘制不同外植体愈伤组织生长曲线,见图1。从图1中可知不同外植体愈伤组织干质量与鲜质量变化规律具有一致性。叶柄和叶基本符合“S”型曲线特征。在生长周期内,明显分为4个时期:延迟期、指数期、稳定期和下降期。叶柄在0~ 12 d为生长滞后期,接着13~21 d为对数生长期,22~25 d则为稳定期,在23 d即达到其最大生长量。叶在前4 d鲜质量变化不明显,接种后第10天细胞从延迟期进入对数生长期生长,第20天时达到1.98倍鲜质量生长量,以后细胞培养物鲜质量增长速度放缓,21~25 d为下降期,20天可达到最大生长量,如不及时更换新鲜培养基,细胞生长将停止。而花的愈伤组织延迟期较短,第3天开始即呈对数生长期,第13天即达到最大生长量,鲜质量增殖系数达到2.75,在21 d鲜质量有明显增加,但此时愈伤组织褐变较多,含水量增大不宜再进行继代培养,因此以生物量为指标,外植体叶柄和叶的愈伤组织的最大生物量在20 d左右,而花的的愈伤组织在13 d左右。
2.4愈伤组织中有效成分变化规律研究
2.4.1曲线标准的建立 本研究选择了奎宁酸类化合物和香豆素化合物为指标,评价了不同外植体中化学成分的变化规律。利用UPLC的分析方法,对不同浓度标准品混合溶液进行测定,获得各化学成分的峰面积,建立了各种化学成分的线性回归方程,如表2所示,各化合物线性关系良好。
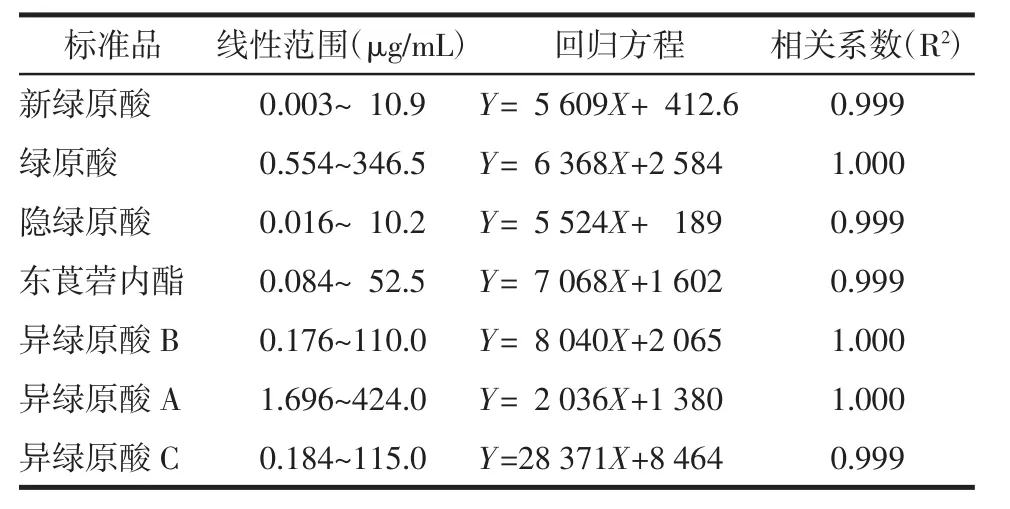
表2 7种化合物的线性范围及回归方程
2.4.2愈伤组织中化学成分含量测定 取不同培养天数的愈伤组织制备供试品溶液,注入UPLC,记录色谱图。按外标法以峰面积计算青蒿中各种化学成分的含量,见表3、表4、表5。从表3中可知,异绿原酸A为青蒿花序愈伤组织主要成分,绿原酸与异绿原酸A含量在第3天达到最高值,新绿原酸、异绿原酸B和异绿原酸C在第13天达到最高值,而隐绿原酸和东莨菪内酯含量则在第17天达到峰值。
从表4可知,异绿原酸A为青蒿叶柄愈伤组织中的主要成分,与新绿原酸、绿原酸、隐绿原酸和异绿原酸C在第3天达到最高值,在23 d出现其次高峰,东莨菪内酯在第17天达到峰值,而异绿原酸B在第23天时含量最高。
从表5可知,异绿原酸A为青蒿叶愈伤组织中的主要成分,其含量最高,与新绿原酸、绿原酸、异绿原酸B、异绿原酸C均在第17天时含量最高,隐绿原酸和东莨菪内酯则在第13天含量最高。
2.5不同愈伤组织中有效成分积累规律比较研究
次生代谢是植物为了适应特定的生活环境或受到病原微生物侵染后,产生并积累,用以增强自身的抵抗力,并不是细胞生命活动或植物生长发育所必需的。但与植物的抗病、抗逆有关,在提高植物的防御能力和处理生态环境关系上有着重要的角色。而中药中的次生代谢产物则常常作为主要的药效成分,并在中药道地性的形成上有很重要的应用[18]。本实验以青蒿愈伤组织中新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C和东莨菪内酯为主要的次生代谢产物进行定量研究。
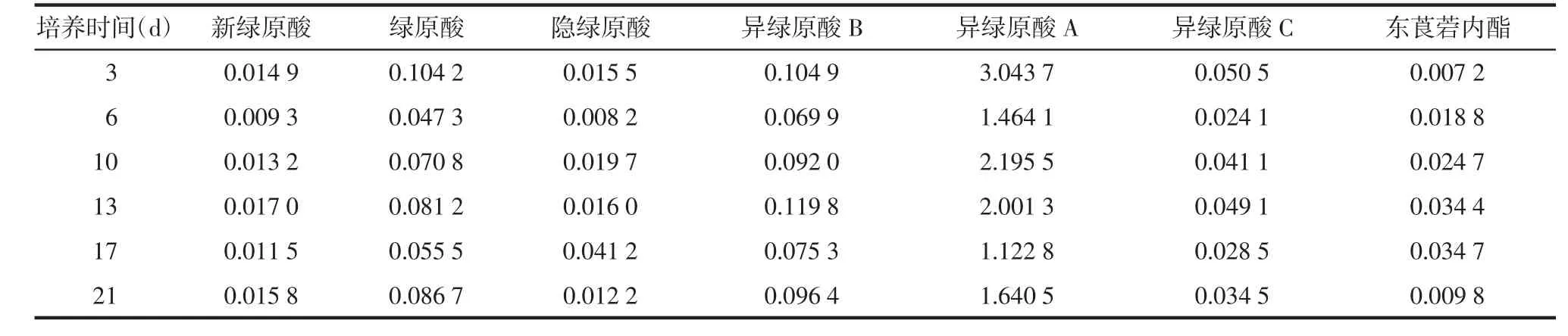
表3 不同培养时间的花序愈伤组织中化学成分含量 %

表4 不同培养时间的叶柄愈伤组织中化学成分含量 %
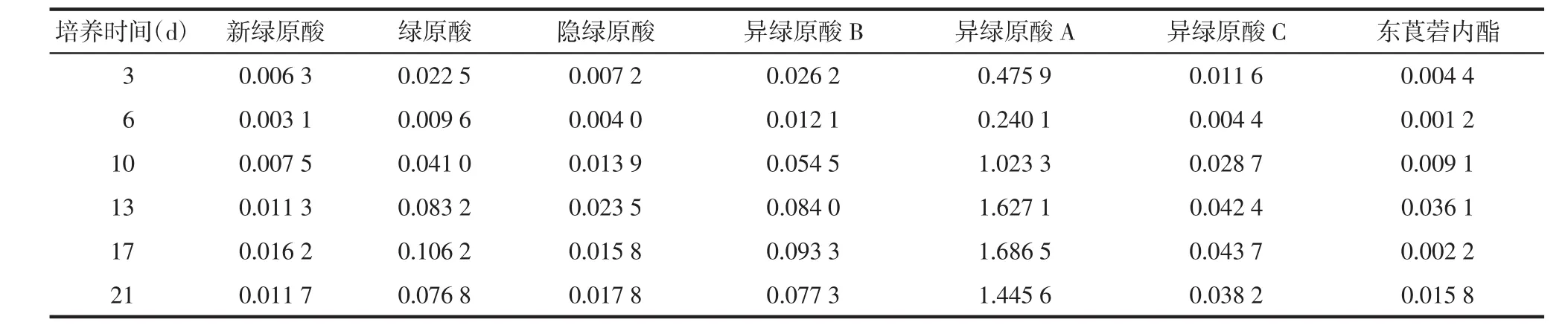
表5 不同培养时间的叶愈伤组织中化学成分含量 %
累积含量(μg)=愈伤组织百分含量×愈伤组织干质量收获量(g)
2.5.1花序愈伤组织有效成分变化规律
对于花的愈伤组织而言,新绿原酸和绿原酸在第21天达到最高值,而异绿原酸B、异绿原酸A和异绿原酸C在第10天达到最高值,隐绿原酸和东莨菪内酯在第17天达到最高值,其中异绿原酸B和异绿原酸A在21 d时又有回升趋势,但此时愈伤组织开始褐变,含水量增大,生长状态不好,不宜再做继代培养,见表6。
2.5.2叶柄愈伤组织有效成分变化规律 对于叶柄的愈伤组织而言,新绿原酸、绿原酸、异绿原酸B和异绿原酸A在第23天达到最高值,隐绿原酸和东莨菪内酯在第17天达到最高值,异绿原酸C在21 d达到最高峰。见表7。
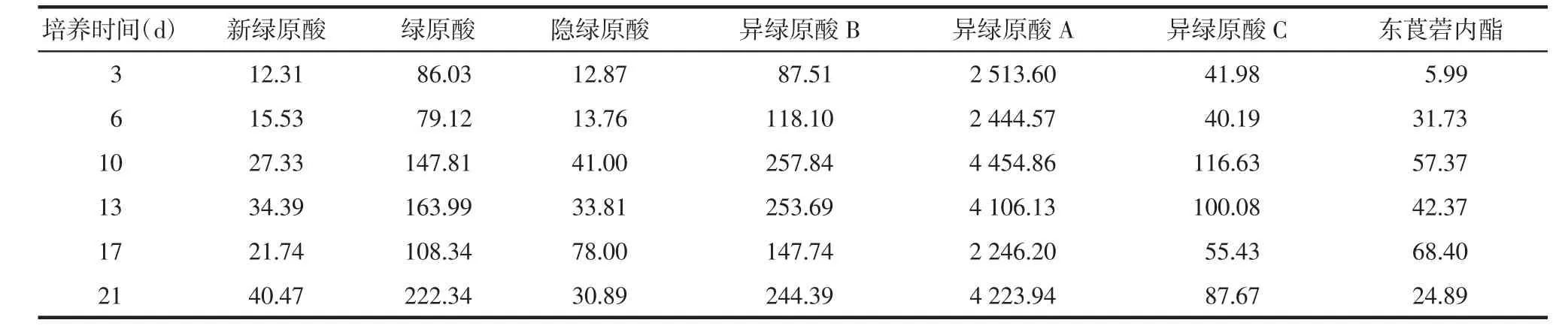
表6 花序愈伤组织中化学成分的累积变化 μg/g
对于叶的愈伤组织而言,新绿原酸、绿原酸、隐绿原酸、异绿原酸B在第17天达到最高值,异绿原酸A和异绿原酸C在第13天达到最高值,东莨菪内酯在第10天达到最高值,见表8。
结合愈伤组织生长曲线变化规律与有效成分变化,发现花序愈伤组织次生代谢产物新绿原酸与绿原酸生长曲线变化一致,而异绿原酸B、异绿原酸A、异绿原酸C则提前到达最大收获量,隐绿原酸和东莨菪内酯则向后推迟,其中异绿原酸B、异绿原酸A在21 d时又有回升,其主要原因可能是细胞开始向褐变发展,从而促进了奎宁酸类次生代谢产物的积累。对于叶柄的愈伤组织而言,新绿原酸、绿原酸、异绿原酸B、异绿原酸A、异绿原酸C与生长曲线变化一致,隐绿原酸和东莨菪内酯在第17 d达到最值,在21 d后各个化合物均达到稳态,可作为最佳的继代培养愈伤组织。对于叶的愈伤组织而言,新绿原酸、隐绿原酸、异绿原酸B、在第17天达到最高值,而异绿原酸A和异绿原酸C则在第13天即达到最佳收获期,可能是细胞高度脱分化抑制了次生代谢产物积累的原因造成的。
3 结论
本研究通过添加外源性激素2,4-D和6-BA成功的诱导出了青蒿花序、叶和叶柄的愈伤组织,呈现出淡黄色,结构疏松且生长迅速,易于分离的特点,将此愈伤组织进行数次继代,得到遗传性状稳定的愈伤组织。其中花序、叶和叶柄愈伤组织诱导培养基均为2,4-D 0.1 mg/L+6-BA 0.5 mg/L,而继代培养基略有变化,叶和叶柄的继代培养基更改为2,4-D 0.5 mg/L+6-BA 1 mg/L。花序愈伤组织生长周期最短,奎宁酸类化合物在13 d左右即可得到较高的累积量,而东莨菪内酯则在17 d为最高的收获量。叶柄的愈伤组织的各化合物含量及累积量均最高,奎宁酸类化合物在21 d左右为最佳收获期,而东莨菪内酯则在17 d达到最高量。结合细胞次生代谢产物的积累和细胞生长周期,建议以叶柄为外植体,以MS+2,4-D 0.1 mg/L+6-BA 0.5 mg/L为诱导培养基,以MS+2,4-D 0.5 mg/L+6-BA 1 mg/L为继代培养基,生长周期为21 d可获得青蒿次生代谢产物含量最高,细胞生长状态最好的愈伤组织,为传统中药青蒿培养体系优化及工业化规模生产进行探索提供了一个新途径。
[1] Biliaa AR,Melillo de MP,Bergonzi MC,et al.Bergonzi Simultaneous analysis of artemisinin and favonoids of several extracts of Artemisia annua L.obtained from a commercial sample and a selected cultivar[J].Phytomedicine,2006,13: 487-493.
[2]王 健,李 锦,孙 瑜,等.GC-MS鉴别清热抗感颗粒中青蒿、荆芥穗和薄荷[J].天津中医药大学学报,2007,26 (4):210-212.
[3]孙玉刚,秦续文,张 玲,等.高效液相色谱法同时测定青蒿绿原酸、隐绿原酸、东莨菪内酯含量[J].天津中医药, 2012,29(5):484-486.
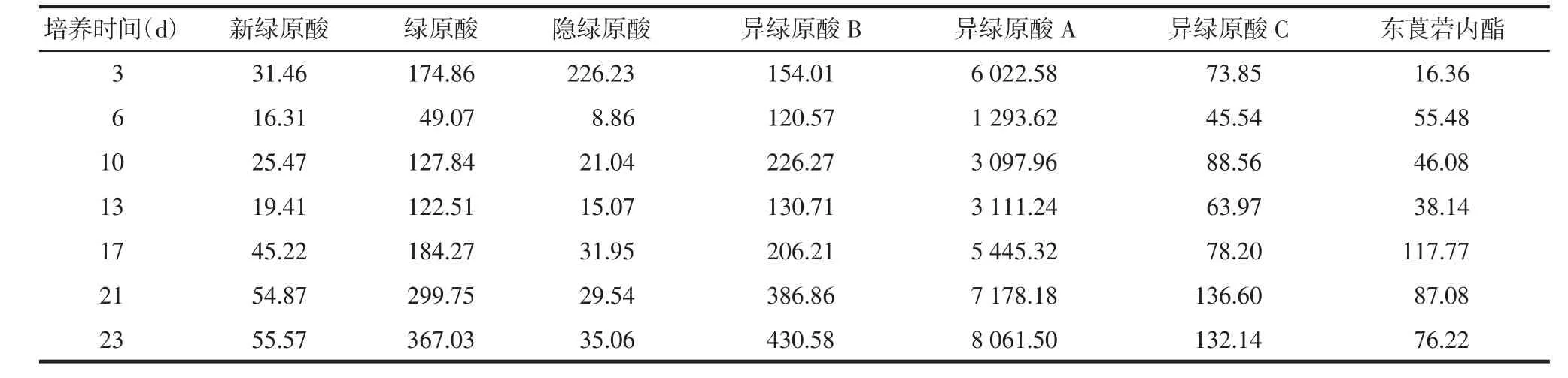
表7 叶柄愈伤组织中化学成分的累积变化 μg/g
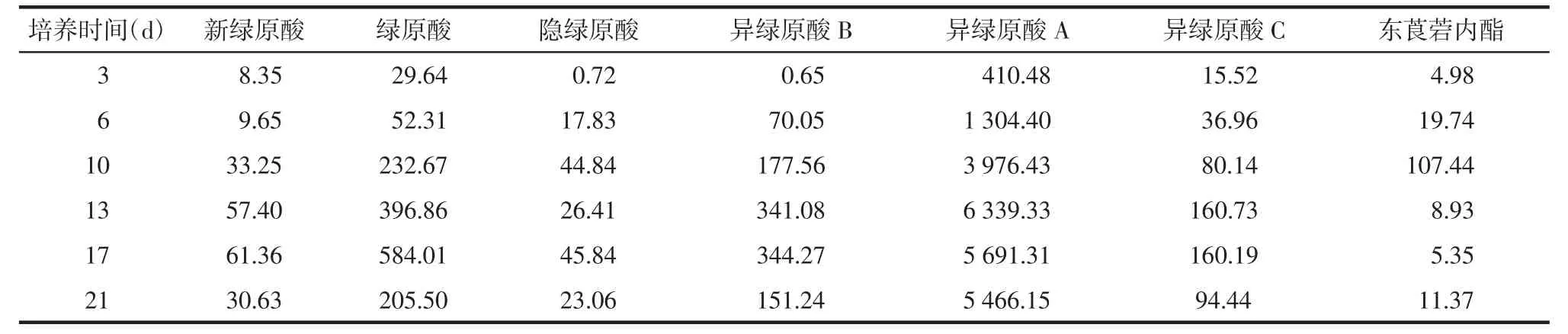
表8 叶愈伤组织中化学成分累积变化 μg/g
[4] Jian H,Min Y,Xue Q,et al.Characterization of phenolic compounds in the Chinese herbal drug Artemisia annua by liquidchromatographycoupledtoelectrosprayionizationmass spectrometry[J].Journal of Pharmaceutical and Biomedical Analysis,2008,32(47):516-525.
[5] Khennouf S,Iratni N,Baghiani A,et al.Antioxidant and antibacterial activities of extracts from Artemisia herba alba Asso.leaves and some phenolic compounds[J].Journal of Medicinal Plants Research,2010,4(13):1273-1280.
[6] Ma CF,Wang HH,Lu X,et al.Analysis of Artemisia annua L.volatile oil by comprehensive twodimensional gas chromatography time of fligh mass spectrometry[J].Journal of Chromatography A,2007,1150:50-53.
[7]何 兵,冯文宇,田 吉,等.GC-MS分析酉阳青蒿挥发油的化学成分[J].华西药学杂志,2008,23(1):30-31.
[8] Han X,Ma XF,Zhang TY,et al.Isolation of high purity casticin from Artemisia annua L by high speed counter-current chromatography[J].Journal of Chromatography A,2007,1151: 180-182.
[9]黄红英,邓 斌,张晓军,等.青蒿中黄酮类化合物的提取及其抗氧化性研究[J].安徽农业科学,2009,37(7):3037-3039.
[10]陈 靖,周玉波,张 欣,等.黄花蒿幼嫩叶的化学成分[J].沈阳药科大学学报,2008,25(11):866-870.
[11]杨国恩,宝 丽.黄花蒿中的黄酮化合物及其抗氧化活性研究[J].中药材,2009,32(11):1683-1686.
[12]焦小珂,高山林,高艳丽,等.青蒿同源四倍体的诱导及农艺性状的评价[J].药物生物技术,2008,15(3):195-198.
[13]伍晓丽,李隆云,钟国跃,等.青蒿花药培养研究[J].时珍国医国药,2009,20(12):3135-3136.
[14]Geng S,Ji SD,Yuan JY,et al.Factors affecting induction of shoot cluster of Artemisia annua[J].Chinese Traditional and Herbal Drugs,2004,35(5):566-572.
[15]张丽珍,徐淑庆,杨冬业,等.青蒿组织培养及其快速繁殖研究[J].生物学通报,2010,45(3):48-50.
[16]王梦琼.青蒿的组织培养及植株再生[J].北京中医药大学学报,2004,27(2):74-75.
[17]Liu CZ,Guo C,Wang YC,et al.Comparison of various bioreactors on growth and artemisinin biosynthesis of Artemisia annua L.shoot cultures[J].Process Biochemistry, 2003,39:45-49.
[18]黄璐琦,郭兰萍.环境胁迫下次生代谢产物的积累及道地药材的形成[J].中国中药杂志,2007,32(7):277-280.
Establishment of rapid callus proliferation culture system and evaluating content of secondary metabolite in Herba Artemisiae Annuae
GUO Xin-rong1,LI Jin1,MA Lin1,WANG Zhen-zhong2,XIAO Wei2,CHANG Yan-xu1,2
(1.Tianjin State Key Laboratory of Modern Chinese Medicine,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China;2 Jiangsu Kanion Pharmaceutical Co.Ltd.,Lianyungang 222001,China)
[Objective]To establish the rapid callus proliferation culture system of Herba Artemisiae Annuae and determine the content of phenylpropionic acids and coumarins.[Methods]The inflorescence,leaf and petiole were cut down and selected as explant and induced into callus under sterile conditions.Then,the callus was planted in MS with different combinations of different hormones.Finally,the content of phenylpropionic acid and coumarins was determined.[Results]The rapid callus proliferation culture system of Herba Artemisiae Annuae was established successfully by tissue culture.Kinetics of growth accumulation and the best harvest of phenylpropionic acid and coumarins biosynthesis were evaluated.[Conclusion]Kinetics of growth accumulation of secondary metabolites of Artemisia Annue can be successfully established by tissue culture.These methods provide a new way to explore the variation of the secondary metabolites in culture system optimization and industrial scale production of Artemisia Annua.
Artemisia annua;tissue culture;quininic acid;coumarin compounds;secondary metabolites
R285.5
:A
:1673-9043(2014)04-0219-06
2014-02-15)
10.11656/j.issn.1673-9043.2014.04.09
“重大新药创制”科技重大专项资助项目(2010 ZX09502-005);中国博士后特别基金资助项目(2012 T50239);江苏省博士聚集计划;天津市科技支撑计划重大项目(10ZCZDSY12400)。
郭新荣(1986-),女,硕士研究生,从事中药药效物质基础研究工作。
常艳旭,E-mail:tcmcyx@126.com;萧 伟,E-mail: xiaowei@163.com。

