人工诱导栉孔扇贝雌核发育胚胎的SNP标记分析*
陈 亮,赵柏淞,李 玲,商文聪,胡晓丽,包振民
(中国海洋大学海洋生命学院,海洋生物遗传学与育种教育部重点实验室,山东 青岛266003)
人工诱导雌核发育技术使用遗传失活的精子激活成熟卵子,通过阻止第二极体排出或第一次卵裂使卵子染色体加倍可获得雌核发育二倍体个体。与自交或全同胞交相比,雌核发育在基因位点的纯化速度上具有明显优势。通过人工诱导雌核发育技术快速建立纯系,可以为种质改良、新品种开发,以及性别决定机制、单性生殖、基因定位等基础生物学研究提供良好的素材[1-3]。
在人工诱导雌核发育过程中,灭活精子只作为激活源,入卵后不参与胚胎发育,理论上雌核发育后代的遗传物质仅来源于母本且基因位点纯合度高。但实际情况中,精子遗传物质失活不完全或者其他原因可能使父本遗传物质渗入[4],因此有必要对雌核发育后代进行遗传鉴定与分析。
栉孔扇贝(Chlamysfarreri)是我国北方重要的海水养殖种类。近年来有关栉孔扇贝人工诱导雌核发育的研究中已有获得雌核发育后代胚胎或幼虫的相关报道[5-7]。在后代的遗传检测方面,王卫军[8]利用细胞遗传学方法对栉孔扇贝雌核发育早期胚胎进行了GISH鉴定,吴彪[9]使用3对微卫星通用引物对异源精子诱导栉孔扇贝雌核发育后代进行了基因位点分析。本文使用紫外照射灭活的同源精子激活栉孔扇贝卵子分裂发育获得雌核发育胚胎。对诱导后的胚胎进行全基因组扩增,利用96个单核苷酸多态性(Single nucleotide polymorphism,SNP)标记对胚胎扩增产物进行基因位点检测,以期为栉孔扇贝人工雌核发育纯系遗传材料的获取及其多基因位点检测评价提供参考。
1 材料与方法
1.1 材料
性腺发育健康且成熟的二龄栉孔扇贝亲贝选自青岛沙子口养殖海区,在实验室循环水养殖系统中控温暂养一周后催产。
1.2 方法
1.2.1 精子的灭活与授精 亲贝雌雄个体分开,采用阴干升温法催产获取单个亲本来源的精卵。参照赵锋[10]的方法,使用辐射强度为800μW·cm-2·s-1的紫外线照射50s对精子进行灭活,照射后的精液立即加入盛有卵液的培养皿中,玻璃棒轻搅使精卵充分接触,于黑暗环境下授精45min,用灭菌过滤海水洗卵3次后转入灭菌过滤海水中培养,海水温度18~20℃。利用未经照射精子受精的正常二倍体胚胎作为对照。
1.2.2 雌核发育胚胎细胞倍性检测 激活后的卵子培养18h后,取适量胚胎于离心管,加入DAPI染液,轻摇混匀成待测样品,-20℃冻存用于倍性检测。其它胚胎使用酒精固定,4℃保存。倍性检测前将待测样品室温解冻,涡旋震荡获得单细胞悬液,过滤至样品管中,利用流式细胞仪对胚胎的倍性进行检测。以正常发育的二倍体胚胎作为对照。
1.2.3 DNA提取及全基因组扩增 选取单倍体率大于80%的胚胎固定样品5份,每份分别来自不同的亲本,从中各选取胚胎10个。胚胎分拣在显微镜视野下进行,使用毛细吸管采用逐级稀释的方法获得单个胚胎,PBS溶液清洗3次后将单个胚胎转入灭菌的PCR小管中,-80℃保存。对于5份胚胎材料各自的雌性亲本和提供精子的雄贝,使用SDS酚氯仿法提取闭壳肌组织基因组DNA。取雌性亲本活体鳃丝组织0.1g在2.0mL PBS溶液中振荡打散过滤后获得鳃丝细胞悬液。利用多重置换扩增(MDA)技术,使用REPLI-g全基因组扩增试剂盒对雌性亲本基因组DNA、鳃丝细胞以及诱导雌核发育的胚胎进行全基因组扩增。在后续的SNP分型中,雌性亲本基因组DNA和鳃丝细胞的扩增产物分别作为DNA水平和细胞水平的对照,用来评价雌核发育胚胎全基因组扩增的效率及其扩增产物的SNP分型效率。
1.2.4 SNP位点分型 在本实验室前期开发的栉孔扇贝转录组来源的SNP标记中(未发表),选取期望杂合度较高的96个,分别以雌性亲本和提供精子的栉孔扇贝的基因组DNA,以及上述3种全基因组扩增产物为模板,参考 Wang等[11]的方法,利用高分辨率溶解曲线(HRM)技术进行SNP位点基因分型。
1.2.5 数据分析 以雌性亲本基因组DNA的分型结果为标准对照,计算4种不同来源模板的位点检出率以及分型结果与标准结果的一致性比率,对后代胚胎全基因组扩增产物的质量进行评价。根据雌性亲本与其雌核发育后代胚胎的SNP位点基因型,分析二者基因组多态性水平的差异。
2 结果
2.1 雌核发育胚胎细胞的单倍体率
图1为雌核发育组和正常对照组的流式细胞仪检测结果,不同DNA倍性胚胎细胞的比率以流式细胞仪检测结果图中单倍体或二倍体检测峰面积占总面积的比例表示。根据图中主峰对应的道数,对照组正常发育的二倍体胚胎细胞DNA相对含量是雌核发育胚胎细胞DNA相对含量的2倍,表明经紫外灭活精子诱导处理获得了雌核发育单倍体胚胎,胚胎细胞的单倍体率平均为82.5%。
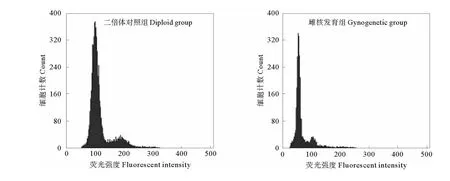
图1 二倍体对照组胚胎和雌核发育胚胎的DNA相对含量Fig.1 The relative DNA content of diploid and gynogenetic embryos
2.2 全基因组扩增产物的SNP分型效率评价
根据雌性亲本基因组DNA的分型结果,分析3种全基因组扩增产物(雌性亲本基因组DNA和鳃丝细胞、雌核发育胚胎)在基因组96个SNP位点的分型效率(见表1)。4种模板的分型检出率均为96.00%以上,且与对照的分型一致性均为99.00%以上。雌核发育胚胎全基因组扩增产物的位点检出率为96.27%,与鳃丝细胞的全基因组扩增产物位点检出率(96.33%)接近,但略低于亲本DNA模板(98.93%)和亲本DNA全基因组扩增产物(98.11%)的位点检出率。诱导胚胎中,99.06%的位点与其雌性亲本基因组DNA的分型结果相符(SNP分型结果中只出现相应雌性亲本等位基因的,视为与对照一致),且与其它2种全基因组扩增产物相比无明显变化。因此,栉孔扇贝单个雌核发育胚胎的全基因组扩增产物能够较完整和准确地反映其基因组信息。
2.3 雌核发育胚胎的SNP位点分析
在分型96个SNP位点后,对在单个诱导雌核发育胚胎个体中只出现一种等位形式的位点比例,以及对应雌性亲本中纯合位点的比例进行了比较分析。在所检测的5个雌性亲本中,纯合度最高的个体含69个纯合位点,占总位点数的71.85%,最低为54个位点纯合,占56.25%,个体平均纯合位点比例为64.25%。而在所检测的50个雌核发育胚胎的全基因组扩增产物中,杂合程度最低的个体在93个位点上表现为一种等位形式,占所有检测位点的96.88%,杂合程度最高的有88个位点表现为一种等位形式,占91.67%,所有个体平均为94.81%。上述结果表明,雌核发育胚胎的基因组杂合程度明显低于雌性亲本(见图2)。

图2 雌性亲本及其雌核发育后代胚胎的单态位点率Fig.2 Percentage of monomorphic loci in gynogenetic embyros and their female parents

表1 不同来源DNA模板的位点分型效率Table 1 SNP genotyping performance of different DNA templates /%
分型结果还显示,雌性亲本为纯合型的位点中,有有98.58%在其单个后代中表现为一种等位形式,1.42%为杂合型。经检测,雌性亲本为纯合型而后代为杂合型的位点,其提供精子的雄性个体在该位点均为杂合型或者是另一等位基因的纯合型,表明胚胎中此类杂合型位点的出现是由精子遗传物质渗入造成的。同时,雌性亲本为杂合型的位点,88.09%在单个后代中表现为一种等位形式,另外11.91%的杂合位点在后代中仍为杂合型,精子遗传物质的渗入和极体非正常排放均可能是后代中此类杂合位点出现的原因。
3 讨论
人工诱导获得的贝类雌核发育单个胚胎或幼虫,其基因组DNA不足以进行多遗传位点的规模检测。对这些微量基因组DNA进行全基因组扩增[12],可为基因组多位点的分子标记检测提供足量的模板。Pazes[13]在进行高密度芯片杂交的研究中发现,全基因组扩增产物对基因组覆盖度可达99.82%,SNP分型结果与对照组的一致性为99.85%。临床样品的分析检测[14]、比较基因组杂交[15]方面的相关研究也表明,全基因组扩增产物对模板DNA有很高的覆盖度和保真性。本研究利用多重置换扩增技术对单个雌核发育胚胎进行了全基因组扩增,扩增产物DNA总量在20μg以上,SNP标记分型检出率96.27%,其中99.06%的位点分型结果与雌核发育胚胎雌性亲本相符。因此,栉孔扇贝单个胚胎的全基因组扩增产物能够较为真实全面地代表单个胚胎的基因组遗传信息,可作为后续遗传检测分析的模板。
对于采用灭活精子激活卵裂获得的雌核发育后代个体,有必要做进一步的遗传检测,以确定精子遗传灭活的效果以及后代基因位点的纯合程度。在人工诱导贝类雌核发育的研究中,使用对照单倍体染色体计数、早期卵裂核相的荧光染色观察[16]、GISH[17]等技术可以在细胞染色体水平上辨别雌核发育后代遗传物质的来源。与之相比,利用分子标记技术则可以在基因位点水平反映雌核发育后代DNA的来源,检测是否存在父本基因的干扰,同时还可以根据位点分型结果估测雌核发育个体基因组受外源遗传物质污染的程度。SNP标记作为第三代分子标记技术,具有数量多、分布广泛、遗传稳定性高、检测方法易于实现自动化等优点,被广泛应用于动植物的遗传学研究中[18]。本研究利用HRM技术,单次检测可实现96个SNP位点的分型,与现有的其它分子标记技术相比,利用数量较多的SNP标记进行遗传位点的快速分型,可以更为高效全面地对雌核发育后代胚胎的基因组进行分析和评价。
雌性亲本中为纯合型的位点,有1.42%在雌核发育后代胚胎中出现杂合型。对提供精子的雄性个体的SNP检测表明,胚胎中上述杂合位点的出现,是由精子遗传物质渗入造成的。徐成等[19]利用同工酶标记对同源精子诱导牙鲆异质雌核发育的后代进行分析时也发现,后代中存在父本基因表达。吴清明等[20]利用微卫星标记在大黄鱼同质雌核发育家系中检测到部分个体含有父本等位基因,作者认为父本基因的存在可能是由精子失活不完全所致。另外,雌性亲本中为杂合型的位点,有11.91%在雌核发育后代胚胎中仍为杂合型,这些杂合位点的出现,除了由于精子遗传物质的渗入,也可能有胚胎极体非正常排出的原因,此推测有待进一步实验验证。
人工诱导雌核发育是快速建立纯系的有效手段。相关研究表明,一次同质雌核发育的位点纯化效率相当于8~10个世代的同胞兄妹交配,通过一次同质雌核发育,再经过一次同质或异质雌核发育即可达到建立纯系的目的[21]。已有多种海水鱼类通过人工雌核发育的方法成功获得纯系[22]。本次研究获得的栉孔扇贝雌核发育单倍体胚胎,单个个体基因组中最高有96.88%的位点表现为一种等位形式,平均为94.81%,明显高于雌性亲本中纯合位点的比例。进一步通过抑制第二极体排放或者抑制第一次卵裂进行染色体加倍[23],则有望获得基因组高度纯合的栉孔扇贝雌核发育二倍体,进而建立纯系。
[1]楼允东.人工雌核发育及其在遗传学和水产养殖上的应用[J].水产学报,1986,10(1):111-123.
[2]Arai K,Fujino K,Sei N,et al.Estimating rate of gene-centromere recombination at eleven isozyme loci in Salvelinus species[J].Bull Jpn Soc Sci Fish,1991,157:1043-1055.
[3]Avtalion R R,Don J.Sex-determining genes in tilapia:Amodel of genetic recombination emerging from sex ratio results of three generations of diploid gynogenetic Oreochromis aureus[J].J Fish Biol,1990,37:167-173.
[4]吴清江,陈荣德,叶玉珍,等.鲤鱼人工雌核发育及其作为建立近交系新途径的研究[J].遗传学报,1981,8(1):50-55.
[5]Pan Ying,Li Qi,Yu Ruihai,et al.Induction of gynogenetic diploids and cytological studies in the zhikong scallop,Chlamys farreri[J].Aquatic Living Resources,2004,17:201-206.
[6]董迎辉,杨爱国,刘志鸿,等.栉孔扇贝正常发育和人工雌核发育二倍体早期胚胎核行为的细胞学观察[J].水产学报,2006,30(1):29-35.
[7]李琪,杨青,于瑞海.栉孔扇贝雌核发育二倍体早期成活与生长发育的研究[J].中国海洋大学学报:自然科学版,2007,37(3):399-404.
[8]王卫军,杨建敏,刘志鸿,等.异源精子诱导栉孔孔扇贝雌核发育二倍体早期胚胎的细胞学研究及GISH鉴定[J].海洋与湖沼,2009,27(6):325-329.
[9]吴彪,杨爱国,王清印,等.异源精子诱导栉孔扇贝雌核发育后代的微卫星分析[J].水产学报,2009,33(4):542-548.
[10]赵峰,杨爱国,刘志鸿,等.紫外辐射对栉孔扇贝精子遗传失活及形态结构的影响[J].海洋水产研究,2003,24(4):26-31.
[11]Wang S,Zhang L,Meyer E,et al.Construction of a high-resolution genetic linkage map and comparative genome analysis for the reef-building coral Acropora millepora[J].Genome Biol,2009,10(11):126.
[12]Mladen V,Christian B,Bettina K,et al.Genome wide single nucleotide polymorphism arrays demonstrate high fidelity of multiple displacement based whole genome amplification[J].Electrophoresis,2005,26(3):710-715.
[13]Paez J,Ming L,Beroukhim R,et al.Genome coverage and sequence fidelity of phi29polymerase-based multiple strand displacement whole genome amplification[J].Nucleic Acids Research,2004,32(9):71.
[14]Hosono S,Faruqi A,Dean F,et al.Unbiased whole genome amplification directly from clincial samples[J].Genome Research,2003,13(5):954-964.
[15]Dean F,Hosono S,Fang L,et al.Comprehensive human genome amplification using multiple displacement amplification[J].PNAS,2002,99(8):5261-5266.
[16]王卫军,杨爱国,刘志鸿,等.异源精子诱导栉孔扇贝雌核发育早期胚胎发育及其倍性分析[J].上海水产大学学报,2007,16(5):414-420.
[17]吕振明.栉孔扇贝和虾夷扇贝杂交过程中的细胞与分子遗传学分析[D].青岛:中国海洋大学,2006.
[18]曹燕如,黄敏仁,王明庥.一种新的分子标记-单核苷酸多态(SNP)[J].南京林业大学学报,2003,27(3):84-88.
[19]徐成,王可玲,徐永立,等.雌核发育牙鲆同功酶基因的重组及父方基因的表达[J].海洋与湖沼,2002,33(1):62-67.
[20]吴清明,蔡明夷,刘贤德,等.大黄鱼同质雌核发育的诱导及微卫星标记分析[J].水产学报,2009,33(5):734-742.
[21]Streisinger G,Walker C,Dower N,et al.Produc tion of clones of homozygous diploid zebra fish(Brachydanio rerio)[J].Nature,1981,291:293-296.
[22]胡则辉,徐君卓.人工诱导海水鱼类雌核发育的研究进展[J].海洋渔业,2007,29(1):78-84.
[23]潘英,李琪,于瑞海,等.栉孔扇贝第1卵裂抑制型雌核发育二倍体的研究[J].海洋学报,2005,27(6):154-161.

