力竭运动及钝挫伤对大鼠骨骼肌卫星细胞及相关调节因子的影响
潘同斌 左伟 夏素文 张乐 朱超 焦寒凝
扬州大学体育学院(江苏扬州225009)
肌卫星细胞在未受到刺激源刺激时处于静息状态, 肌肉蛋白不被表达, 表现出胚胎细胞的一些特点,胞质含量很少。当肌肉发生损伤,包括钝挫伤时,肌卫星细胞处于激活状态,产生肌肉调节因子,最后通过增殖和分化作用融合成肌管, 通过合成对肌肉再生有重要作用的蛋白质参与骨骼肌的修复, 弥补损失的蛋白质,最终融合为肌纤维[1,2]。本研究初步摸索力竭运动和钝挫伤两种不同处理后的大鼠骨骼肌体外培养成肌细胞的条件及结果, 为进一步探索相关调节因子及其机制打下基础。
转化生长因子β(TGF-β)是一种抑制生长因子,它对肌卫星细胞的生长增殖具有抑制作用, 但它对细胞的生长、分化和免疫功能都有重要的调节作用,对肿瘤疾病、血管生成、纤维化疾病等都起着重要作用,在骨骼肌损伤修复中也起着重要的作用[3,4]。血小板衍生生长因子(PDGF)是一个分子量约30 kD 的碱性糖蛋白,在胚胎发育、细胞分化和对组织损伤的反应等过程中具有极为重要的作用。 它是创面愈合过程中较早出现的生长因子之一[5,6]。目前,关于血小板衍生生长因子(PDGF)及TGF-β与运动损伤修复关系的研究较少,本研究通过力竭运动损伤模型,探索其在力竭运动后不同时期的变化情况。
1 材料和方法
1.1 动物分组与取材
力竭运动组: 选用7周龄清洁级Wistar雄性大鼠24只, 由扬州大学比较医学中心提供, 许可证号:SCXK(苏)2007-0001。 随机分为3组,每组6只,进行一次性力竭跑台运动, 分别于力竭后即刻、24小时、48小时后宰杀(即E0、E24、E48组),并取左侧腓肠肌一分为二,一份立即进行骨骼肌卫星细胞培养实验,另一份液氮保存, 用于检测PDGF和TGF-β, 采用ELISA法。
对照组(C组):不运动,与E0组同时宰杀。
钝挫伤组:以Wistar雄性大鼠4只,进行钝挫伤实验,在钝挫伤即刻、24小时后(D0、D24组)分别进行麻醉,每组2只,于受伤处取左侧腓肠肌,立即进行细胞培养实验。 另取新生鼠(N组)2只,宰杀后取左侧腓肠肌,同样进行细胞培养实验。
1.2 力竭运动模型
运动组动物均进行一次性力竭离心运动 (持续下坡跑), 依次进行第Ⅰ级负荷 (0°,8.2 m/min)15 min、第Ⅱ级负荷(-5°,15 m/min)15 min、第Ⅲ级负荷(-10°,19.3 m/min)直至力竭。
1.3 钝挫伤模型
参照Kami等[7]的方法,麻醉后,将大鼠后肢置于伸膝、踝背屈90°位置,用自制打击装置击打其小腿内侧面距跟骨1.5 cm处。 金属重锤呈漏斗形,底端圆形平面直径1 cm。 重锤质量350 g,打击时从45.7 cm高度的圆管内自由下落,打击动能为1.57 J,一次性打击致伤,解剖证实成功率100%。
1.4 细胞培养试剂及仪器
培养基(Gibco公司产品):高糖DMEM培养基占78%;青/链霉素占2%;胎牛血清占10%;标准马血清占10%。 主要仪器:CO2恒温培养箱, 赛默飞世尔(Thermo) 科 技 公 司; 光 学 倒 置 显 微 镜, 日 本OLYMPUS公司;NikonE600显微照相图像采集系统,日本尼康。
1.5 大鼠骨骼肌卫星细胞的分离与培养方法
(1)用眼科剪刀在有少量含2%双抗的hanks液中将组织剪成1 mm3大小的肉糜, 缓慢将hanks倒掉。(2)倒入少量消化酶(0.25%胰蛋白酶)沉淀至组织沉淀,倒掉液体,留下沉淀。 (3)倒入5 ml左右0.25%胰蛋白酶,振荡后迅速移至离心管中,放入37℃水浴箱中,消化50~60 min。 (4)依次滤过200目、400目的筛网,滤液收集后用2000 r/min离心10 min,取沉淀加入适量培养液进行培养。 (5)隔60 min差速贴壁1次,共两次。将第1次培养瓶中的培养液留下继续加入新鲜培养液培养。 以后每隔24 h更换培养基,并用倒置显微镜进行观察。
1.6 骨骼肌PDGF和TGF-β测定
采用酶联免疫吸附法(ELISA),北京博奥拓达生物有限公司提供酶联免疫检测试剂盒。 采用美国ELX800型酶标仪,严格按照试剂盒说明操作。 考马斯亮兰法进行定氮。
1.7 统计学分析
全部数据用Microsoft Excel 2003处理,计算平均数和标准差。统计分析用SPSS 17.0软件完成,各组间两两比较采用方差分析的LSD法, 显著性差异水平为P < 0.05。
2 结果
2.1 力竭运动及钝挫伤后不同时期的成年鼠和新生鼠骨骼肌卫星细胞(SC)的体外培养结果
首先,本实验条件下,对照组(C组)和力竭运动组(E0、E24组)未能观察到明显的卫星细胞增殖、分化。 但N组新生鼠(N组)1天后即可见到梭形卫星细胞,钝挫伤即刻组(D0组)3天后可见卫星细胞梭形分化,而钝挫伤后24小时组(D24组)5天后可见卫星细胞梭形分化,且此3组分化的卫星细胞一直保持良好的增殖、传代,第13天仍长势良好,可见部分融合和微管。 选取代表性的3组图片如下:
2.1.1 各组培养1天后及3天后的卫星细胞状况

图1 D0组培养24小时(×20)

图2 D0组培养3天后(×20)

图3 D24组培养24小时(×20)

图4 D24组培养3天后(×20)

图5 N组培养24小时(×20)
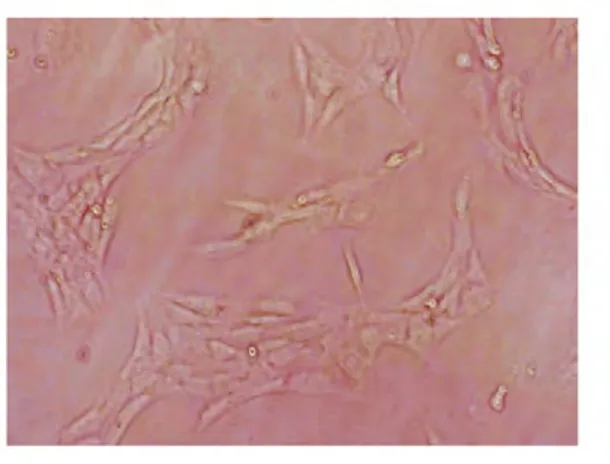
图6 N组培养3天后(×20)
图1、图3、图5为各组大鼠腓肠肌卫星细胞培养24小时观察的照片,其中钝挫伤组D0、D24组未见到激活的肌卫星细胞, 但可见含有少许的未被过滤的肌纤维,新生鼠组(N组)可以看见梭形的肌卫星细胞。 图2、图4、图6为各组大鼠腓肠肌卫星细胞培养3天后的照片,其中钝挫伤组D24组仍未见到激活的肌卫星细胞,钝挫伤即刻组D0组及新生鼠组(N组)可以看见较多梭形的肌卫星细胞。 各组卫星细胞的激活时间及增殖数量存在较大差异。
2.1.2 各组培养5天后及13天后的卫星细胞状况
图7、图9、图11为肌卫星细胞培养5天后的照片。此时各组肌卫星细胞均呈现梭形, 数量上较之前几天均明显增多,表明肌卫星细胞培养第5天开始大量增殖。
图8、图10、图12为肌卫星细胞培养第13天照片。各组肌卫星细胞分布都非常密集,已密布培养皿中,且出现了融合现象,部分出现微管,说明此时的肌卫星细胞已出现分化、融合现象。

图7 D0组培养第5天(×20)

图8 D0组培养第13天(×20)
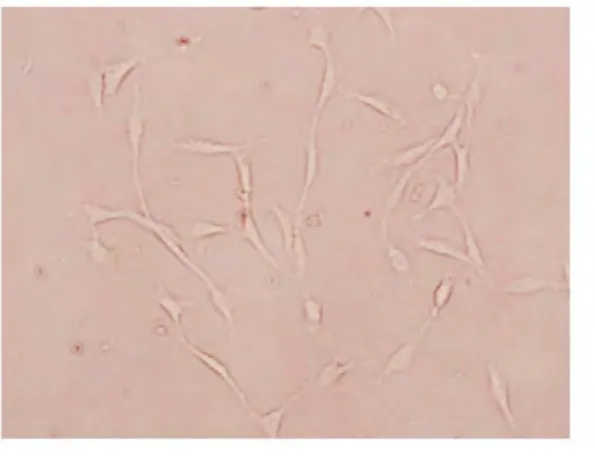
图9 D24组培养第5天(×20)

图10 D24组培养第13天(×20)

图11 N组培养第5天(×20)

图12 N组培养第13天(×20)
2.2 力竭运动及恢复期间大鼠骨骼肌PDGF及TGF-β的变化情况
PDGF和TGF-β的ELISA结果(表1)显示,一次力竭离心运动后,与安静对照组相比较,力竭组大鼠骨骼肌中PDGF均显著性升高(P < 0.01),而TGF-β均呈现极显著性降低(P < 0.01)。且力竭各组之间(E0、E24、E48组)无显著性差异(P > 0.05)。

表1 各组大鼠骨骼肌PDGF及TGF-β的变化
3 讨论
3.1 力竭运动、 钝挫伤和乳鼠的骨骼肌卫星细胞(SC)体外培养的增殖和分化情况对比
从骨骼肌中分离获得的肌卫星细胞在体外培养时统称为成肌细胞。张立贵等[8]观察了大鼠眼外肌成肌细胞的增殖及分化特征, 采用反复差速贴壁法分离纯化成肌细胞,进而进行体外培养、鉴定并观察其增殖及分化特征,取得了比较满意的实验效果。关于其分化性能,Peterson等[9]研究发现,肌卫星细胞在肥胖大鼠骨骼肌中分化性能降低,但通过运动可恢复、提高其分化能力。 本研究初步摸索及完善了几种不同处理的大鼠骨骼肌体外培养成肌细胞的条件及结果, 为进一步探索相关调节因子及损伤修复机制打下了基础。
首先,本研究条件下,对照组(C组)和力竭运动组(E0、E24组)取材后,体外培养未能观察到明显的卫星细胞增殖、分化。 一方面可能由于这3组未能达到损伤激活卫星细胞分化的条件, 另一方面可能是操作条件的局限导致未培养成功。 但同样培养条件下,新生鼠(N组)1天后即可见到梭形卫星细胞,钝挫伤即刻组(D0组)3天后可见卫星细胞梭形分化,而钝挫伤后24小时组(D24组)5天后可见卫星细胞梭形分化, 且此3组分化的卫星细胞一直保持良好的增殖、传代,第13天仍长势良好,可见部分融合成微管。 结果说明新生鼠在发育的早期, 肌卫星细胞即保持着旺盛的分化增殖能力, 早期即具有特异性成肌细胞的活性,且分化、增殖数量较高。 钝挫伤对骨骼肌的损伤较重,亦能较强地刺激卫星细胞分化,促进其修复,且钝挫伤即刻组(D0组)启动较快,3天后可见卫星细胞梭形分化,而钝挫伤后24小时组(D24组)相对启动较慢,5天后才见卫星细胞梭形分化。 且在卫星细胞增殖数量上,D0组高于D24组,这可能与钝挫伤造成的肌肉中调节因子的变化有关, 势必对体外培养造成较大的影响,其具体机制有待进一步研究。
3.2 力竭运动对大鼠骨骼肌PDGF的影响
PDGF在创伤中起着重要的作用,它刺激有丝分裂,趋化成纤维平滑肌细胞、中性粒细胞、巨噬细胞,并且还刺激巨噬细胞产生创伤愈合各阶段中所需的重要细胞生长因子, 还可促进细胞外基质分子的产生[5]。 在骨骼肌受到损伤后,受损肌细胞便会发生炎症反应,此时巨噬细胞浸润胞内,吞噬坏死细胞同时分泌多种生长因子, 促进骨骼肌的愈合,PDGF就是其中一种。Antoniades等[6]研究发现PDGF在转化生长因子(TGF)和胰岛素样生长因子(IGF-1)的协同作用下,在胃癌的发生和发展过程中起着重要作用。
目前, 关于运动影响血小板衍生生长因子的研究还较少,而PDGF可能在骨骼肌损伤和修复过程中发挥重要作用。 本研究发现, 在骨骼肌损伤早期,PDGF的浓度便有明显升高,且差异具有显著性(P <0.01),由此推测PDGF可能较早参与骨骼肌损伤的修复。 随着时间的延长,PDGF的浓度也在逐渐升高,48 h时又出现缓慢下降趋势, 可能是由于炎症反应下降,释放的PDGF减少所致。 综上所述,PDGF可以作为骨骼肌损伤修复的指标之一。
3.3 力竭运动对大鼠骨骼肌TGF-β的影响
于新凯等[3]通过实时荧光定量PCR技术检测一次力竭离心运动后骨骼肌中不同时期TGF-β1 mRNA表达情况, 发现在骨骼肌损伤后的6 h、24 h、48 h,TGF-β1 mRNA 表 达 水 平 低 于 对 照 组 (P >0.05),12 h、72 h、1 w和2 w TGF-β1 mRNA表达水平明显低于对照组(P < 0.05),表明TGF-β1在骨骼肌损伤修复中可能处于抑制状态。 这提示TGF-β在骨骼肌损伤修复中可能表现为一种负相调节因子,它是通过对细胞周期的调节作用从而促进损伤骨骼肌纤维化,抑制肌细胞再生和肌管融合。Kulkarni等[4]通过破坏鼠胚胎干细胞中的TGF-β同族基因建立了TGF-β-null无效突变小鼠模型, 结果表明TGF-β在免疫细胞的增殖和组织分布的自身调节中有重要作用。Brown 等[10]在肌萎缩和急慢性肌肉疾病中发现,组织纤维化的发生都伴随TGF-1表达增高, 细胞外基质蛋白合成增加,降解减少。
在本实验模型中, 从骨骼肌中TGF-β的变化情况可以看出,力竭运动E0、E24、E48组与对照组相比较均有极显著性降低(P < 0.01),但各组在时相上的变化虽有波动,但无显著性差异。 由此推测,实验大鼠在一次性离心力竭运动后, 机体受到了一定的损伤,可能导致骨骼肌卫星细胞被激活,开始处于增殖期, 此时对肌卫星细胞具有正向调节作用的生长因子处于高表达状态, 而这些正向调节因子与TGF-β的拮抗作用导致这一时期的TGF-β处于低水平表达状态, 而使TGF-β对骨骼肌卫星细胞的抑制作用明显低于其他正向调节因子对骨骼肌卫星细胞的促进作用。 关于TGF-β的作用机制还有待进一步研究证实。
4 总结
(1)大鼠骨骼肌卫星细胞体外培养结果显示,钝挫伤刺激对骨骼肌卫星细胞有较强的激活作用,且钝挫伤即刻组比钝挫伤后24小时组体外增殖、 分化更快,数量更多。 另外,新生鼠肌肉在未受刺激条件下,其卫星细胞即具有较强的增殖、分化能力。
(2) 一次力竭离心运动后, 与安静对照组相比较, 力竭组大鼠骨骼肌中PDGF均显著性升高,而TGF-β均呈现显著性降低, 且力竭各组之间无显著性差异。这提示PDGF在肌肉损伤修复中可能具有正性作用,而TGF-β则可能起着负性调节因子的作用。
[1] Gaster M,Beck -Nielsen H,Schroder HD. Proliferation conditions for human satellite cells. The fractional content of satellite cells. APMIS,2001,109(11):726-734.
[2] 于秋华,朱道立.大鼠快肌卫星细胞移植在肌肉钝挫伤模型中的修复作用.江苏农业科学,2010(1):54-57.
[3] 于新凯,石鹏超,左群.运动性损伤后大鼠骨骼肌转化生长因子-β1变化的研究. 中国体育科技,2011,47(5):128-133.
[4] Kulkarni AB,Huh CG,Becker D,et al.Transforming growth factorβ1 null mutation in mice causes excessive inflammatory response and early death. Proc. Natl. Aead.Sei.USA.1993,90(2):770-774.
[5] 陈松建.血小板衍化生长因子及其受体与疾病关系研究进展.医学综述,2008,14(10),1441-1444.
[6] Antoniades HN,Chung CK. Expression of csisi-plateletderived growth factor B,Insulin-like growth factor I,and transforming growth factor a messenger RAN s and their respective receptor messenger RAN s in primary human gastric carcinomas: In vivo studies with in situhy-bridzation and immunocy to chemistry. Cancer Res 1992,52(12): 3453-3459.
[7] Kami K,Masuhara M,Kashiba H,et al. Changes of vinculin and extracellular matrix components following blunt trauma to rat skeletal muscle.Med Sci Sports Exerc,1993,25(7):832-840.
[8] 张立贵,王传富,黄晓辉.大鼠眼外肌成肌细胞的增殖及分化特征. 中国组织工程与临床康复,2007,11(24):4702-4705.
[9] Peterson JM,Bryner RW,Alway SE. Satellite cell proliferation is reduced in muscles of obese Zucker rats but restored with loading. Am J Physiol Cell Physiol,2008,295(2): C521 - C528.
[10] Brown RD,Ambler SK,Mitchell MD,et al.The cardiac fibroblast: therapeutic target in myocardial remodeling and failure. Annu Rev Pharmacol Toxicol,2005,45:657-687.

