鸡滑液支原体乳酸脱氢酶的克隆表达及其表达产物活性研究
任 峰,谭 磊,包世俊,张凡庆,陆 凤,仇旭升,宋翠萍,孙英杰,陈书明,丁 铲
(1.山西农业大学动物科技学院,太谷 030801;2.中国农业科学院上海兽医研究所,上海 200241)
鸡滑液支原体乳酸脱氢酶的克隆表达及其表达产物活性研究
任 峰1,2,谭 磊2,包世俊2,张凡庆2,陆 凤2,仇旭升2,宋翠萍2,孙英杰2,陈书明1,丁 铲2
(1.山西农业大学动物科技学院,太谷 030801;2.中国农业科学院上海兽医研究所,上海 200241)
根据GenBank中鸡滑液支原体(Mycoplasma synoviae, MS)MS53株的乳酸脱氢酶序列设计一对特异性上下游引物,通过PCR扩增获得MSWVU1853菌株的乳酸脱氢酶基因并将其克隆至pGEM-T Easy载体,测序正确并成功完成点突变后连接表达菌pET-28a(+),将重组表达质粒pET-28a-ldh转化表达菌BL21(DE3)。经IPTG诱导成功表达蛋白rMSLDH并测定其酶促活性。结果显示,重组表达的rMSLDH具有较强酶活性;最适反应温度40℃,最适pH7.5;Al2+和Ba2+可增加酶活性;Cr3+作为该酶的辅因子,在一定浓度内能有效的促进酶促反应进行;Cu2+作用下酶几乎失活,Fe3+、Mn2+、Ni2+、Zn2+对酶产生不同程度的抑制作用;其米氏常数(Km)为0.365 mmol/L ,最大反应速率(Vm)为0.98 μmol(L*min)。本研究结果为更好地研究鸡滑液支原体乳酸脱氢酶的生物学功能提供了参考。
滑液支原体;乳酸脱氢酶;原核表达;酶活性
滑液支原体(Mycoplasma synoviae,MS)又叫鸡滑液囊支原体,该支原体可以侵害幼龄鸡和火鸡的关节滑液、腱鞘膜和气囊[1],可造成关节、腱鞘和脚掌肿胀,气囊有干酷物[2-4]。调查表明,在我国各地鸡滑液囊支原体的感染率达到20.7%[2]。虽然MS不能直接造成禽类死亡,但在鸡群中可长期蔓延,导致饲料利用率低、生长发育迟缓、淘汰率增高、产蛋量下降,造成严重的经济损失[5-7]。
支原体是一种具有很小基因组和蛋白质组的最小的自我复制的微生物。支原体与宿主的相互作用主要通过膜蛋白中的可溶性脂蛋白及血凝素蛋白(variable lipoprotein haemagglutinin,VlhA)[8]。由于简化的基因组和有限的生物合成能力,需要从宿主细胞中获得核酸、氨基酸、脂肪酸、维生素等营养物质,引起宿主细胞的严重损伤[9]。
乳酸脱氢酶(lactate dehydrogenase,LDH)是一种在糖代谢中催化乳酸和丙酮酸之间可逆反应的一组同工酶,广泛存在于微生物、动植物细胞内,参与糖代谢。在哺乳动物中有两种不同的LDH亚基,一种是M型(或称为A型),一种是H型(或称B型),可构成5种同工酶,而在原核生物中,LDH由两种亚基构成iLDH和FDP激活的两种同工酶[10]。
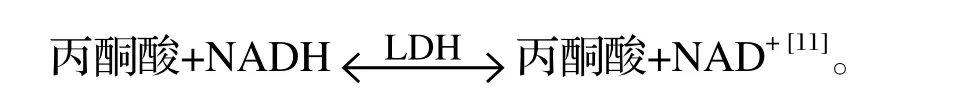
LDH在厌氧条件下能够催化丙酮酸接受NADH上的氢,生成乳酸;当动物体内缺少葡萄糖时,LDH还可以催化乳酸生成丙酮酸并经糖异生途径生成葡萄糖。其催化丙酮酸的化学式:
自1959年由Markert和Moller[14]发现LDH后,已有大量关于LDH分离纯化的文献报道,然而关于鸡滑液支原体中的LDH相关功能的研究尚未报道。因此,本研究通过对MSLDH基因的扩增、原核表达及其表达产物酶促活性的研究,为进一步研究MSLDH的生物学功能以及对MS引起疾病的防控奠定基础。
1 材料和方法
1.1 主要试剂及其来源普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒、E.coliDH5α、BL21(DE3)均购自北京天根生化科技有限公司;限制性内切酶BamHⅠ和XhoⅠ大连宝生物工程有限公司;表达菌pET-28a(+)为本实验室提供;pGEM-T Easy 载体和T4 DNA连接酶购自Promega公司;蛋白质纯化试剂盒和Ni-NTA His-Bind Resin:Novagen公司;胰蛋白胨、酵母提取物:OXOID公司;IPTG、青霉素、卡那霉素、氨苄霉素、丙酮酸(pyruvic acid PA)、NADH、兔肌肉乳酸脱氢酶标准均购自Sigma公司;BCA蛋白定量试剂盒购自碧云天生物有限公司;NAD购自Roche公司;Horse serum购自Gibco公司;其他试剂均为国产分析纯产品。
1.2 菌种、培养基和培养方法菌种MSWVU1853购自中国兽医药品监察所;支原体基础培养基购自青岛高科园海博生物技术有限公司。按照培养基基础说明书配制液体培养基,121℃高压灭菌15 min,待培养基冷却后加入100 mL/L的灭活马血清和终浓度0.1 g/L的NAD。取适当的培养基接种MSWVU1853后置50 mL/L CO2培养箱中,37℃培养。
1.3 LDH基因提取克隆表达及其产物的纯化
1.3.1 LDH基因的提取 取生长至对数期的MSWVU1853菌液100 mL,10 000×g低温离心5 min后弃上清,用PBS洗3遍后,200 μL PBS悬起沉淀,沸水浴10 min,冰浴5~10 min后,12 000×g常温离心10 min,取上清即为MS基因组DNA,-80℃冻存备用。
1.3.2 目的基因的PCR扩增 试验所用引物均是参考GenBank中MS53乳酸脱氢酶序列,用Primer Premier 5.0软件设计引物并由生工生物工程(上海)股份有限公司合成,引物序列见表1。
用上述提取的DNA为模板,并以LDHF和LDHR为引物对MS的LDH进行PCR扩增,产物回收后与pGEM-T Easy 载体连接后转化DH5α,挑阳性菌转液体培养12 h后提质粒送上海生工进行测序。根据测序结果,通过Overlapping PCR将影响大肠杆菌表达的TGA密码子突变为TGG,将回收产物与pGEM-T Easy 载体连接后转化DH5α,挑阳性菌转液体培养12 h后提质粒送上海生工进行测序。
1.3.3 乳酸脱氢酶原核表达及表达产物的纯化 将测序正确的LDH质粒用BamH I和XhoI进行双酶切并与用同样酶双酶切过的pET-28a(+)空载体质粒进行连接,构建原核表达质粒pET-28a-ldh并转化表达菌BL21(DE3),挑取5~6个单菌落分别接种到3 mL含卡那霉素100 μg/mL的液体LB培养基中,37℃摇床中220 r/min震荡培养过夜。将过夜培养的菌液按10 mL/L转接种到2YT培养基中,继续37℃摇床中220 r/min震荡培养,待OD600达到0.6~0.8时,加入终浓度为1.0 mmol/L的IPTG,18℃、180 r/min诱导12 h。菌体离心(10 000 ×g、10 min)后用PBS(pH7.5)洗涤3次,重悬后超声裂解离心分离上清和沉淀,超声条件为功率300 w,工作4 s,间歇15 s,共超声30 min。BCA蛋白定量后SDS-PAGE检测蛋白的可溶性。确定上清表达后用200 mL 2YT进行大量诱导表达,用His*Bind蛋白纯化试剂盒纯化蛋白。用纯化后的His-LDH免疫兔子,三免后采血,5000×g、10 min获得上清作为多抗。对His-LDH进行Western blot分析,上述血清作为一抗,二抗用HRP标记羊抗兔血清。
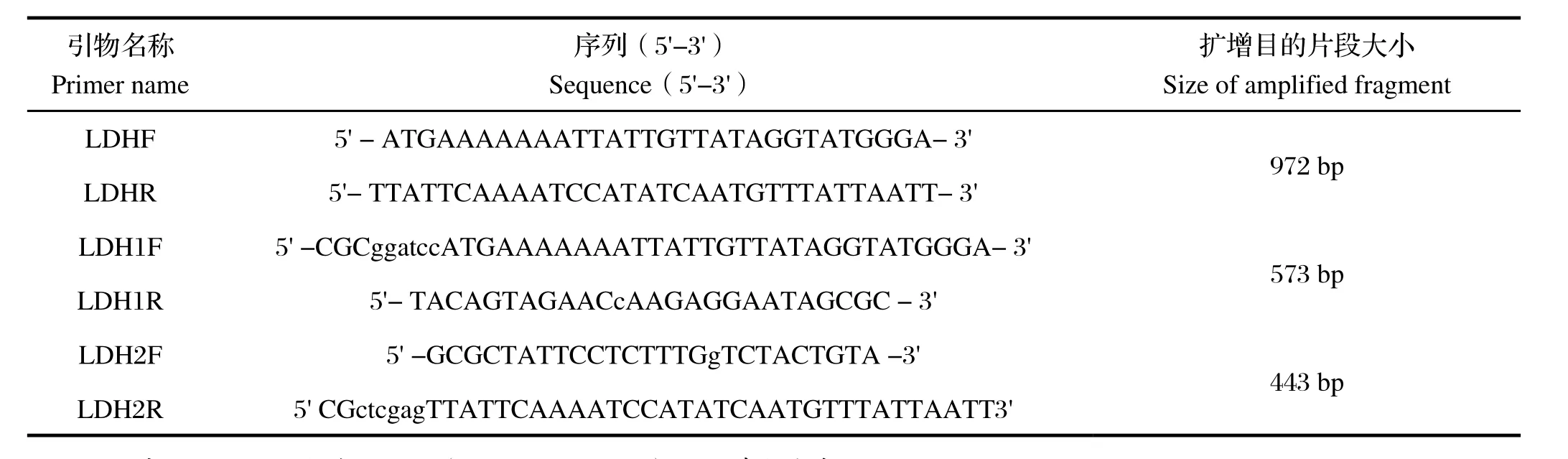
表1 本研究所使用的PCR引物及其序列Table 1 Sequences of primers used in this study
1.4 His-LDH活性及其影响因素的测定
1.4.1 His-LDH比活性的测定 该实验原理是LDH催化丙酮酸还原产生乳酸,设定反应体系为220 μL,含有20 mmol/L的NADH,粗酶液10 μL含蛋白1.25 μg,向体系中加入终浓度为50 mmol/L的丙酮酸200 μL开始反应[12]。该反应在分光光度计340 nm波长下测量[13]。每隔1 min测1次,至30 min结束,记录各
时间点的光吸收值。同时以兔肌肉的LDH做阳性对照。配制不同浓度的粗酶液(0.125、0.25、0.5、1.0 μg/μL)分别测定酶促活性。
1.4.2 不同温度对His-LDH活性的影响 设定反应pH7.5,分别测定10℃、20℃、30℃、37℃、40℃、45℃、50℃、60℃时His-LDH的酶促活性。0~20 min每隔1 min测定1次该反应的OD340值,每个温度点重复测定3次。
1.4.3 不同pH值对His-LDH活性的影响 设定反应温度37℃,分别测定pH为2.0、6.4、7.5、8.0、12.0的缓冲液中His-LDH的酶促反应值。每个pH点重复测定3次,了解不同pH值对His-LDH活性的影响。
1.4.4 不同金属离子对His-LDH活性的影响 用终浓度1 mmol/L的NiSO4、BaCl2、CuSO4、AlCl3、ZnCl2、MnCl2、CaCl2、MgSO4的缓冲液配制反应物,调pH7.5,37℃下测定His-LDH活性。同样测定该反应0~20 min每隔1 min的OD340值,每种金属离子重复测定3次。
1.4.5 不同浓度底物对酶活的影响 在上述最适pH反应缓冲液中加入不同浓度的丙酮酸(10、25、50、100 mmol/L)。0~20 min每隔1 min测定1次OD340值,每个浓度重复测定3次。
2 结果
2.1 乳酸脱氢酶基因克隆经过Overlap PCR扩增过的LDH基因大小与预算的大小相同(图1)。胶回收产物经双酶切后与pGEM-T Easy 载体连接,挑阳性菌转液体LB氨苄抗性培养基中过夜培养,质粒提取后送测序,结果正确。将正确测序的LDH基因与pET-28a(+)连接,构建pET-28a-ldh双酶切鉴定结果。
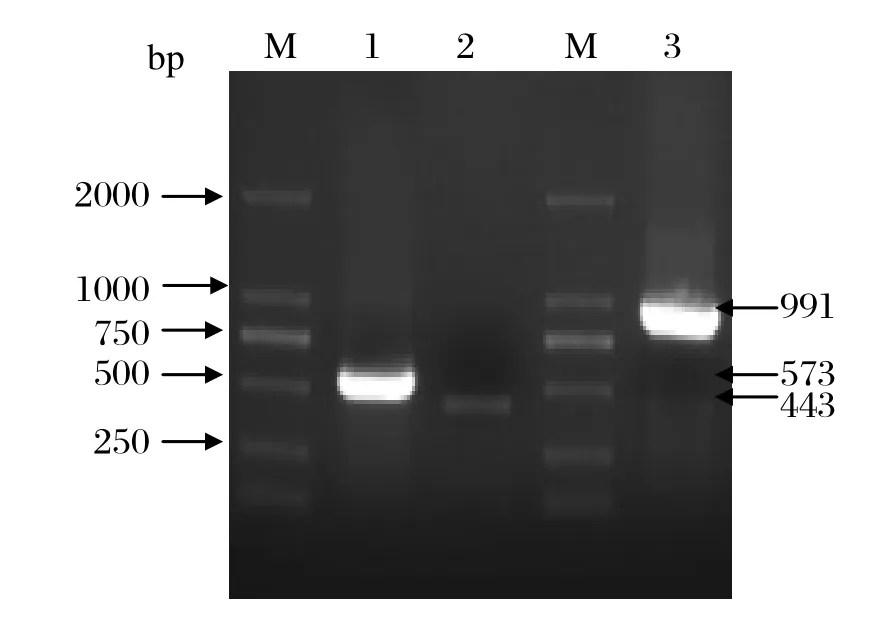
图1 乳酸脱氢酶基因的PCR扩增结果Fig.1 Overlap PCR amplif cation of LDH gene
2.2 乳酸脱氢酶基因表达及产物纯化将pET-28aldh转化表达菌BL21(DE3),2YT培养至OD600达到0.6~0.8时,加入终浓度1.0 mmoL/L的IPTG过夜表达,结果鉴定见图2,大小约为34 kDa。将蛋白纯化后免疫兔子获得多抗对该蛋白进行Western blot分析结果见图3。
2.3 乳酸脱氢酶比活力兔肌肉LDH作为标准品,LDH纯化蛋白作为粗酶液,两种样品比对酶活结果,粗酶液活性略高(图4A)。丙酮酸浓度不变时,LDH活性随粗酶液量的增加而升高(图4B)。当丙酮酸浓度不同时LDH的酶活也有差异(图4C)。
2.4 温度和pH对酶活影响当温度在0℃~50℃区间都有酶活,50℃时酶活明显降低,超过50℃酶失活(图5A)。pH对酶活也有很明显的影响,pH7.0~pH8.0酶活比较强,低于2.0或超过12.0时酶活明显降低甚至失活(图5B)。利用图4C数据通过双倒数法作图(图5C)求得LDH的米氏常数(km)为0.365 mmol/L,最大反应速率(Vm)为0.98μmol(L*min)。

图2 重组蛋白的SDS-PAGE分析Fig. 2 SDS-PAGE analysis of the recombinant protein

图3 重组蛋白Western blot分析Fig.3 Western blot analysis of the recombinant protein
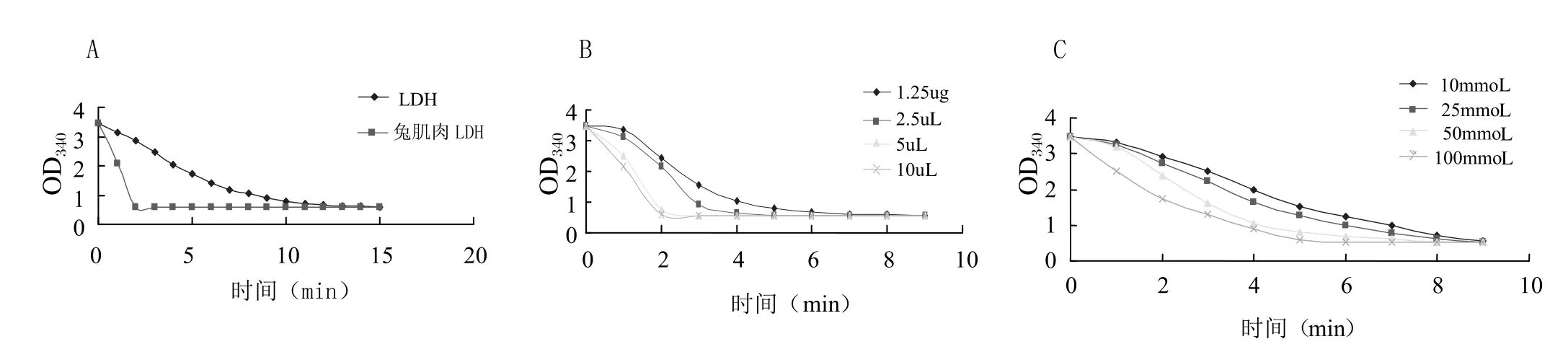
图4 重组蛋白酶活性分析Fig. 4 Analysis of His-LPH activity

图5 温度和pH对酶活的影响Fig. 5 Effect of temperature and pH on His-LDH activity in vitro
2.5 金属离子对酶活的影响不同金属离子对酶活性影响很明显,Al3+和Ba2+对LDH活性明显加强,Mn2+对酶活性有较小抑制,Ni2+、Zn2+对酶活性有明显的抑制,Cu2+作用下酶几乎失活(表2)。
3 讨论
乳酸脱氢酶是微生物体内进行糖酵解途径中重要的酶类[2],在无氧条件下加入电子载体它可以催化丙酮酸生成乳酸,有的生物体产生L-LDH,有的生物体产生D-LDH,使生物体糖代谢能够顺利进行,从而保证生物体正常的生命活动[14]。支原体属于柔摸体纲,在极端的生物还原进化过程中失去很多基因,形成了具有最小基因组进行自我复制的特征[15],其能量来源主要靠糖酵解途径。乳酸脱氢酶又是糖酵解和糖异生中重要的酶之一,参与滑液支原体产能,从而影响其生命活动。因此,研究MS乳酸脱氢酶的酶促动力学将为进一步了解和研究滑液支原体的代谢奠定基础。

表2 金属离子对酶活的影响Table2 Effect of metaliron on His-LDH activity in vitro
本研究成功获得了鸡滑液支原体中乳酸脱氢酶蛋白,经过纯化达到酶活较高的粗酶液,有利于进行后续的酶活试验。
MS中乳酸脱氢酶基因表达的产物与兔肌肉乳酸脱氢酶酶活性相比较,前者有较高活性。根据双倒数法得到的乳酸脱氢酶米氏常数(Km=0.365 mmol/L)和最大反应速率(Vm=0.98μmol(L*min)),更充分证明该酶有较高的酶活性,正因为如此在MS糖代谢过程中该酶才能满足自身能量需求,有利于支原体生长。
经过试验证明pH在6.4~7.5,乳酸脱氢酶都有较高的酶活性,当pH小于2.0或者大于12.0时酶活性很低,在pH7.5时最高,以上数据证明MS中乳酸脱氢酶可在弱碱性条件下发挥正常的催化功能维持MS正常生理。经过试验证明当温度在0℃~50℃之间乳酸脱氢酶都有活性,当高于50℃时酶活丧失,乳酸脱氢酶可分L-乳酸脱氢酶和D-乳酸脱氢酶,其中D-乳酸脱氢酶热稳定性较弱,与Garvie结论一致[16],D-乳酸脱氢酶与本实验中乳酸脱氢酶很相符。
[1] Buim M R, Buzinhani M, Yamaguti M,et al. Mycoplasma synoviae cell invasion∶ elucidation of the Mycoplasma pathogenesis in chicken[J]. Comp Immunol Microbiol Infect Dis, 2011, 34(1)∶ 41-47.
[2] 吴移谋, 叶元康. 支原体学[M]. 2版. 北京∶ 人民卫生出版社, 2008∶ 49-56.
[3] Chin R P, Meteyer C U, Yamamoto R,et al. Isolation of Mycoplasma synoviae from the brains of commercial meat turkeys with meningeal vasculitis[J]. Avian Dis, 1991, 35(3)∶ 631-637.
[4] Kleven S H, Fletcher O J, Davis R B. Influence of strain of Mycoplasma synoviae and route of infection on development of synovitis or airsacculitis in broilers[J]. Avian Dis, 1975, 19(1)∶ 126-135.
[5] Stipkovits L, Kempf I. Mycoplasmoses in poultry[J]. Rev Sci Tech, 1996, 15(4)∶ 1495-1525.
[6] Kleven S H, Rowland G N, Kumar M C. Poor serologic response to upper respiratory infection with Mycoplasma synoviae in turkeys[J]. Avian Dis, 2001, 45(3)∶ 719-723.
[7] Branton S L, Lott B D, May J D,et al. The effects of F strain Mycoplasma gallisepticum, Mycoplasma synoviae, and the dual infection in commercial layer hens over a 44-week laying cycle when challenged before beginning of lay. II. Egg size distribution[J]. Avian Dis, 1999, 43(2)∶326-330.
[8] Noormohammadi A H. Role of phenotypic diversity in pathogenesis of avian mycoplasmosis[J]. Avian Pathol, 2007, 36(6)∶ 439-444.
[9] 曹中赞, 栾新红, 刘胜旺, 等. 禽滑液囊支原体研究进展[J]. 动物医学进展, 2012, 34(11)∶ 113-117.
[10] Ismailov A D, Danilov V S, Egorov N S. Lactate dehydrogenase activity and its isoenzyme in a system coupled with bacterial luciferase[J]. Vopr Med Khim, 1984, 30(6)∶ 45-50.
[11] 周静. 乳酸脱氢酶的分离纯化及其性质的研究[J]. 赤峰学院学报(自然科学版), 2009, 25 (9)∶ 111-113.
[12] Contag P R, Williams M G, Rogers P. Cloning of a lactate dehydrogenase gene from Clostridium acetobutylicum B643 and expression in Escherichia coli[J]. Appl Environ Microbiol, 1990, 56(12) ∶ 3760-3765.
[13] Ozkan M, Yilmaz E I, Lynd LR,et al. Cloning and expression of the Clostridium thermocellum L-lactate dehydrogenase gene in Escherichia coli and enzyme characterization[J].Can J Microbiol, 2004, 50(10)∶ 845-851.
[14] Savijoki K, Palva A. Molecular genetic characterization of the L-lactate dehydrogenase gene (ldhL) of Lactobacillus helveticus and biochemical characterization of the enzyme[J]. Appl Environ Microbiol, 1997, 63(7)∶ 2850-2856.
[15] Dusanic D, Bencina D, Oven I,et al. Mycoplasma synoviae induces upregulation of apoptotic genes, secretion of nitric oxide and appearance of an apoptotic phenotype in infected chicken chondrocytes[J]. Vet Res, 2012, 43(1)∶ 7-9.
[16] Garvie E I. Bacterial lactate dehydrogenases[J]. Microbiol Rev, 1980, 44(1)∶ 106-139.
CLONING AND EXPRESSION OF LACTATE DEHYDROGENASE GENE OF MYCOPLASMA SYNOVIAE AND DETERMINATION OF ENZYMATIC ACTIVITY OF THE RECOMBINANT PROTEIN
REN Feng1,2, TAN Lei2, BAO Shi-jun2, ZHANG Fan-qing2, LU Feng2, QIU Xu-sheng2, SONG Cui-ping2, SUN Ying-jie2, CHEN Shu-ming1, DING Chan2
(1. College of Animal Science and Veterinary Medicine, Shanxi Agricultural University, Taigu 030801, China; 2. Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
In the present study, a pair of specific primers of lactate dehydrogenase (LDH) were designed according to the sequence ofMycoplasma synoviaeMS53 strain in GenBank. Then, the LDH gene ofMSWVU1853 strain was amplif ed in PCR and cloned into pGEM-T Easy. After sequencing and spot mutation, the LDH gene was cloned into prokaryotic expression plasmid pET-28a (+). The recombinant plasmid pET-28a-LDH was transformed into BL21 (DE3). The expression of rLDH was induced with IPTG and its enzymatic activity was detected. The results showed that rLDH possessed high activity. The optimal reaction conditions were determined to be 40℃ and pH 7.5. Its enzymatic activity was stimulated with addition of Ba2+, Al3+and Cr3+but inhabited with Fe3+, Mn2+, Ni2+and Zn2+. The michaelis constant (Km) of LDH was 0.365 mmol/L and the maximum reaction velocity (Vm) was 0.98 μmol(L*min).
Mycoplasma synoviae; lactate dehydrogenase; prokaryotic expression; enzymatic activity
S852.62
A
1674-6422(2014)02-0052-06
2013-12-20
公益性行业科研专项(201303044)
任峰,男,硕士研究生,预防兽医学专业
陈书明,E-mail:chensm2001@yahoo.com.cn;丁铲,E-mail:shoveldeen@shvri.ac.cn

