柔嫩艾美耳球虫G6-PI基因的克隆、序列分析与原核表达
刘 田,廖申权,戚南山,吴彩艳,李 娟,吕敏娜,李国清,孙铭飞
(1.华南农业大学兽医学院,广州 510640;2.广东省农业科学院动物卫生研究所,广州 510640)
柔嫩艾美耳球虫G6-PI基因的克隆、序列分析与原核表达
刘 田1,2,廖申权2,戚南山2,吴彩艳2,李 娟2,吕敏娜2,李国清1,孙铭飞2
(1.华南农业大学兽医学院,广州 510640;2.广东省农业科学院动物卫生研究所,广州 510640)
为研究柔嫩艾美耳球虫(Eimeria tenella)葡萄糖-6-磷酸异构酶(glucose- 6-phosphate isomerase, G6-PI)的生化特性,本研究对其基因进行了克隆和原核表达。根据NCBI已公布的E. tenellaHoughton株G6-PI的基因序列(GI: 298161921)设计特异性引物,运用RT-PCR方法扩增EtG6-PI基因序列,并将其克隆到表达载体pColdI、pCold43a中,构建重组质粒pColdIEtG6-PI、pCold43a-EtG6-PI,经测序鉴定正确后,将其转化感受态细胞E. coliRosetta (DE3),并进行IPTG诱导表达。结果表明,E. tenellaG6-PI的ORF序列(1650 bp),编码550个氨基酸;重组菌pColdI-EtG6-PI、pCold43a-EtG6-PI均能成功诱导表达,其中pCold43a-EtG6-PI表达部分可溶性蛋白,表达产物纯化后可用于酶生化特性分析。柔嫩艾美耳球虫G6-PI基因的成功克隆表达为该酶的功能研究奠定了基础。
柔嫩艾美耳球虫;葡萄糖-6-磷酸异构酶;克隆;原核表达
鸡球虫病是由一种或几种艾美耳球虫感染引起的以肠道病变为主的寄生虫病,严重危害集约化养鸡业的发展,每年因此造成的经济损失高达25亿英镑以上[1]。柔嫩艾美耳球虫(E. tenella)是致病力最强的病原之一,可引起雏鸡血便,食欲减退,蛋鸡产蛋下降等症状。目前鸡球虫病的防控仍然是以药物预防为主,但鸡球虫广泛而严重的抗药性极大影响了球虫药的防治效果,生产上迫切需要新型抗球虫药物。近年来,基于药物靶标的药物筛选已成为当今药研发的主流方法,药物靶标的功能解析成为研制新型药物最为重要的一环。
葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase,G6-PI)在糖酵解过程中催化葡萄糖-6-磷酸转变为果糖-6-磷酸的可逆反应,参与球虫的能量代谢过程,对球虫的生存起着重要作用。2003年,Readmond等[2]利用RNAi技术研究布氏锥虫(Trypanosoma brucei)葡萄糖-6-磷酸异构酶,发现G6-PI的下调使得T. brucei的生长受到50%抑制。随着现代生物技术的快速发展,T. brucei及墨西哥利什曼原虫(Leishmania mexicana)G6-PI的高级结构[3-5]已经解析,基于该酶结构特征开展了一系列的抑制物筛选工作,结果显示,葡萄糖-6-磷酸异构酶是抗顶复门原虫药物研发的潜在靶标[6]。目前,仅在NCBI数据库中发现注释的EtG6-PI基因序列,未见相关的研究报道。本研究旨在对EtG6-PI基因进行克隆、序列分析及重组表达,为系统研究EtG6-PI的生物学功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 试验动物及饲料 1日龄岭南黄肉鸡,购自广东省农业科学院畜牧研究所种鸡场;全价肉仔鸡饲料(不含抗球虫药和抗菌药)。
1.1.2 虫株、载体及菌株E. tenella(广东株)卵囊为广东省农业科学院动物卫生研究所寄生生物室分离保存;pMD18-T 载体购自宝生物(大连)有限公司;表达载体pColdI、E. coliDH 5α、E. coliRosetta(DE3)株由广东省农业科学院动物卫生研究所寄生生物室保存;pCold43a表达载体由南京农业大学茅翔教授馈赠。
1.1.3 试剂与试剂盒 氨苄青霉素(ampicillin,Amp)、IPTG、SDS、DMSO、EDTA、DTT、Tris、异丙基-β-D-硫代半乳糖苷(isopropyl-βd-thiogalactoside)等购自上海生工生物技术服务有限公司;DNA Marker (DL2000/DL4500)为天根生物技术有限公司;胰酶(trypsin)为Hyclone公司产品;E.Z.N.A质粒小量制备试剂盒和DNA胶回收试剂盒为Omega公司产品;LATaqTM、琼脂糖、RTPCR试剂盒为宝生物工程(大连)有限公司产品;PreMixTaqEx为天根生化科技有限公司产品;试验中所需的现配溶液,参照《分子克隆实验指南》配制[7]。
1.1.4 引物 根据NCBI已公布的EtG6-PI cDNA序列(GI∶ 298161921),利用Primer Premier 5.0软件设计2对引物,由上海英俊生物工程公司合成。上游引物(EtG6-PI F)∶ 5'-GCGGAATTCATGTCTTCT CAGTTCGCCGCCT-3';下游引物(EtG6-PI R)∶5'-GCGGTCGACTTAGGCAGATAAATACTTCTGC AGT-3';含EcoRI酶切位点(下划线)上游引物F∶5'-CCGGAATTCGCGGAATTCATGTCTTCTCAGTT CGCCGCCT-3';含SalI酶切位点(下划线)下游引物R:5'-CCCGTCGACGCGGTCGACTTAGGCAGA TAAATACTTCTGCAGT-3'
1.2 方法
1.2.1 E. tenella第二代裂殖子的分离及纯化 参照文献 [8]的方法进行E. tenella第二代裂殖子的分离及纯化。2周龄无球虫感染鸡每只口服20×104孢子化卵囊,感染后第112 h扑杀取盲肠,剖开肠腔,弃肠内容物用PBS洗涤3次,再用刀背轻刮取肠黏膜,以含2.5 g/L胰酶和7.5 g/L 脱氧胆酸钠的PBS 缓冲液于40℃消化30 min,纱布过滤去除组织碎片后,滤液加PBS 缓冲液,1000×g离心10 min,重复2次,所得沉淀即为纯化的裂殖子。
1.2.2 E. tenella第二代裂殖子总RNA的提取 参照Invitrogen 公司的TRIzol LS®Reagent 试剂盒说明书。
1.2.3 EtG6-PI基因的RT-PCR扩增 以上述提取的总RNA为模板,用TaKaRa公司Prime ScriptTM1st Strand synthesis Kit 试剂盒反转录为cDNA;以cDNA为模板,EtG6-PI F、EtG6-PI R为引物,用LATaqTM酶扩增EtG6-PI。PCR条件:94℃预变性4 min;94℃变性 30 s;60℃ 退火30 s;72℃延伸2 min;35个循环;72℃再延伸7 min。PCR产物按试剂盒回收并连接到pMD18-T载体上,再将连接产物转化入E. coliDH 5α感受态细胞中,菌液PCR鉴定阳性菌落,阳性克隆送北京六合华大基因科技股份有限公司测序分析。
1.2.4 EtG6-PI基因序列分析 利用在线工具Translate tool(http://www.expasy.ch/tools/dna.htmL)翻译EtG6-PI序列,对氨基酸序列用SignalP 3.0 (http://www.cbs.dtu.dk/services/SignalP/)在线软件进行信号肽序列分析,利用TargetP 1.1 server(http://www.cbs.dtu.dk/services/TargetP/)在线分析软件对EtG6-PI进行亚细胞定位预测;利用在线软件(http://www.cbs.dtu.dk/services/TMHMM/)对EtG6-PI 的氨基酸序列进行跨膜结构域分析。根据PDB数据库(http://www.ebi.ac.uk/pdbsum/)与EtG6-PI三维结构数据库已知的蛋白质分子模板,利用晶体结构最为相似原理(http://swissmodel.expasy.org/workspace/index.phpfunc=modelling_simple1)对EtG6-PI进行三维结构预测。
1.2.5 重组质粒的构建及诱导表达 以E. coliDH 5α(pMD18-T-EtG6-PI)为模板,含EcoRI酶切位点上游引物F,含SalI酶切位点下游引物R为引物,扩增含EcoRI和SalI酶切位点的EtG6-PI片段,分别用EcoRI和SalI双酶切pCold I/pCold 43a质粒和EtG6-PI片段,胶回收试剂盒回收EtG6-PI片段和pCold I/pCold 43a酶切片段。目的片段与载体连接,转化感受态细胞E. coliDH 5α,菌液PCR鉴定阳性菌落,阳性样品送北京六合华大基因科技股份有限公司测序分析。选取测序正确的pColdI-EtG6-PI、pCold43a-EtG6-PI克隆,37℃培养过夜,按试剂盒分别提取重组质粒,将重组质粒pColdI-EtG6-PI、pCold43a-EtG6-PI分别转入感受态细胞E. coliRosetta (DE3),菌液PCR鉴定阳性克隆,阳性菌落在10 mL(Amp 100 μg/mL)LB培养液中培养12 h,按1∶100扩大培养于LB(含Amp)培养基中,37℃培养至OD600为0.6左右,加入1 mmol/L IPTG诱导表达。离心弃上清收集菌体,将菌体重悬于PBS溶液中,冰浴超声破碎,10 800×g离心20 min,超声破碎后上清及沉淀分别用SDS-PAGE分析重组蛋白在菌体中的分布。
2 结果
2.1 EtG6-PI基因的RT-PCR扩增利用TRIzol方法提取第二代裂殖子总RNA,根据NCBI已公布的基因序列设计特异性引物,以第二代裂殖子总RNA为模板,进行RT-PCR扩增。1%琼脂糖凝胶电泳分析显示,在1700 bp处有特异性目的条带,与预期片段大小一致(见图1);将PCR产物与pMD18-T载体连接,转化至E.coliDH5α感受态细胞,菌液PCR鉴定阳性克隆,阳性克隆菌送北京六合华大基因科技股份有限公司测序分析。

图1 EtG6-PI序列扩增结果及菌液PCR鉴定结果Fig.1 PCR product of EtG6-PI and identif cation of its positive clone
2.2 EtG6-PI基因分析
2.2.1 序列分析 测序分析发现EtG6-PI全长编码序列1650 bp,利用clustalW2比对分析发现,与NCBI数据库注释的序列大小一致,相似性高达99%(见图2)。
2.2.2 EtG6-PI亚细胞定位、信号肽分析 利用SignalP 3.0和TargetP 1.1 server在线软件对EtG6-PI进行信号肽序列分析和亚细胞定位预测,结果显示EtG6-PI无信号肽,且准确系数为2。
2.2.3EtG6-PI跨膜结构域分析 对EtG6-PI的氨基酸序列进行跨膜结构域分析,发现该蛋白无跨膜结构域(见图3)。

图2 EtG6-PI扩增序列与注释序列的比对分析结果Fig.2 Alignment of the amplif ed fragment of EtG6-PI with the predicted sequence
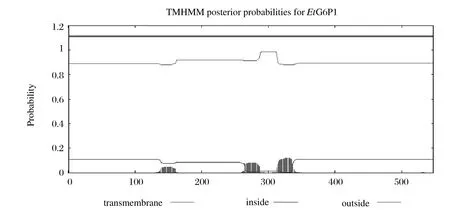
图3 EtG6-PI跨膜结构域分析Fig.3 Prediction of transmembrane helices in EtG6-PI
2.2.4EtG6-PI三级结构预测 三维结构预测显示EtG6-PI单体由27个α螺旋,12个β折叠构成(见图4)

图4 EtG6-PI三级结构预测Fig.4 The predicted tertiary structure of EtG6-PI
2.3 重组质粒的构建及鉴定对EtG6-PI(含EcoRI、SalI酶切位点)片段和pColdI/pCold43a空质粒进行双酶切,酶切产物经1% 琼脂糖凝胶电泳,切胶回收,连接、转化、PCR鉴定,成功获得pColdIEtG6-PI、pCold43a-EtG6-PI重组质粒;用EcoRI和SalI对pColdI-EtG6-PI、pCold43a-EtG6-PI重组质粒进行双酶切鉴定,获得大小约1700 bp片段,与预测大小相符。
2.4 重组质粒在大肠杆菌中诱导表达将带有pColdIEtG6-PI、pCold43a-EtG6-PI重组质粒的E.coliRosetta (DE3)菌液,扩大培养,经IPTG于22℃诱导表达,离心菌液,PBS重悬菌体,冰浴超声破碎后分别取上清与沉淀进行SDS-PAGE分析。pCold I-EtG6-PI融合表达蛋白大小约为61.4 kDa,超声裂解后,SDS-PAGE分析发现,重组蛋白以包涵体形式存在(见图5);pCold43a-EtG6-PI融合表达蛋白大小约为113.4 kDa(pCold 43a载体蛋白大小为52 kDa),超声裂解后,SDS-PAGE分析,蛋白表达量较pCold I-EtG6-PI少,但重组蛋白部分可溶(见图6),可溶性蛋白纯化后可用于酶生化特性分析。
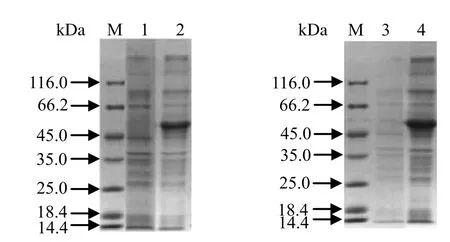
图5 pColdI-EtG6-PI表达产物的SDS-PAGE分析Fig.5 SDS-PAGE analysis of the expression product of pColdI-EtG6-PI

图6 pCold43a-EtG6-PI表达产物的SDS-PAGE分析Fig.6 SDS-PAGE analysis of the expression product of pCold43a-EtG6-PI
3 讨论
葡萄糖-6-磷酸异构酶具有多种生物学功能,主要参与糖代谢的糖酵解作用,糖代谢是生物体获取能量的主要方式。糖酵解过程在有氧或无氧条件下均可进行,是所有生物体进行葡萄糖分解代谢所必须的共同路径。寄生性原虫的生长发育需要获取能量,而直接提供能量的物质是ATP。机体生命活动的能量获取的主要途径为糖酵解途径,三羧酸循环及磷酸戊糖途径。研究表明,顶复门原虫在其发育过程中,大多数内生发育阶段为低氧或无氧的环境,使得其代谢方式与细菌有许多共同之处,并且不遵循“pasteur effect”(巴斯德效应),即在有氧条件下顶复门原虫仍主要依靠糖酵解途径获取能量[9-11]。这一重要特征决定了糖酵解途径的一些关键酶可以作为开发新型抗顶复门原虫药物的靶标。因而近年来顶复门原虫的糖酵解生化代谢途径成为研究的热点。
1994年,Nyame等[12]成功克隆了Leishmania. mexicanaG6-PI基因,亚基分子量为65 kDa,与恶性疟原虫(Plasmodium falciparum)G6-PI基因序列大小一致,编码604个氨基酸,超过90%存在于细胞质基质,少量存在于糖酵解酶体。随后,Concepcion等[13]研究发现枯氏锥虫(Trypanosoma cruzi)G6-PI亚基分子量为63 kDa,约60%存在于细胞质基质,40%存在于糖酵解酶体,蛋白以三聚体形式存在。Marchand等[14]研究表明T. bruceiG6-PI存在于糖酵解酶体,且等电点较低。2004年,Cordeiro等[4]对L. mexicanaG6-PI进行了蛋白结晶及X射线衍射分析,解析了LmG6-PI结构信息,为EtG6-PI的功能研究提供了可供借鉴的资料。
本研究克隆了柔嫩艾美耳球虫G6-PI基因,并在大肠杆菌原核表达系统中表达。原核表达系统具有高效、快捷、成本低及周期短等特点,被广泛地用于外源蛋白的重组表达。本试验最初构建的重组质粒pColdI-EtG6-PI,经诱导表达后未获得可溶性蛋白,随后选择pCold43a作为表达载体,发现pCold43a-EtG6-PI的蛋白表达量虽然有所降低,但获得了可溶性重组蛋白,满足后期试验需求。pCold43a表达载体带有NusA融合标签,在低温条件下有利于融合蛋白的表达,在一定程度上增加了表达蛋白的可溶性。本研究所获得的带NusA融合标签的可溶性蛋白,将用于EtG6-PI的生化特性分析,为EtG6-PI的功能研究提供了实验依据。
[1] Williams R B. A compartmentalised model for theestimation of the cost of coccidiosis to the world's chicken production industry[J]. Int J Parasitol, 1999, 29(8)∶ 1209-1229.
[2] Redmond S, Vadivelu J, Field M C. RNAi∶ an automated web-based tool for the selection of RNAi targets in Trypanosoma brucei [J]. Mol Biochem Parasitol, 2003, 128(1)∶115-118.
[3] Arsenieva D, Appavu B L, Mazock G H,et al. Crystal structure of phosphoglucose isomerase from Trypanosoma brucei complexed with glucose-6-phosphate at 1.6 A resolution[J]. Proteins, 2009, 74(1)∶ 72-80.
[4] Cordeiro A T, Hardré R, Michels P A,et al. Leishmania mexicana mexicana glucose-6-phosphate isomerase∶crystallization, molecular-replacement solution and inhibition[J]. Acta Crystallogr D Biol Crystallogr, 2004, 60(Pt 5)∶ 915-919.
[5] Sampathkumar P, Roach C, Michels P A,et al. Structural insights into the recognition of peroxisomal targeting signal 1 by Trypanosoma brucei peroxin 5 [J]. J Mol Biol, 2008, 381(4)∶ 867-880.
[6] Loo S S, Blake D P, Mohd-Adnan A,et al. Eimeria tenella glucose-6 -phosphate isomerase∶ molecular characterization and assessment as a target for anticoccidial control[J]. Parasitology, 2010, 137(8)∶ 1169-1177.
[7] 萨姆布鲁克. 分子克隆实验指南[M]. 黄培堂等译. 3版.北京∶ 科学出版社. 2002.
[8] Xie M Q, Gilbert J M, Fuller A L,et al. A new method for purification of Eimeria tenella merozoites [J]. Parasitol Res, 1990, 76(7)∶ 566-569.
[9] Maugeri D A, Cannata J J, Cazzulo J J. Glucose metabolism in Trypanosoma cruzi [J]. Essays Biochem, 2011, 51∶15-30.
[10] Polonais V, Soldati-Favre D. Versatility in the acquisition of energy and carbon sources by the Apicomplexa[J]. Biol Cell, 2010, 102(8)∶ 435-445.
[11] Senkovich O, Speed H, Grigorian A,et al. Crystallization of three key glycolytic enzymes of the opportunistic pathogen Cryptosporidium parvum [J]. Biochim Biophys Acta, 2005, 1750(2)∶ 166-172.
[12] Nyame K, Do-Thi C D, Opperdoes F R,et al. Subcellular distribution and characterization of glucose phosphate isomerase in Leishmania mexicana mexicana [J]. Mol Biochem Parasitol, 1994, 67(2)∶ 269-279.
[13] Concepcion J L, Chataing B, Dubourdieu M. Purification and properties of phosphoglucose isomerases of Trypanosoma cruzi [J]. Comp Biochem Physiol B Biochem Mol Biol, 1999, 122(2)∶ 211-222.
[14] Marchand M, Kooystra U, Wierenga R K,et al. Glucosephosphate isomerase from Trypanosoma brucei. Cloning and characterization of the gene and analysis of the enzyme [J]. Eur J Biochem, 1989, 184(2)∶ 455-464.
CLONING, SEQUENCE ANALYSIS AND PROKARYOTIC EXPRESSION OF GLUCOSE-6-PHOSPHATE ISOMERASE OF EIMERIA TENELLA
LIU Tian1,2, LIAO Shen-quan2, QI Nan-shan2, WU Cai-yan2, LI Juan2, LV Min-na2, LI Guo-qing1, SUN Ming-fei2
(1.College of Veterinary Medicine, South China Agricultural University, Guangzhou 510640, China; 2.Institute for Animal Health, Guangdong Academy Agricultural Sciences, Guangzhou 510640, China)
In order to analyze biochemical properties ofEimeria tenellaglucose-6- phosphate isomeraseEtG6-PI, the full-length of open reading frameEtg6-PI was amplif ed in RT-PCR from total RNA from the second-generation schizonts ofE. tenella. The amplif ed fragments were Results showed that the open reading frame was 1650 bp, sequenced. TheEtg6-PI gene was cloned into the expression vectors pColdI and pCold43a and expressed inE. coliRosetta (DE3). encoded a protein of 550 amino acids. The recombinant vectors pColdI-EtG6-PI or pCold43a-EtG6-PI was transformed intoE. coliRosetta (DE3) cells and the expression was induced with IPTG Soluble protein obtained from pCold43a-EtG6-PI purif de by the aff nity chromatography assay can be used for biochemical analysis of this enzyme. The prokaryotic expression ofE. tenellaG6-PI set important basis for function study on glucose-6-phosphate isomerase.
Eimeria tenella; glucose-6-phosphate isomerase; cloning; prokaryotic expression
S852.723
A
1674-6422(2014)02-0072-06
2014-01-07
国家自然科学基金项目 (31201902;31302087);珠江科技新星项目(2012J2200059);广东省重点实验室建设支撑项目(2012A061100006);广东省对外科技合作项目(2011B050700007)
刘田,男,硕士研究生,预防兽医学专业
李国清, E-mail:gqli@scau.edu.cn;孙铭飞, E-mail:smf7810@gmail.com

