鸭疫里默氏杆菌10个基因在菌株中的分布及序列分析
岳嘉蘋,王少辉,韩先干,白 灏,王小兰,侯湾湾,于圣青
(中国农业科学院上海兽医研究所,上海 200241)
鸭疫里默氏杆菌10个基因在菌株中的分布及序列分析
岳嘉蘋,王少辉,韩先干,白 灏,王小兰,侯湾湾,于圣青
(中国农业科学院上海兽医研究所,上海 200241)
检测鸭疫里默氏杆菌(Riemerella anatipestifer, RA)10个基因在不同菌株间的分布并进行序列分析,研究其在不同菌株中的保守性。分别选取8株RA的10个基因进行PCR扩增,扩增产物克隆于pMD18-T载体,进行序列测定和分析。结果显示:测定的8株RA菌株中均能检测到Lipid A、LuxE和TCTR编码基因,表明这些基因在不同血清型RA菌株中的保守性良好;TR基因仅从6株具有致病性的RA菌株中扩增得到,而2株非致病性RA菌株NJ1和NJ4未能扩增到,表明TR基因可能与RA菌株的致病性相关;IS1仅从6株血清1型和2型的RA菌株扩增得到,2株血清10型菌株均未扩增得到,提示IS1为血清10型菌株缺失基因。
鸭疫里默氏杆菌;PCR;序列分析
鸭疫里默氏杆菌(Riemerella anatipestifer, RA)病是当前危害我国养鸭业最重要的传染病之一,广泛分布于世界上各个养鸭国家[1]。1~8周龄鸭对本菌易感,尤以2~3周龄的鸭最易感,主要引起纤维素性心包炎、肝周炎、气囊炎等广泛纤维素性炎症,部分病鸭表现为神经症状、干酪性输卵管炎和生长障碍。
RA菌株的血清型较多,到目前为止,共报道有21个血清型(1~21 型)[2-9],各血清型之间无交叉保护[2]。RA菌株的致病性各异,部分菌株对易感鸭无致病性,其LD50大于1010CFU,而有些菌株的致病力很强,其LD50可低至100 CFU[10-12],血清型和致病性之间无相关性。
自1982年郭玉璞等[13]在北京确定血清1型的鸭疫里默氏杆菌感染后,我国各养鸭地区不断有出现鸭疫里默氏杆菌感染的报道。张大丙等[14-27]鉴定出我国还有血清 2、6、10、11、13、14 型和其他未知血清型的存在,表明我国存在的RA血清型具有一定的复杂性。在我国大部分的鸭场,感染鸭疫里默氏杆菌的发病率高达50%以上,死亡率可达到80%。然而,我们对鸭疫里默氏杆菌的毒力因子和发病机制却知之甚少。因此,本文旨在通过对不同血清型鸭疫里默氏杆菌的10个相对保守基因进行PCR扩增以及序列测定分析,研究这些基因在不同血清型菌株之间的分布和保守性是否呈现一定的规律性。
1 材料与方法
1.1 菌株和培养条件鸭疫里默氏杆菌血清1型菌株CH3、WJ4、NJ1、NJ4,血清2型菌株Yb2、NJ3,血清10型菌株Hxb2、YxL1由本实验室分离、鉴定并保存。鸭疫里默氏杆菌由TSB(胰蛋白胨大豆肉汤)或TSA(胰蛋白胨大豆肉汤琼脂)在37 ℃,5% CO2的条件下培养。宿主菌E. coliDH5α感受态细胞购自天根生化科技(北京)有限公司。详见表1。
1.2 培养基和缓冲液配制TSB液体培养基:称取30 g胰蛋白胨大豆肉汤粉于1 L超纯水中,121 ℃高压灭菌15 min;TSA固体培养基:称取30 g胰蛋白胨大豆肉汤粉于1 L超纯水中,然后加入12 g琼脂粉,121 ℃高压灭菌15 min。LB液体培养基:称取10 g胰蛋白胨,5 g酵母提取物和10 g氯化钠于1 L超纯水中121 ℃高压灭菌15 min;LB固体培养基:称取10 g胰蛋白胨,5 g酵母提取物和10 g氯化钠于1 L超纯水中,然后加入12 g琼脂粉,121 ℃高压灭菌15 min。去离子水:1 mL/管分装后,121 ℃高压灭菌20 min,-20 ℃保存备用;50×TAE缓冲液:冰乙酸57.1 mL,Tris-base 242 g,100 mL 0.5 mol/L EDTA(pH8.0)定容至1 L;1%琼脂糖凝胶:1g琼脂糖溶解于100 mL 1×TAE缓冲液中,微波炉加热煮沸,温度降至60 ℃时加入2 μL Goldview,混匀备用。
1.3 主要试剂和仪器设备胰酶大豆琼脂和胰酶大豆肉汤为BD公司产品;2×TaqPCR Master Mix、定量Marker DS-2000均购自北京康维科技有限公司;高保真酶购自TaKaRa公司;自动高压灭菌锅:日本TOMY公司;恒温箱:德国 Binder公司;超净台:上海博讯公司;CO2培养箱:美国SIM公司;恒温培养摇床:北京创新思成公司;PCR仪:美国ABI公司;DNA电泳仪、凝胶成像系统:上海天能科技有限公司;超低温冰箱:美国Nuair公司。
1.4 基因选择、引物设计与合成根据GenBank中鸭疫里默氏杆菌标准株DSM 15868株的全基因组序列(序列号CP002346.1),选取10个保守基因进行PCR扩增以及序列测定。引物用软件Primer 5.0设计,由上海英骏生物技术有限公司合成并纯化,详见表2。
1.5 PCR扩增体系PCR 扩增体系和反应条件:2×TaqPCR Master Mix 10 μL,上游引物和下游引物各1 μL,模板2 μL,用无菌去离子水补至终体积20 μL。扩增条件:94 ℃预变性4 min;94 ℃变性40 s,52 ℃退火40 s,72 ℃ 延伸1.2 min,35个循环;72 ℃ 延伸10 min;同时设不加模板的阴性对照。取10 μL PCR产物进行1%琼脂糖凝胶电泳,检测PCR扩增产物。
1.6 PCR产物纯化和克隆用Thermo胶回收试剂盒对所扩增的PCR产物进行回收,回收产物与pMD18-T simple载体连接后转化至E. coliDH5α中,这一过程参照分子克隆实验指南进行[28]。经SalI与BamH I酶切鉴定筛选可疑阳性克隆,并用PCR进一步鉴定。取各基因产物经酶切和PCR鉴定均为阳性的2~3个重组菌液送至上海华津生物科技有限公司测序。
1.7 序列分析和系统进化树的建立序列测定完成后,用DNAStar软件进行同源性的比较分析并建立系统发育树。
2 结果
A、LuxE和TCTR编码基因,表明这些基因在不同血清型RA菌株中的保守性良好;TR基因仅从6株具有致病性的RA菌株中扩增得到,而2株非致病性[11]RA菌株NJ1和NJ4未能扩增到,表明TR基因可能与RA菌株的致病性相关;IS1仅从6株血清1型和2型的RA菌株扩增得到,2株血清10型菌株均未扩增得到。提示IS1基因可能与RA菌株的血清型相关。结果见表3。
2.1 PCR扩增测定的8株RA菌株均能检测到Lipid
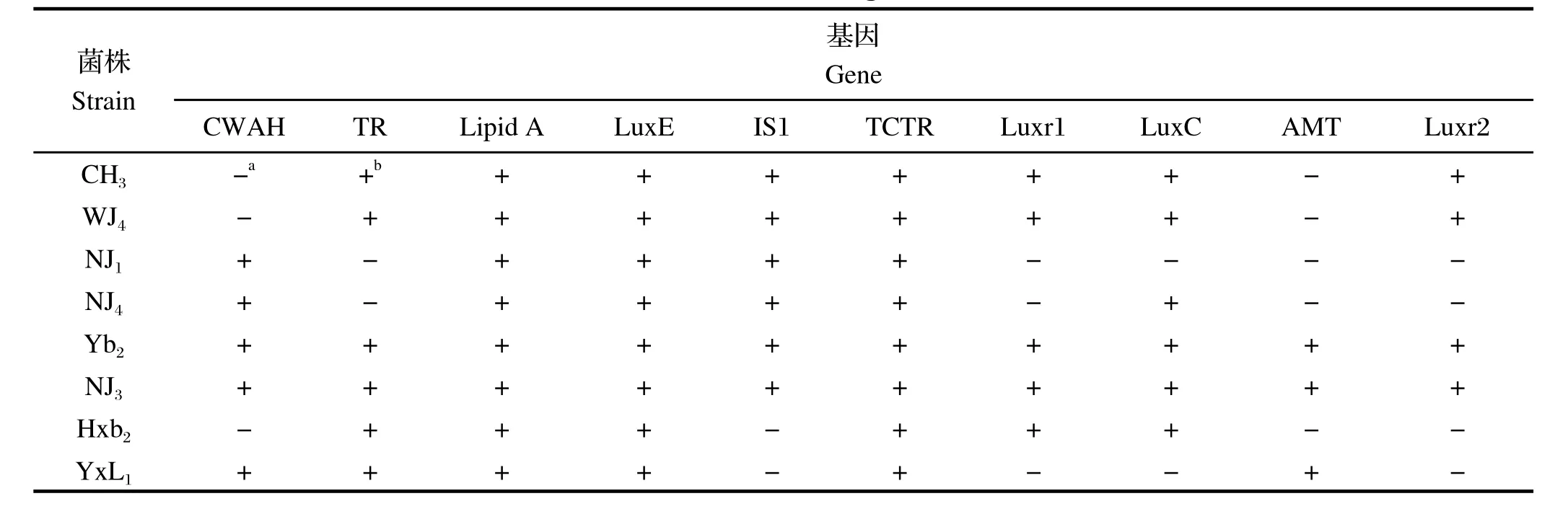
表3 10个基因在RA 不同菌株中的PCR扩增结果Table 3 The distribution of ten genes in RA strains
2.2 PCR产物的克隆和鉴定用Thermo PCR产物纯化回收试剂盒分别将8株细菌10个基因的PCR产物进行回收。用SalI和BamH I双酶切后与pMD18-T simple载体连接,转化进入DH5α,分别取3~5个白色单菌落进行PCR鉴定[28]。结果所有样品均为PCR扩增阳性结果,表明基因扩增产物已成功克隆至载体中。
2.3 序列测定与分析分别取各基因扩增产物的3个阳性重组菌液送至上海华津生物科技有限公司测序,采用DNAStar软件中的MegAlign程序进行序列比对(By clustal W Method),结果表明,阳性扩增基因序列与鸭疫里默氏杆菌标准菌株DSM15868相对应序列的同源性均达到90%以上;RADSM15868菌株基因序列与血清2型菌株Yb2和NJ3的基因序列相似性最高,除LuxC基因外,其余9个基因的同源性均达到97%以上;8个RA菌株均扩增获得Lipid A、LuxE和TCTR基因产物,表明该3个基因在RA菌株中的保守性良好。结果见表4。
2.4 系统进化树的绘制使用DNAStar软件中的MegAlign程序进行序列比对(By clustal W Method),绘制得到系统进化树。结果表明:两株非致病性菌株NJ1和NJ4在CEAH、Lipid A、LuxE、IS1和TCTR基因进化树中均位于同一分支,表明这些基因与细菌的致病性可能相关;血清1型菌株CH3和WJ4,血清2型菌株NJ3和Yb2在 TR、LuxE、IS1、TCTR、Luxr1、AMT基因进化树中均位于各自的分支,表明这些基因与细菌的血清型可能相关;DSM15868在大多数基因进化树中与血清2型菌株位于同一分支,提示该菌株为血清2型菌株。如图1。
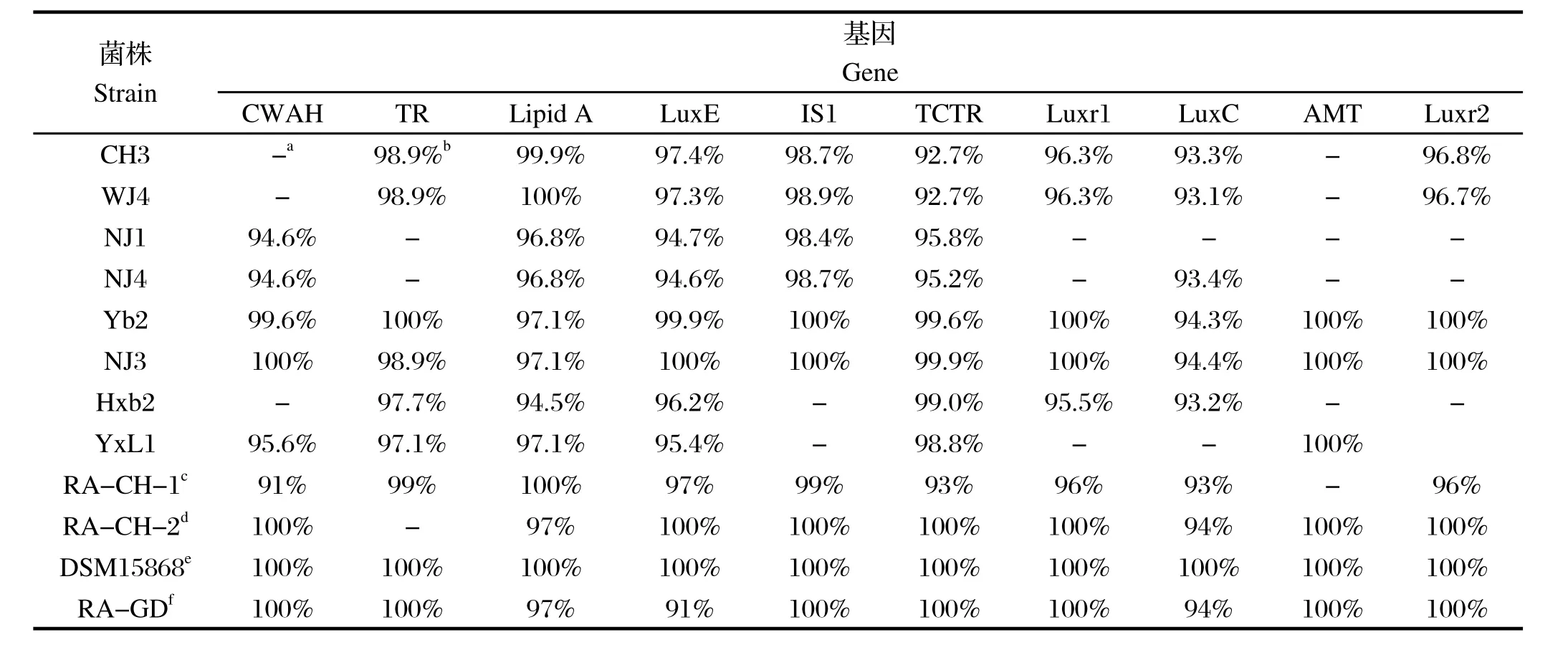
表4 10个基因在RA不同菌株中的序列同源性分析Table 4 The homology analysis of the ten genes in RA strains
3 讨论
鸭疫里默氏杆菌于1932年由Hendrickson和Hilbert首次分离获得[29],在1997年被归类于黄杆菌科第五核糖体RNA总科[30]。2011年8月,GenBank上登录了RA的第一个全基因组序列ATCC11845(No. CP003388.1)[31],此后又有4株鸭疫里默氏杆菌的全基因组序列登录至GenBank,然而对于许多基因的功能并没有明确的注释。本文对8株不同血清型鸭疫里默氏杆菌的10个相对保守基因进行PCR扩增,研究各基因在不同菌株中的分布情况,发现Lipid A、LuxE和TCTR这3个基因在不同血清型的RA菌株中具有高度的保守性。表明这3个基因可能与鸭疫里默氏杆菌的特定生物学特性相关。
鸭疫里默氏杆菌的血清型众多,各个血清型之间缺乏有效的交叉保护[2],且血清型与毒力之间并没有相关性。因此对于鸭疫里默氏杆菌病的流行目前尚缺乏有效的防治措施。本文通过对10个相对保守基因在8株不同血清型鸭疫里默氏杆菌中的序列进行测定并进行进化树绘制。结果表明TR、LuxE、IS1、TCTR、Luxr1、AMT基因序列与细菌的血清型具有一定的相关性。因此我们可以基于这些基因序列建立特异性地鉴定鸭疫里默氏杆菌血清型的PCR方法,从而对临床病例进行快速的血清型鉴定,对制定合理、有效的鸭疫里默氏杆菌病的防治方法奠定了基础。
近几年,有关RA分子致病机制的研究主要是对毒力基因进行鉴定,然而目前已报道的RA毒力因子仅有ompA基因。而本文的研究表明CWAH、Lipid A、LuxE、IS1和TCTR基因与细菌的致病性可能相关。这一发现对鸭疫里默氏杆菌的分子致病机制研究提供了方向。事实上我们正在构建相关基因的缺失株对其致病性进行验证。综上所述,本研究发现了鸭疫里默氏杆菌3个具有高度保守性的基因、6个可能与血清型相关的基因,以及5个可能为毒力相关的基因,该结果为进一步鸭疫里默氏杆菌病的防控和鸭疫里默氏杆菌的致病机制研究奠定基础。
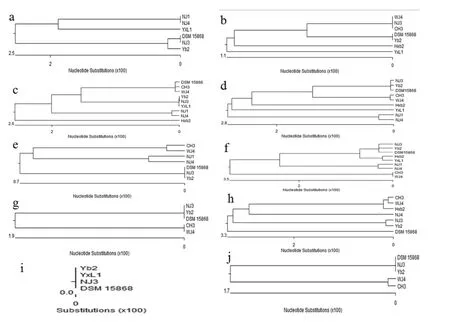
图1 10个基因的系统发育树Fig.1 phylogenetic trees of 10 genes investigated
[1] Seger P, Mannheim W, vancanneyt M,et al.Riemerella anatipestifergen. nov., comb. nov., the causative agent of septicemi a anserum exsudative, and its phylogenetic af filiation with in the Flavobacteriuum-Cytophaga rRNA homology group[J]. Int J Syst Bacterial, 1993, 43(3): 768-776.
[2] Sandhu T S. Immunization of White Pekin ducklings against Pasteurlla anatipestifer infection[J]. Avian Dis, 1979, 23: 662-669.
[3] Harry E G. Pasteurella anatipestitfer serotyps isolated from cass of anatipestifer septicemia in duck[J]. Vet Rec, 1969, 84: 673.
[4] Sandhu T S, Harry E G. Serotype of Pasteurella anatipestifer isolated from commercial White Peking ducks in the United Stats[J]. Avian Dis, 1981, 25(2): 497-502.
[5] Brogden K A, Rhoades K L, Rimler R B. Serologic types and physologic characteristic of 46 avian Pasteurella anatipestifer cultures[J]. Avian Dis, 1982, 26(4): 891-896.
[6] Bisgaard M. Anatigenic studies on Pasteurella anatipestifer, species incertaes edis, using slide and tubeagglutination[J]. Avian Pathol, 1982, 11(3): 341-350.
[7] Sandhu T S, Leister M L. Serotypes of Pasteurella anatipestifer isolates from poultry in differen countris[J]. Avian Pathol, 1991, 20(2): 233-239.
[8] Loh H, Teo P P, Hui-cheng T. Serotypes of Pasteurella anatipestifer isolats from ducks in Singapore: a proposal of new serotype[J]. Avian Pathol, 1992, 21(3): 453-459.
[9] Pathanasophon P, Sawada T, Tanticharoenyos T. New serotype ofRiemerella anatipestiferisolated from ducks in Thailand[J]. Avian Pathol, 1995, 24(1): 195-199.
[10] 王小兰, 胡青海, 童永亮, 等. 血清1型鸭疫里默氏杆菌灭活油乳剂疫苗的研制[J]. 中国预防兽医学报,2012, (4):313-316.
[11] 王小兰, 胡青海, 韩先干, 等. 血清2型鸭疫里默氏杆菌制苗用菌株的筛选及灭活油乳剂疫苗的研制[J]. 中国动物传染病学报, 2012, 20(1): 54-58.
[12] 王小兰, 刘蕾, 刘海文等. 血清10型鸭疫里默氏杆菌灭活油乳剂疫苗的研制[J]. 中国家禽, 2012, (15): 29-32.
[13] 郭玉璞, 曹澍泽. 北京鸭小鸭传染性浆膜炎的调查研究[J].畜牧兽医学报, 1982, 13(2): 107-114.
[14] 高福,刘红卫,郭玉璞. 上海地区小鸭传染性浆膜炎的流行病学调查[C]//第18届世界家禽会议分科讨论会—国际水禽生产学术会议, 1988: 266-267.
[15] 程安春, 汪铭书, 汪开毓, 等. 现代禽病诊断和防治全书[M]. 成都: 四川大学出版社, 1997.
[16] 王明俊. 兽医生物制品学[M]. 北京: 中国农业出版社, 1997.
[17] Timms L M, Marshall R N. Laboratory assesment of protection given by experiment Pasteurella anatipestifer vaccine[J]. Brit Vet J, 1989, 145(5): 483-493.
[18] Layton H W, Sandhu T S. Protection of ducklings with a Broth-Grown Pasteurella anatipetifer bacterin[J]. Avian Dis, 1984, 28(3): 718-726.
[19] Sandhu T S. Immunogenicity and safety of a live Pasteurella anatipestifer vaccine in White Pek in ducklings: laboratory and field trials[J]. Avian Pathol, 1991, 20(3): 423-432.
[20] Pathanasophon P, Sawada T, Pramoolsinsap T,et al. Immunogenicity ofRiemerella anatipestiferbroth culture bacterin and cell-f ree cult ure filtrate in duck[J]. Avian Pathol, 1996, 25(4): 705-719.
[21] 胡青海, 李刚, 郑明球, 等. 鸭疫巴氏杆菌的分离与鉴定[J]. 中国兽医科技, 1997, 27(6): 22-24.
[22] 张大丙, 郭玉璞. 不同血清型鸭疫巴氏杆菌分离株的部分特性比较[J]. 中国兽医杂志, 1999, 25(10): 13-15.
[23] 张大丙, 郭玉璞. 我国鸭疫里默氏杆菌血清型鉴定[J].畜牧兽医学报, 1999, 34(6): 536-542.
[24] 张大丙, 郭玉璞. 鸭疫里默氏杆菌血清学调查[J]. 中国兽医杂志, 1998, 24(6): 44-46.
[25] 郭玉璞. 我国对鸭传染性浆膜炎研究概况[J]. 中国兽医杂志, 1997, 23(12): 37-38.
[26] 高福, 郭玉璞. 小鸭传染性浆膜炎疫苗的研究Ⅰ. 鸭疫巴氏杆菌的血清型鉴定[J]. 中国兽医杂志, 1987, 13(4): 47-48.
[27] 张大丙, 郭玉璞. 北京地区鸭病毒性肝炎和传染性浆膜炎的流行情况与防制现状[J]. 中国兽医杂志, 1993, 19(12): 11-13.
[28] Sambrook J. 分子克隆实验指南[M]. 2版. 北京: 科学出版社, 1996.
[29] Hendrickson J M, Hilbert K F. A new and serious septicemic disease of young ducks with a description of the causative organism, Pfeifferella anatipestifer[J]. Cornell Vet, 1932, 22: 239-252.
[30] Subramaniam S, Chua K, Tan H,et al. Phylogenetic position ofRiemerella anatipestiferbased on 16S rRNA gene sequences [J]. Int J Syst Evol Microbiol, 1997, 47(2): 562.
[31] Konstantinos M, Meqan L, Monica M,et al. Complete genome sequence ofRiemerella anatipestifertype strain (ATCC 11845) [J]. Stand Genomic Sci, 2011, 4(2): 144-153.
DISTRIBUTION AND SEQUENCE ANALYSIS OF TEN GENES IN RIEMERELLA ANATIPESTIFER STRAINS
YUE Jia-ping, WANG Shao-hui, HAN Xian-gan, BAI Hao, WANG Xiao-lan, HOU Wan-wan, YU Sheng-qing
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
Investigation into distribution and sequences of 10 genes inRiemerella anatipestiferstrains will be informative to speculate the conservation of these genes. Ten genes were amplif ed in PCR from eight strains of R. anatipestifer. The PCR products were then cloned into PMD18-T vector for sequence analysis. Among 10 genes, Lipid A, LuxE and TCTR were amplif ed from all eight strains tested, indicating that these genes were well conserved in R. anatipestifer strains belonging to different serotypes. The TR gene was detected only in six pathogenic strains of R. anatipestifer but not in two non-pathogenic R. anatipestifer strains NJ1 and NJ4, suggesting that TR gene might be related to bacterial pathogenecity. The IS1 gene was amplif ed from six strains of serotypes 1 and 2 but not from two strains of serotype 10, supporting that IS1 was absent from R. anatipestifer strains of serotype 10.
Riemerella anatipestifer; PCR; sequence analysis
S852.612
A
1674-6422(2014)01-0050-07
2013-12-19
国家自然科学基金面上项目(31272591,31072161)
岳嘉蘋,女,硕士研究生,预防兽医学专业
于圣青,E-mail:yus@shvri.ac.cn

