壳聚糖人工泪液治疗干眼病实验研究
王斌 朱婉萍
壳聚糖人工泪液治疗干眼病实验研究
王斌 朱婉萍
目的 探讨壳聚糖人工泪液(LCH)治疗干眼病的疗效、量效及时效。方法将42只家兔随机分为7组,每组6只(12眼),分别为阴性对照组:滴用0.9%氯化钠溶液28d;阳性对照组:滴用羧甲基纤维素钠滴眼液28d;LCH低浓度组:滴用0.15%LCH 28d;LCH中浓度短时效组:滴用0.3%LCH 14d;LCH中浓度中时效组:滴用0.3%LCH 21d;LCH中浓度长时效组:滴用0.3%LCH 28d;LCH高浓度组:滴用0.6%LCH 28d。用药结束后以荧光素及琥红染色并计分比较,同时光镜及投射电镜观察角结膜的损伤及恢复情况。结果与阴性对照组比较,其他各组用药后各时点荧光染色及琥红染色评分(除阳性对照组用药后14d)均发生明显变化,差异均有统计学意义(P<0.05或0.01);与用药前比较,阳性对照组及LCH低、中、高浓度组用药后各时点荧光染色及琥红染色评分(除阳性对照组用药后14d)均发生明显变化,差异均有统计学意义(P<0.05或0.01)。LCH终浓度短时效、中时效、长时效组用药后荧光素染色和琥红染色评分均明显低于用药前,差异均有统计学意义(均P<0.05),但3组间用药后的差异均无统计学意义(P>0.05)。结论LCH是一种安全、有效的人工泪液,不仅可以改善干眼症状且可以修复角膜上皮损。
壳聚糖 人工泪液 家兔 干眼 疗效
干眼病是一种眼科常见疾病,是一组因泪液分泌低下或其它不明原因引起的泪液异常而导致眼表上皮干变的疾病,主要包括干性角、结膜炎和Sjogren综合征两种类型。由于干眼病患者的红细胞免疫与淋巴细胞免疫功能低下呈一致关系[1],因此其病因可能与免疫反应有关,但确切病因及发病机制尚未完全明了。目前,干眼病最主要的治疗药物是人工泪液[2]。本研究通过制作家兔干眼病模型,观察相同人工泪液不同浓度组及相同浓度人工泪液不同时效组的治疗情况,探讨人工泪液的疗效、量效及时效。
1 材料和方法
1.1 实验动物及分组 健康家兔42只(由浙江省中医药研究院动物实验中心提供),雌雄各半,体重1 538~3 142(1781±0.272)g。随机分为7组,每组6只(12眼),分别为阴性对照组:滴用0.9%氯化钠溶液28d;阳性对照组:滴用羧甲基纤维素钠滴眼液(商品名:瑞新滴眼液)28d;壳聚糖人工泪液(LCH)低浓度组:滴用0.15% LCH 28d;LCH中浓度短时效组:滴用0.3%LCH 14d;LCH中浓度中时效组:滴用0.3%LCH 21d;LCH中浓度长时效组:滴用0.3%LCH 28d;LCH高浓度组:滴用0.6%LCH 28d。
1.2 试剂及器材 试剂:3%戊巴比妥,剂量30mg/kg,华东制药厂生产;50%三氯醋酸,如皋市金陵试剂厂生产;0.9%氯化钠溶液,杭州民生药业有限公司生产;1%虎红液,山西晋中开发区中资化工技术有限公司生产;1%荧光素钠,上海三爱思试剂有限公司生产;瑞新滴眼液,剂量0.5ml/支,美国眼力健公司生产;LCH由浙江南洋药业提供。器材:YZ-5CSⅡ型裂隙灯角膜显微镜(苏州医疗器械厂生产),日本Olympus C-35AD型数码相机,日本Olympus显微镜,日本JEM-200CX透射电镜,日本JSM-6301扫描电镜。
1.3 干眼病模型制作 麻醉:以3%戊巴比妥1ml/kg耳缘静脉注射,用药量1.468~2.976(1.835±0.517)ml。麻醉后参照贾光学等[3]介绍的方法并作修改,手术摘除家兔眼瞬膜和Harder腺、泪腺后,用大头针端蘸50%三氯醋酸涂抹角膜缘3mm以外的球结膜,待球结膜颜色变白时,即用0.9%氯化钠溶液缓慢冲洗,阴性对照组仅作右眼,左眼对照,其余各治疗组则双眼均作干眼模型。
1.4 检测方法 实验前后均在裂隙灯下检查角结膜荧光素和琥红染色,而后0.9%氯化钠溶液冲洗。从治疗后第2周开始每周检查1次,以数码相机拍摄输入电脑记录,直至角结膜上皮染色完全转阴,为了获得良好对照,必要时用滤玻片(Wratten 12月)遮住物镜提高清晰度。
1.4.1 荧光素染色评分 1%荧光素钠10μl滴入结膜囊内,翻兔眼皮数次后,裂隙灯钴蓝光下观察,全角膜荧光素着染情况,其计分标准为:0示无着染,1分示散在点染,2分示点片染色,3分示密集斑片染色,4分全角膜斑状染色。最后以各组眼计分均数统计,评分越高表明角结膜损伤越重。
1.4.2 琥红染色 1%琥红10μl滴入结膜囊内,翻兔眼皮数次,裂隙灯绿光观察球结膜、角膜评分标准是:0示无着染;1分示散在点染;2分示点片着染;3分示斑片密集染;4分示全角膜斑状染。最后取各组眼计分均数统计,评分越高表明角结膜损伤越重。
1.4.3 标本制作及光镜观察 取角膜及以6mmΦ巩膜咬切器取下穹隆部睑结膜标本PAS染色脱水后置于载玻片中自然干燥,采用二甲苯使其透明置于普通光镜下观察模型眼及对照眼角膜上皮细胞间的连接;胞核、胞质的颜色;核、浆比(N/C)上皮细胞角化;炎性细胞及杯状细胞的计数,然后进行分析。原则上按NELSON'S分级:0级:结膜上皮细胞形态正常,层状大小一致,胞质蓝绿色N/C为1∶2,杯状细胞密集分布。目镜及物镜10倍下观察5个视野分别计杯状细胞数,取其均值,平均每个低倍视野下见12个以上的杯状细胞。1级:结膜上皮细胞轻度扩大,胞浆蓝绿色,N/C为1∶3,无角化。杯状细胞开始减少,密度下降,平均1个低倍视野下见7.5个杯状细胞。2级:所有结膜上皮细胞均扩大,变扁平,胞浆蓝绿或粉红色,N/C为1∶4~1∶5,轻度角化,杯状细胞明显减少,平均1个低倍视野下见2.5~3个杯状细胞。3级:结膜上皮细胞胞质内出现颗粒状物,核固缩崩解,上皮细胞胞浆呈粉红色,N/C为1∶6~1∶8,出现不同程度的角化,杯状细胞完全丧失,视野下不见杯状细胞。
1.5 统计学处理 采用SPSS13.0统计软件,所得数据均以表示,组间比较采用方差分析。
2 结果
2.1 不同浓度组染色检查结果 见表1。
由表1可见,与阴性对照组比较,其他各组用药后各时点荧光染色及琥红染色评分(除阳性对照组用药后14d)均发生明显变化,差异均有统计学意义(P<0.05或0.01);与用药前比较,阳性对照组及LCH低、中、高浓度组用药后各时点荧光染色及琥红染色评分(除阳性对照组用药后14d)均发生明显变化,差异均有统计学意义(P<0.05或0.01)。
2.2 LCH中浓度不同时效组染色检查结果 见表2。
由表2可见,3组用药后荧光素染色和琥红染色评分均明显低于用药前,差异均有统计学意义(均P<0.05),3组间用药后差异均无统计学意义(均P>0.05)。
2.3 结膜上皮光镜检查情况 正常情况下结膜上皮形态正常,上皮间常见有杯状细胞(图1-2);阴性对照组:结膜上皮层数增多,角化,杯状细胞明显减少或者消失(图3);阳性对照组及LCH组:结膜上皮形态正常,上皮间常见有杯状细胞(图4)。结膜铺片:正常情况下可见中等数量的杯状细胞,呈兰色,密度中等(图5);阴性对照组:杯状细胞密度明显减少接近消失;阳性对照组及LCH组:可见呈兰色的密度中等的杯状细胞分布(图6)。
2.4 角膜扫描电镜检查情况 正常情况下角膜上皮细胞表面的微绒毛和微皱裂排列整齐,可见明亮、中等亮度及深暗三种细胞(图7);阴性对照组:表层上皮细胞不规则,卷曲样剥脱,分布出三种亮度的细胞,表层上皮细胞的微绒毛和微皱裂肿胀和融合,排列紊乱(图8);阳性对照组及LCH组:角膜上皮细胞排列规则,可见三种亮度的细胞(图9)。角膜透射电镜观察:空白对照组,上皮细胞表面微绒毛和微皱裂形态正常排列整齐,邻近细胞有桥粒连接,可见细胞核和线立体等(图10);模型组,微绒毛肿胀明显,呈气球样变,桥粒解体,线立体肿胀,嵴变短或消失,呈空泡状(图11);阳性对照组,各用药组,上皮表面微绒毛和微皱裂形态正常排列整齐,可见桥粒连接(图12)。

表1 不同浓度组染色检查结果
表2 LCH中浓度不同时效组染色检查结果

图1 结膜上皮形态正常,其间可见杯状细胞(HE染色,×100)
图2 杯状细胞数量中等,呈空泡状(HE染色,×400)

图3 结膜上皮层数增多,杯状细胞明显减少或消失(HE染色,×100)

图4 结膜上皮形态基本正常,其间可见杯状细胞(HE染色,×100)
图5 可见中等数量的呈兰色的杯状细胞(甲苯胺蓝染色,×200)

图6 兰色的杯状细胞数量基本正常(甲苯胺蓝染色,×200)
3 讨论
壳聚糖是一种新型天然生物材料,其生物学特性优良,具有良好的生物相容性、生物可降解性,无毒、无刺激性,无致炎性、无抗原性、无有害降解产物,且有止血和抑菌作用。目前,壳聚糖在生物医学领域已被广泛应用,在眼科已被用作药物转运的载体。它是一类由2氨基-2脱氧-葡萄糖通过β-1,4糖甙键连接的带正电荷的直链多糖,是甲壳素(自然界中产量仅次于纤维素的天然多糖)的脱乙酰衍生物。其广泛存在于节肢动物类的翅膀和外壳中,也存在于真菌和藻类的细胞壁中,另外还可来源于有机酸类、抗生素类和酶的酿造产物[4]。壳聚糖具有生物可降解性,在生物体内可被生物酶如溶菌酶催化缓慢水解解聚,降解产物为对人体无毒的N-乙酰氨基葡萄糖和氨基葡萄糖[5]。而且降解过程中产生的低分子量甲壳胺或其寡聚糖在体内不积累,无免疫原性。

图7 三种不同亮度的细胞:明、暗及中等亮(SEM,×1 000)
图8 表面上皮不规则,卷曲样剥脱,分不出三种亮度的细胞(SEM,×1 000)
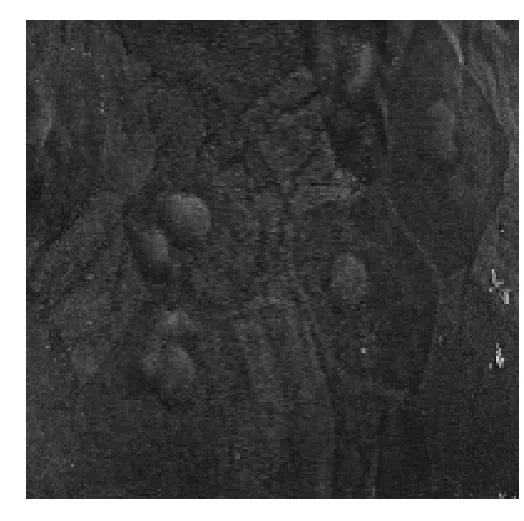
图9 三种不同亮度的细胞:明、暗及中等亮,基本可见(SEM,×1 000)

图10 上皮细胞内各种正常的细胞器可见,相邻细胞间有桥粒连接(TEM,×10 000)
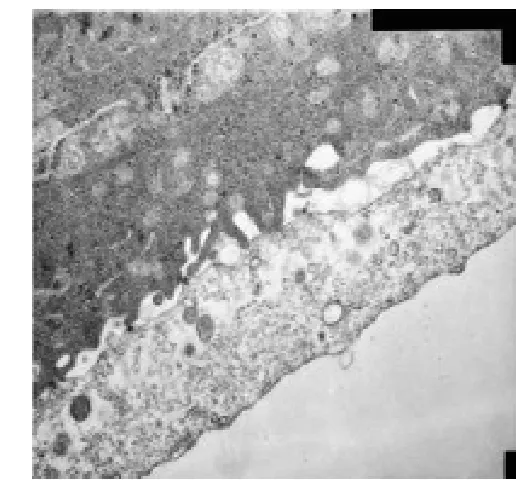
图11 微绒毛肿胀明显,呈气球样变,桥粒解体(TEM,× 15 000)
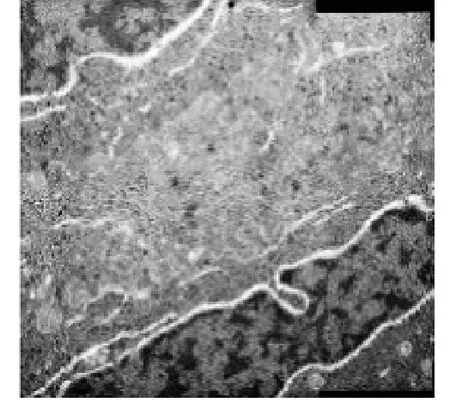
图12 相邻细胞间的桥粒结构可见,小线粒体出现(TEM,× 15 000)
目前,多项研究证明了壳聚糖在眼部的生物相容性很好,对眼组织无毒性,用于眼部是安全的。Felt等[6]将壳聚糖溶液滴于角膜表面,角膜荧光素染色后采用激光扫描仪观察,角膜对壳聚糖的耐受性良好。Genta等[7]在滴眼液中加入壳聚糖,用于兔眼,未见任何刺激症状及不适。Di Colo等[8]对含壳聚糖的植入物在眼部的作用进行研究,未发现结膜充血、角膜水肿等眼部刺激症状,对角膜内皮细胞活性、晶状体上皮、视网膜组织学形态均无明显影响,对参与晶状体及视网膜代谢的酶如乳酸脱氢酶、琥珀酸脱氢酶、酸性磷酸酶、碱性磷酸酶活性均无明显影响,说明壳聚糖不会造成眼部组织缺氧、损伤,对眼部无毒性。而且,壳聚糖具有亲水性、黏弹性、黏滞性等独特物理特性,化学性质稳定,与角膜和房水具有相同的渗透压,并有良好的光学性能,不妨碍视力。因此,医用壳聚糖在眼科的应用前景广阔。
壳聚糖是自然界唯一的一种表面带有多价阳离子的天然高分子材料,其生物学特性优良,具有抗微生物活性、止血、调节机体免疫功能及抗肿瘤、调节胆固醇代谢、降血压及降血糖、促进伤口愈合、抑制瘢痕形成等作用[9],已广泛用于制造人工皮肤、可吸收缝线、止血材料、抗粘连剂、药物载体等[10]。其所特有的理化性质已成为医药界及生物医学领域的研究热点[11]。作为阳离子性的生物高聚物,壳聚糖分子中含有许多极性基团,具有良好的吸水性和成膜性,溶于水中形成具有黏滞性的大分子胶体溶液,而且本身又具有消炎、抑菌、止血及良好的生物相容性。因此,壳聚糖可被用作人工泪液。Felt等[12]发现,采用壳聚糖作为人工泪液,与常用的人工泪液作用时间相同,但黏滞性为后者的1/5;同时发现低分子量的壳聚糖对大肠杆菌的最小抑菌浓度为0.375mg/ml,对葡萄球菌的最小抑菌浓度0.15mg/ml。可见以壳聚糖作为泪液替代品,不仅可改善干眼症患者的症状,而且具有良好的抑菌功能。用壳聚糖、聚乙烯山梨醇、油酸脂加防腐剂氯代丁醇配制的等渗溶液作为人工泪液,用于无泪液患者和干燥性角膜结膜炎,效果明显优于甲基纤维素制成的人工泪液。另外,壳聚糖具有良好的生物相容性、可降解性、生物活性,可以加工成用于细胞移植和组织再生的多孔结构支架,提供细胞生长所需的三维生长支架,创造类似细胞基质的环境,维持细胞表型及功能[13]。还可以促进组织修复及伤口愈合、抑制瘢痕形成,因此壳聚糖除了可用于眼外伤外,还可用于眼部整形。由于壳聚糖是天然产物,其结构和部分理化性质仍不完全清楚。
研究表明,分子量和脱乙酰化程度对壳聚糖的性质影响较大,而现有的生产技术尚无法获得均一脱乙酰化程度和分子量的产物,使其大规模生产受到限制。而壳聚糖的降解属酶解过程以及体内降解机制尚未完全清楚,使其降解时间也难以精确控制。本研究结果表明,壳聚糖人工泪液是一种安全、有效的人工泪液,不仅可以改善干眼症状且可以修复角膜上皮损,而且效果优于甲基纤维素制成的人工泪液。目前的大多数研究还处于体外和动物体内实验阶段,要想成为临床常用剂型,还需要大量的临床试验和深入研究。相信随着对壳聚糖药学、药理、毒理和临床应用研究的深入,壳聚糖在生物医学方面的应用会更广泛,在眼科的应用也会得到进一步开发。
[1] 杨朝忠,刘增玉.干眼病患者红细胞和淋巴细胞免疫功能对比研究[J].中国实用眼科杂志,1997,15(5):283-285.
[2]刘祖国,陈家祺.眼表泪液病的研究[J].中华眼科杂志,2000,36(1): 74-76.
[3] 贾光学,王玉新,韩东平,等.兔颌下腺游离移植再造泪腺的实验研究[J].中国医科大学学报,1994,23(6):446-448.
[4]Singla A K,Chawla M.Chitosan:some phamaceutical and biological aspects-update[J].J Pham Phamacol,2001,53(8):1047-1067.
[5]Tomihata K,Ikada Y.In vitro and in vivo degradation of films chitin and its deacetylated derivatives[J].Biomaterials,1997,18(7):567-575.
[6]Felt O,Furrer P,Mayer J M,et al.Topical use of chitosan in ophthalmology:tolerance assessment and evaluation of precomeal retention[J].Int J Phamn,1999,180(2):185-193.
[7]Genta I,Perugini P,Pavanetto F,et al.Microparticulate drug delivery systems[J].EXS,1999,87:305-313.
[8]Di Colo G,Zambito Y,Burgalassi S,et al.Effect of chitosan on in vitro release and ocular delivery of ofloxacin from erodible inserts based on poly(ethlene oxide)[J].Int J Pharm,2002,248(1-2):115-122.
[9]Jumaa M,Furkert F H,Muller B W.A new lipid emulsion formulation with high ntimicrobial efficacy using chitosan[J].Eur J Pharm Biopharm,2002,53(1):115-123.
[10]Ueno H,Mori T,Fujinaga T.Topical formulations and wound healing applications of chitosan[J].Adv Drug Deliv Rev,2001,52 (2):105-115.
[11]Tharanathan R N,Kittur F S.Chitin-the undisputed biomolecule of great potential[J].Crit Rev Food Sci Nutr,2003,43(1):6l-87.
[12]Felt O,Carrel A,Baehni P,et al.Chitosan as tear substitute:a wetting agent endowed with antimicrobial efficacy[J].J Ocul Pharmacol Ther,2000,16(3):261-270.
[13]Nettles D L,Elder S H,Gilbert J A.Potential use of chitosan as a cell scaffold material for cartilage engineering[J].Tissue Eng, 2002,8(6):1009-1016.
Experimental treatment of rabbit dry eye with chitosan artificial tears
Objective To assess the efficacy of chitosan artificial tears (LCH)in treatment of dry eye in rabbits.MethodsForty two rabbits were randomly divided into 7 groups with 6 (12 eyes)in each.In negative control group 0.9%saline drops were given for 28 d,in positive control group carboxymethyl cellulose sodium eye drops for 28 d;in low dose chitosan artificial tears (LCH)group 0.15%LCH for 28 d;in short-term LCH group 0.3%LCH for 14 d;in medium-term medium-dose LCH group 0.3% LCH for 21 d,in long-term medium-dose LCH group 0.3%LCH drop for 28 d,in high-dose long-term LCH group:0.6%LCH drop for 28 d.After the medication the eyes were stained with fluorescein and Hu red staining and scored;the optical and electron microscope were applied to observe the projection angle of conjunctival injury and recovery.ResultsCompared with negative control group,the fluorescence staining and Hu red staining scores (except the positive control group after 14d)were changed significantly after treatment(P<0.05 or 0.01).Compared with before medication,the fluorescence staining and Hu red staining scores(except the positive control group after 14 d)in positive control group and LCH low,medium and high concentration groups were changed significantly(P<0.05 or 0.01).The fluorescein staining and Hu red staining scores in short-,mediumand long-term group after treatment were significantly lower than before treatment(all P<0.05),and there was no significant difference among three groups (P>0.05).ConclusionChitosan artificial tears is safe and effective in improvement of symptoms and repair of corneal epithelia for dry eye.
Chitosan Artificial tear mytear Rabbit Dry eye Curative effect


2013-10-23)
(本文编辑:欧阳卿)
310012 杭州,浙江省立同德医院眼科(王斌),中医临床研究所(朱婉萍)

