参附注射液对严重脓毒症患者临床疗效及免疫功能的影响
徐俊龙 张宁 朱红俊 张剑 邱泽亮 何许伟 楼天正
参附注射液对严重脓毒症患者临床疗效及免疫功能的影响
徐俊龙 张宁 朱红俊 张剑 邱泽亮 何许伟 楼天正
目的 观察参附注射液对严重脓毒症患者的临床疗效及对T淋巴细胞亚群(CD3+、CD4+、CD8+)、NK细胞、单核细胞人白细胞DR抗原(HLA-DR)表达率的影响。 方法 将68例严重脓毒症患者随机分为西医常规治疗基础上加用参附注射液治疗组(参附组,36例)和单纯西医常规治疗组(对照组,32例)。观察治疗前及治疗后第3、7天患者临床疗效及T淋巴细胞亚群、NK细胞、单核细胞HLA-DR表达率的变化。结果 两组患者治疗前APACHE II、Marshall评分、IL-6和IL-10水平的差异均无统计学意义(均P>0.05);与健康对照组比较,严重脓毒症患者血清IL-6、IL-10和CRP水平明显升高,CD3+、CD4+、CD8+T淋巴细胞和单核细胞HLA-DR表达降低(均P<0.05)。与对照组同期比较,治疗后第7天参附组APACHEII、Marshall评分及IL-6和CRP水平均下降,而CD3+、CD4+、CD8+T淋巴细胞、NK细胞及单核细胞HLA-DR表达均升高,差异均有统计学意义(均P<0.05)。结论 严重脓毒症患者全身炎症反应和免疫抑制同时存在;参附注射液具有维持促炎/抗炎平衡,双向调节严重脓毒症免疫紊乱作用,从而改善临床疗效。
严重脓毒症 参附注射液 T淋巴细胞亚群 单核细胞人白细胞DR抗原
脓毒症的发病率高、病死率高,是重症监护病房最常见的死亡原因之一,病死率高达60%[1-2]。在脓毒症的发生、发展过程中机体处于一种免疫细胞过度激活和淋巴细胞受抑制的双相异常或紊乱状态[3]。脓毒症主要是特异性免疫功能抑制,与此同时,非特异性免疫系统却呈现高度活跃状态,因此对免疫抑制状态的调控已成为当前治疗的热点[4]。业已证明,参附注射液在白血病、肝癌及围手术期等患者中具有增强机体免疫功能的作用[5-8],但它对严重脓毒症患者免疫功能的影响及其临床疗效有待评估。为此,本研究通过动态观察参附注射液对严重脓毒症患者外周血T细胞亚群、NK细胞及单核细胞人白细胞DR抗原(HLA-DR)表达率的影响,探讨参附注射液对脓毒症后免疫功能紊乱的干预情况及其在脓毒症救治中的临床疗效。
1 资料和方法
1.1 一般资料 选择2009-06—2010-06入住我院ICU诊断为严重脓毒症的患者68例,其中男38例,女30例,年龄18~75(49.8±16.3)岁。纳入标准:均符合严重脓毒症诊断标准[9];年龄≥18岁;Marshll评分>5分。排除标准:前6个月内接受过化疗者;治疗未超过7d死亡或出院;3个月内接受皮质激素或其他免疫抑制剂、免疫调节剂治疗者;有免疫系统疾病者;HIV阳性者。采用前瞻性随机对照临床研究方案,应用随机数字表分成参附组和对照组,其中参附组36例,男20例,女16例,年龄18~74(49.3±15.5)岁,体重(68.3±16.5)kg,器官衰竭数目(2.6±0.5)个;对照组32例,男18例,女14例,年龄22~75(50.5±17.2)岁,体重(65.2±15.0)kg,器官衰竭数目(2.7±0.7)个。两组患者的性别、年龄、体重、疾病严重程度等比较差异均无统计学意义(均P>0.05)。健康对照组为同期在本院健康体检患者,共10例,男4例,女6例,年龄31~67(44.5±15.3)岁,体重(61.2±13.0)kg。经知情同意后采用健康体检用血标本检测。本研究符合临床伦理学标准,经医院伦理委员会批准,均取得患者或家属及健康体检者的知情同意。
1.2 方法
1.2.1 治疗方法 两组均参照2008年SSC制定的《脓毒症治疗指南》[10]进行常规治疗,包括积极处理原发病(针对性的手术,必要的禁食、胃肠减压等),早期抗感染(抗生素使用前留取病原学标本),液体复苏,镇痛、镇静治疗,控制血糖,营养支持及主要脏器功能的支持治疗(包括呼吸机辅助通气等)。参附组在西医常规治疗基础上加用参附注射液100ml(四川雅安三九药业有限公司生产,批号:国药准字Z20043117)加入5%葡萄糖250ml中静脉滴注,1次/d,持续7d。
1.2.2 检测方法 分别于治疗前及治疗后第3、7天进行急性生理和慢性健康状况评分(APACHE)Ⅱ和Marshall评分,采用流式细胞仪检测CD3+、CD4+、CD8+T淋巴细胞、NK细胞计数和单核细胞HLA-DR表达率,ELISA法检测血清IL-6、IL-10水平,免疫透视比浊法测定CRP水平,具体检测过程参照试剂盒说明书。
1.3 统计学处理 采用SPSS12.0统计软件。计量资料中正态分布资料以表示,组间样本均数比较采用单因素方差分析,两两比较采用SNK-q检验;计数资料比较采用χ2检验。
2 结果
2.1 参附组和对照组APACHEⅡ、Marshall评分比较 见表1。

表1 两组患者治疗前后APACHEⅡ、Marshall评分比较
由表1可见,治疗前两组APACHEⅡ评分、Marshall评分差异均无统计学意义(均P>0.05)。治疗后两组患者APACHEⅡ、Marshall评分值均呈下降趋势,两组患者治疗后第7天均较治疗前下降(均P<0.05),且参附组APACHEⅡ、Marshall评分较对照组下降明显(P<0.05)。
2.2 3组血清IL-6、IL-10、CRP水平的比较 见表2。
由表2可见,两组治疗前血清IL-6、IL-10和CRP水平均较健康对照组升高(均P<0.05)。两组治疗后血清IL-6水平和CRP均呈下降趋势,治疗后第7天,参附组与治疗前比较差异有统计学意义(P<0.05),而对照组与治疗前比较差异无统计学意义(P>0.05)。参附组治疗第7天后上述指标较对照组下降(均P<0.05)。参附组与对照组治疗前后IL-10水平差异均无统计学意义(均P>0.05)。

表2 3组患者血清IL-6、IL-10、CRP水平的比较
2.3 3组患者T淋巴细胞、NK细胞计数及HLA-DR表达的比较 见表3。
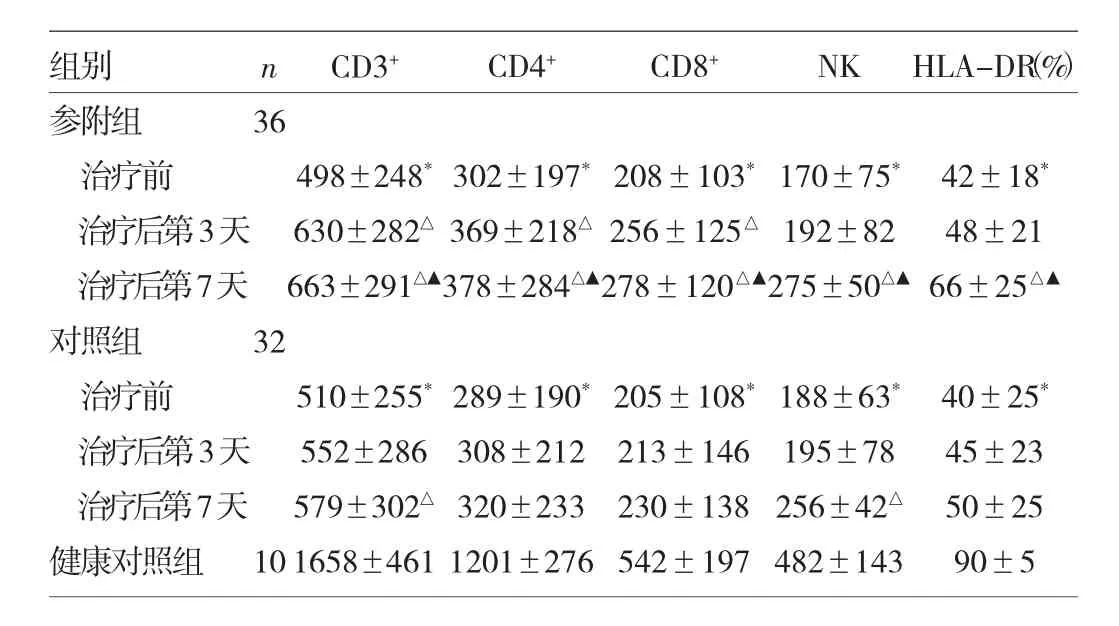
表3 3组患者T淋巴细胞、NK细胞计数及HLA-DR表达的比较
由表3可见,参附组和对照组治疗前CD3+、CD4+、CD8+T淋巴细胞、NK细胞及HLA-DR表达均降低(均P<0.05),参附组治疗后上述指标均呈上升趋势(均P<0.05),但对照组治疗后第7天仅CD3+T淋巴细胞计数升高(P<0.05);参附组CD3+、CD4+、CD8+T淋巴细胞计数于治疗后第3天即升高,NK细胞及HLA-DR表达于治疗后第7天升高,且高于对照组,差异均有统计学意义(均P<0.05)。
3 讨论
在脓毒症时出现的炎症反应可有大量促炎细胞因子产生,鉴于此人们自然想到采用抑制炎症反应来治疗严重感染,但并没有在临床获得预期效果。Bone[11]提出了代偿性抗炎反应综合征(CARS)假说,指出脓毒症时存在免疫抑制。Giamarellos等[12]通过检测严重感染时淋巴细胞功能证明,在严重感染一开始就存在免疫抑制,提示严重感染最初是免疫低反应。国内的一些研究也发现,严重感染时机体同时产生特异性免疫系统抑制和非特异性炎症反应亢进。这表明严重感染时既可能存在免疫亢进,也可能存在免疫抑制,两者可同时存在,其强弱也处于不断变化之中,机体处于一种复杂的免疫紊乱和失衡状态,相应的免疫治疗也不应只强调一个方面,而在于重建严重感染患者的免疫平衡稳态[13-14]。中医学认为,严重脓毒症的病机突出表现在“正衰邪盛”及“正衰邪衰”的状态[15]。参附注射液是根据中医古方“参附汤”而来,具有减毒增效,回阳救逆,益气固脱之功效;参附注射液的天然活性成分进入体内后可多靶点综合协调地作用于失去平衡的神经内分泌免疫网络系统,起整体性调节作用[16-17]。据此,我们选用参附注射液起到益气扶正的功效,达到补气通阳,使阳气畅达,恢复络脉出入自由、充盈满溢的正常状态,有利于抗邪外出,防止内生毒邪造成进一步损害。
本研究结果显示参附组和对照组患者治疗前APACHEⅡ评分、Marshall评分、IL-6和IL-10水平无明显差异;与健康对照组比较,严重脓毒症患者血清IL-6、IL-10和CRP水平明显升高,CD3+、CD4+、CD8+T淋巴细胞、NK细胞和单核细胞HLA-DR表达明显降低。这表明在严脓毒症患者中非特异性炎症反应亢进和免疫抑制同时存在。
经过治疗干预后与对照组同期比较,参附组CD3+、CD4+、CD8+T淋巴细胞计数于治疗后第3天就出现明显升高,治疗后第7天后参附组除CD3+、CD4+、CD8+T淋巴细胞仍较对照组升高外,NK细胞及HLA-DR亦明显升高;治疗第3天、7天时IL-6和CRP水平均较对照组下降,差异均有统计学意义。表明经过参附注射液干预治疗可抑制过度的非特异性炎症反应;单核细胞HLA-DR作为全身感染过程中免疫失调的指标,如下降提示机体出现免疫功能的严重抑制,通过本研究可观察到在严重脓毒症的早期即表现有HLA-DR的明显下降,经治疗后两组的HLA-DR值均出现升高,但参附组升高更加显著,表明参附注射液除减轻过度的炎症反应外,还可以调节机体的免疫功能。其机制可能与其成分人参皂甙的抗炎和较强的免疫调节药理作用相关。
在危重患者的病情严重程度评估中APACHEⅡ评分是目前使用最广泛的评分系统,Marshall评分是MODS评分系统的代表,这两个评分系统均可预测危重患者病情严重程度的评估及预后。因此本研究选用APACHEⅡ评分及Marshall评分联合作为评估患者的临床疗效,结果提示两组患者治疗后APACHEⅡ、Marshall评分值均呈下降趋势,参附组APACHEⅡ、Marshall评分较对照组下降更明显,提示参附注射液的治疗可使严重脓毒症患者的早期病情改善。
通过本研究表明在严重脓毒症时存在非特异性炎症反应亢进和免疫抑制,通过参附注射液干预治疗后,出现特异性炎症反应的下调和非特异性免疫的上调,表明在严重脓毒症时应用参附注射液具有维持促炎/抗炎平衡,双向调节严重脓毒症免疫紊乱作用;并能改善临床疗效。
[1] Martin G S,Mannino D M,Eaton S,et al.The Epidemiology of Sepsis in the United States from 1979 through 2000[J].N Engl J Med,2003,348:1546-1554.
[2] Brun-Buisson C,Meshaka P,Pinton P,et al.EPISEPSIS:a rerppraisalofth epidemiology and outcome ofsevere sepsis in Frenchintensive care units[J].Inte Care Med,2004,30(6):580-588.
[3]Sriskandan S,Altmann D M.The immunology of sepsis[J].J Pathol,2008,214(2):211-223.
[4] Russell J A.Management of Sepsis[J].N Engl J Med,2006,355: 1699-1713.
[5] 薛燕,白金叶,程桂芳.参附注射液对免疫功能的影响[J].中药药理与床,2001,17(1):8-9.
[6]魏影非,杜惠兰,王素云,等.参附注射液配合化疗治疗急性白血病疗效及对细胞免疫、血清IL-6和TNF-α水平的影响[J].中国中西医结合杂志,2003,23(4):258-260.
[7] 陈晓伟,付鉴,阮新民,等.参附注射液对体外循环手术患者围术期机体免疫功能的影响[J].中国中西医结合杂志,2006,26(9):775-779.
[8] 李敬东,戴毅,彭勇,等.参附注射液对肝癌切除术后的肝功能和免疫功能恢复的影响[J].医药导报,2009,28(10):1292-1294.
[9]Levy M M,Fink M P,Marshall J C,et al.2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J].Crit Care Med,2003,31(4):1250-1256.
[10]Dellinger R P,Levy MM,Carlet J M,et al.Surviving Sepsis Campaign:internationalguidelines for management of severe sepsis and septic shock:2008[J].Crit Care Med,2008,36(1):296-327.
[11] Bone R C.Immunologic dissonance:a continuing evolution in our understanding of the systemic inflammatory response syndrom (SIRS)and the multiple organ dysfunction syndrome(MODS)[J]. Ann Intern Med,1996,125(8):680-687.
[12] Ciamarellos-Bourooulis E J,Tsaganos T,Spyridaki E,et al. Early changes ofCD4-positive lymphocytes and NKcells in patients with severe Gram negtive sepsis[J].Crit Care,2006,10(6): 166-170.
[13] 王晗旭,胡文全.脓毒症病人淋巴细胞调控的研究进展[J].天津医科大学学报,2011,17(1):140-142.
[14]脓毒症免疫调理治疗临床研究协作组.乌司他丁、α1胸腺肽联合治疗严重脓毒症——一种新的免疫调理治疗方法的临床研究[J].中华医学杂志,2007,87(7):451-457.
[15]中华医学会急诊医学分会危重病专家委员会,中国中西医结合学会急救专业委员会.脓毒症的定义、诊断标准、中医证候诊断要点及说明(草案)[J].中华急诊医学杂志,2007,16(8):797-798.
[16] 余洋,康强,王秀英,等.注射用参附药效学实验研究[J].中华中医药学刊,2010,(11):2424-2426.
[17] 李钢,赵金锋,王凯诚,等.参附注射液对实验性脓毒症大鼠部分神经内分泌免疫因子的影响[J].中国中西医结合外科杂志,2011,17(2): 185-189.
Efficacy of Shengfu injection in treatment of severe sepsis and its effect on immune function of patients
XU Junlong,ZHANG Ning, ZHU Hongjun,et al.
Department of Intensive Care Unit,Lishui Municipal People's Hospital,Lishui 323000,China
Severe sepsis Shenfu injection T lymphocyte subsets Monocyte human leukocyte antigen-DR
2013-07-13)
(本文编辑:马雯娜)
浙江省中医药科技计划资助项目(2009CB084)
323000 丽水市人民医院ICU
徐俊龙,E-mail:xujunlong65@163.com
【 Abstract】 Objective To assess the efficacy of Shengfu injection(SFI)in treatment of severe sepsis and its effect on immune function of patients. Methods Sixty-eight patients with severe sepsis were randomly divided into two groups,36 patients were treated with Shengfu(SFI group)and conventional therapy and 32 patients received conventional therapy only(control group).The acute physiology and chronic health evaluation II(APACHE II)score and Marshall score were evaluated.The serum levels of interleukins(IL-6,IL-10),C-reactive protein,NK cell,CD3+,CD4+,CD8+T cell and monocyte human leukocyte antigen-DR(HLA-DR)before and 3,7 d after treatment were measured.Results There were no significant differences in APACHE II and Marshall scores,serum IL-6 and IL-10 levels between two groups before treatment(P>0.05).Before treatment serum IL-6,IL-10 and CRP in both groups were significantly higher,and the CD3+,CD4+,CD8+T cells,NK cells and HLA-DR level were all significantly lower than those of healthy controls(all P<0.05).Compared with the control group,the APACHE II and Marshall scores and serum IL-6,CRP levels in the SFI group were significantly decreased at d7 after treatment,while the CD3+, CD4+,CD8+T cells were significantly increased(P<0.05). Conclusion Shengfu injection can improve the therapeutic efficacy of severe sepsis,which may be associated with its effect on regulation of immune function in patients.

