帕立骨化醇对糖尿病肾病大鼠肾保护机制的研究
高燕红 罗群 蔡珂丹 邬民香
帕立骨化醇对糖尿病肾病大鼠肾保护机制的研究
高燕红 罗群 蔡珂丹 邬民香
目的 探讨帕立骨化醇对糖尿病肾病(DN)大鼠的肾保护作用及其可能机制。方法采用腹腔内注射链脲佐菌素(STZ)构建DN大鼠模型。将造模成功的大鼠随机分为帕立骨化醇组(P组)、DN组(D组),并设置健康对照组(N组)。P组大鼠每周腹腔注射帕立骨化醇3次,剂量为0.4μg/kg,给药12周后检测24h尿蛋白定量及血生化指标,以实时PCR检测肾组织肾素及环氧化酶-2(COX-2)mRNA表达,免疫组化检测肾组织COX-2蛋白的表达,并以ELISA法检测尿前列腺素E2(PGE2)水平。结果与N组相比,D组与P组24h尿蛋白定量、血肌酐(SCr)、空腹血糖及甲状旁腺激素(PTH)均显著升高(均P<0.05),肾组织肾素和COX-2 mRNA及蛋白表达,以及尿PGE2水平均显著升高(均P<0.05),且D组显著高于P组(P<0.05)。肾素水平与尿PGE2水平及COX-2 mRNA表达均呈正相关(r=0.798、0.722,均P<0.01)。结论帕立骨化醇可显著减少DN大鼠早期蛋白尿,其机制可能与通过抑制肾组织COX-2表达,下调尿PGE2水平,从而抑制肾组织肾素表达有关。
糖尿病肾病 帕立骨化醇 肾素 前列腺素E2环氧化酶-2
糖尿病肾病(diabetic nephropathy,DN)是糖尿病常见的严重并发症,是终末期肾病(end stage renal disease,ESRD)的主要原因。肾素-血管紧张素系统(renin-angiotensin system,RAS)在DN进展过程中发挥着关键的作用,阻断RAS已成为目前治疗DN的重要措施。近年来研究发现维生素D类似物帕立骨化醇能够起到抑制肾素分泌,减少尿蛋白及肾脏保护的作用,但其具体机制尚不清楚。本研究拟通过帕立骨化醇对DN大鼠蛋白尿、肾组织肾素、环氧化酶-2(cyclooxygenase-2,COX-2)及尿前列腺素E2(prostaglandin E2,PGE2)表达的影响,探讨其肾保护机制。
1 材料和方法
1.1 主要试剂 链脲佐菌素(STZ)购于美国Sigma公司,帕立骨化醇购于美国Abbott公司,尿总蛋白测定试剂盒为北京利德曼生化股份有限公司产品,PGE2ELISA试剂盒购于上海蓝基生物科技有限公司,兔抗大鼠COX-2多克隆抗体购于北京博奥森生物技术有限公司,免疫组化试剂盒为北京中杉金桥生物技术有限公司产品,Trizol、RT-PCR试剂盒和荧光定量PCR试剂盒购于大连宝生物工程有限公司,肾素、COX-2、β-actin引物合成于上海捷瑞生物工程有限公司。
1.2 动物模型的建立和分组 雄性清洁级SD大鼠30只由浙江省动物实验中心提供,约6~7周龄,体重(220.0±15.0)g,饲养于宁波大学实验动物中心。经随机数字表法分成3组,其中20只大鼠造模,余下10只作为健康对照组(N组)。大鼠禁食12h后,单次无菌腹腔注射STZ 65mg/kg。72h后尾静脉采血,测空腹血糖(FBG),FBG≥16.7mmol/L确定为糖尿病大鼠。3周后留24h尿,测24h尿蛋白≥30mg,则确定DN大鼠造模成功。20只大鼠造模均成功,后再经随机数字表法分成帕立骨化醇组(P组)10只和DN组(D组)10只。P组大鼠将帕立骨化醇溶于0.05ml丙二醇中,以0.4μg/kg剂量每周腹腔注射3次;D组和N组大鼠均予等量丙二醇腹腔注射,3组均注射12周。12周后用代谢笼留取24h尿液,并杀死大鼠心脏取血4~6ml,分离双侧肾脏并称重,部分肾组织以4%多聚甲醛固定,其余部分-80℃冻存。
1.3 观察指标及检测方法
1.3.1 一般指标 各组大鼠常规检测24h尿蛋白定量、SCr、FBG、血钙、血磷及甲状旁腺激素(PTH)。
1.3.2 尿液PGE2测定 代谢笼留取大鼠24h尿液,其中取5.0ml,3 000r/min离心5min,取上清液,-80℃冻存备用。以ELISA法测定尿液PGE2水平。
1.3.3 肾组织病理和免疫组化 肾组织以4%多聚甲醛固定,石蜡切片常规HE染色观察。免疫组化采用PV二步法。切片常规脱蜡、水化,3%过氧化氢阻断内源性过氧化物酶,微波抗原修复。依次滴加COX-2一抗、二抗,DAB显色,最后苏木素复染、脱水、透明和封片,采用PBS替代一抗作阴性对照。每张切片400倍视野下随机选取10个不重复肾小球扫描。使用Image pro plus 6.0对COX-2蛋白表达进行半定量分析,测定COX-2蛋白的平均吸光度值,并取其均值作为样品的相对阳性表达量。
1.3.4 实时PCR 肾组织总RNA提取按照Trizol说明书进行。紫外分光光度计测定RNA浓度后,总RNA反转录合成cDNA。肾素引物:上游:5′-AGAGGGTGCTAAAGGAGGAAGTGTT-3′,下游:5′-GTAGTGAAAGTTGCCCTGGTAATGT-3′,扩增片段119bp。COX-2引物:上游:5′-TCCTCCTGTGGCTGATGACTG-3′,下游:5′-CTGGGCAAAGAATGCGAACA-3′,扩增片段154bp。内参β-actin引物:上游:5′-TCAGGTCATCACTATCGGCAAT-3′,下游:5′-AAAGAAAGGGTGT AAAACGCA-3′,扩增片段432bp。采用Mx3005P QPCR仪进行PCR反应:预变性95℃1min;变性95℃15s,退火57℃30s,延伸72℃30s,共40个循环;然后延伸95℃15s,57℃30s,95℃15s。记录Ct值,结果处理按照2-ΔΔCT法:首先计算出每个标本的目的基因及内参β-actin的Ct值,ΔCT=Ct(目的基因)-Ct(β-actin),再按照ΔΔCT=ΔCT(P组/D组)-ΔCT(N组)进行组间比较。
1.4 统计学处理 采用SPSS 18.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,两组间比较采用LSD-t检验。两变量间相关性采用直线相关分析。
2 结果
2.1 各组大鼠生化指标比较 12周后,D组和P组24h尿蛋白定量、SCr、FBG、PTH和尿PGE2水平显著高于N组,均有统计学差异(均P<0.05);且D组24h尿蛋白定量、SCr、PTH和尿PGE2水平显著高于P组,均有统计学差异(均P<0.05)。但D组与P组间FBG无统计学差异(P>0.05);与P组比较,D组血钙明显下降,血磷明显上升(均P<0.05),P组血钙、血磷与N组无统计学差异(P>0.05),见表1。
2.2 12周后各组大鼠肾脏病理改变 HE染色结果显示12周后N组大鼠无明显病理学改变;D组大鼠肾小球肿胀,肾小球毛细血管基底膜增厚,弥漫性肾小球系膜区增宽、基质增多;P组大鼠病理改变较D组有所减轻(图1,见插页)。
2.3 各组大鼠肾组织肾素、COX-2 mRNA及COX-2蛋白表达 12周后,肾素mRNA的表达在D组(1.48±0.14)和P组(1.23±0.10)均高于N组(1.03±0.12),且D组显著高于P组,均有统计学差异(均P<0.05);COX-2 mRNA的表达在D组(1.51±0.27)和P组(1.21±0.12)也高于N组(0.91±0.21),且D组显著高于P组,均有统计学差异(均P<0.05),见图2。D组(0.69±0.31)和P组(0.44±0.67)的COX-2蛋白表达也高于N组(0.21±0.02),且D组显著高于P组,均有统计学差异(均P<0.05),图3,见插页。
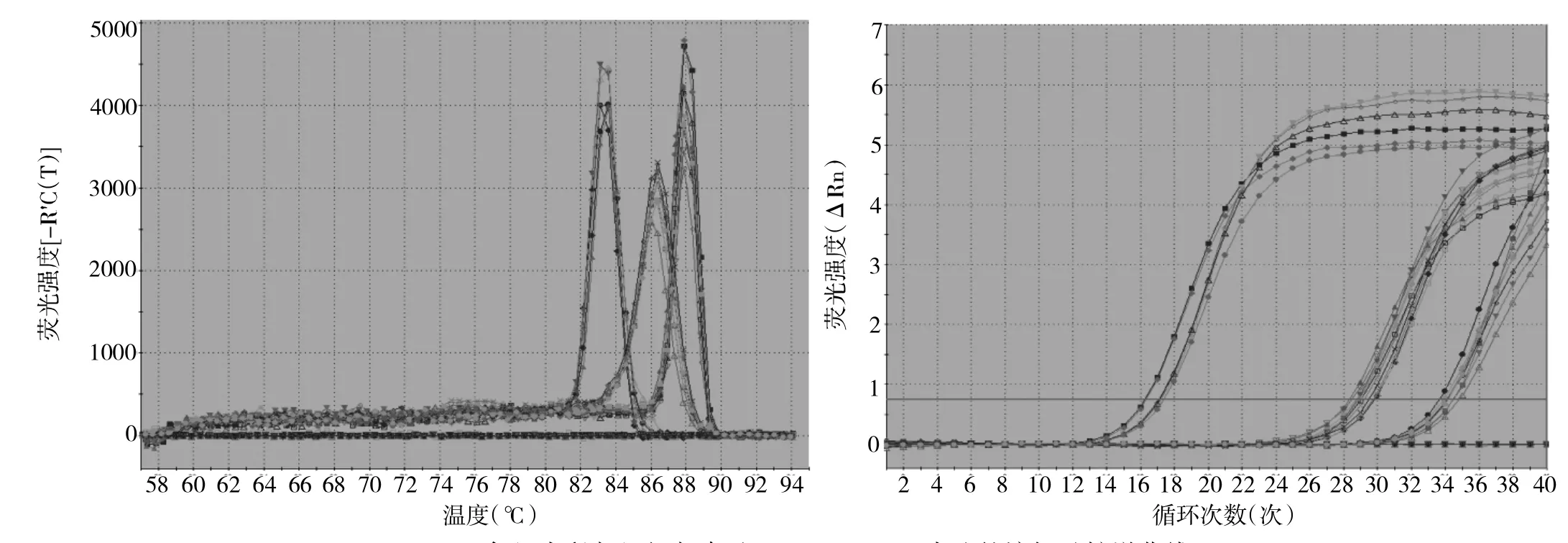
图2 各组大鼠肾组织肾素及COX-2 mRNA表达的熔解及扩增曲线
2.4 相关性分析 直线相关分析提示大鼠肾组织肾素水平与尿PGE2水平及COX-2 mRNA表达均呈正相关(r=0.798、0.722,均P<0.01)。
3 讨论
近年来研究发现,维生素D类似物帕立骨化醇的生物学活性与活性维生素D非常相似,在有效控制高血钙同时能够降低PTH水平,抑制甲状旁腺增生;并且可同时通过抑制RAS系统、细胞外基质沉积、系膜细胞增殖和炎性因子分泌等途径改善DN病理生理过程,从而保护肾脏[1-2]。近年的研究表明,其具有调控肾素分泌的作用[1,3]。兰凯等[4]发现维生素D类似物帕立骨化醇可以抑制DN大鼠肾脏的肾素及血管紧张素Ⅱ的表达,减少DN大鼠蛋白尿,保护肾脏。Deb等[5]通过联合运用氯沙坦及帕立骨化醇,证实帕立骨化醇能抑制代偿性的肾素增加,减少蛋白尿,降低肾小球硬化,延缓肾功能衰竭进展,但帕立骨化醇抑制肾素分泌的机制目前尚不清楚。
近期在RAS研究中出现了一个新兴领域,Vargas等[6]研究发现致密斑(macula densa,MD)细胞顶端膜上的G蛋白耦联受体(G-protein-coupled,GPR91)能够与三羧酸循环中的中间产物琥珀酸结合,激活p38和细胞外信号调节激酶(extracellular signal-regulated kinase, ERK1/2),随后激活COX-2及PGE2的合成和释放,引起球旁细胞(juxtaglomerular cell,JGC)肾素的释放和肾素依赖性的RAS激活。琥珀酸与GPR91结合刺激MD细胞的COX-2、PGE2分泌增加从而促进肾脏局部RAS激活是DN早期的重要表现[7]。因此,笔者推测帕立骨化醇可通过MD细胞的COX-2-PGE2途径抑制肾素合成,其可能是防治DN的重要突破口。
PGE2是MD细胞调控肾素分泌的关键递质。Schnermann等[8]研究发现氯化钠在低浓度时可调节PGE2的释放,从而调控肾素合成和释放。Poschke等[9]通过低盐饮食的方法,发现低盐能够刺激COX-2的表达,进而增加PGE2的合成,通过与PGE2受体4(E-prostanoid,EP4)结合,激活肾素的释放。近几年研究发现,PGE2主要通过作用于其受体EP2和EP4,激活JGC上的Gsα耦联受体,从而激活腺苷酸环化酶(adenylate cyclase,AC),使细胞内环磷酸腺苷(cyclic adenosine monophosphate,cAMP)浓度增加,激活依赖cAMP的蛋白激酶A,促使肾素分泌[10]。许多研究已证实COX-2-PGE2能够剂量依赖性的刺激肾素的合成和释放[11-12]。PGE2在体内代谢迅速,生物半衰期仅数分钟,其大部分由尿液排出,故通过检测尿液中的PGE2水平可有效反应肾组织中PGE2的水平。
本研究发现,帕立骨化醇可以降低DN大鼠肾组织肾素水平,减少蛋白尿,与上述报道相一致[4-5]。本研究还提示帕立骨化醇可抑制肾组织COX-2蛋白及mRNA的表达,下调尿PGE2水平。肾组织肾素水平与COX-2 mRNA表达及尿液PGE2水平呈正相关。故笔者推测帕立骨化醇可能通过抑制COX-2-PGE2的表达,从而抑制肾素分泌,减少蛋白尿,起到保护肾脏的作用。帕立骨化醇如何调控COX-2-PGE2释放以及帕立骨化醇是否还通过其他通路来调控肾素分泌,尚有待进一步的研究。
[1]Cunningham J,Zehnder D.New vitamin D analogs and changing therapeutic paradigms[J].Kidney Int,2011,79(7):702-707.
[2] 臧丽,刘芳,付平.1,25(OH)2D3与糖尿病肾病[J].中华肾脏病杂志, 2011,27(7):541-544.
[3]Dusso A S,Tokumoto M.Defective renal maintenance of the vitamin D endocrine system impairs vitamin D renoprotection:a downward spiral in kidney disease[J].KidneyInt,2011,79(7):715-729.
[4]兰凯,罗群,周芳芳,等.帕立骨化醇对糖尿病肾病大鼠蛋白尿的影响[J].中华肾脏病杂志,2012,28(7):524-527.
[5]Deb D K,Sun T,Wong K E,et al.Combined vitamin D analog and AT1 receptor antagonist synergistically block the development of kidney disease in a model of type 2 diabetes[J].Kidney Int,2010, 77(11):1000-1009.
[6]Vargas S L,Toma I,Kang J J,et al.Activation of the succinate receptor GPR91 in macula densa cells causes renin release[J].J Am Soc Nephrol,2009,20(5):1002-1011.
[7]Peti-Peterdi J.High glucose and renin release:the role of succinate and GPR91[J].Kidney Int,2010,78(12):1214-1217.
[8]Schnermann J,Briggs J P.Tubular control of renin synthesis and secretion[J].Pflugers Arch,2013,465(1):39-51.
[9]Poschke A,Kern N,Maruyama T,et al.The PGE(2)-EP4 receptor is necessary for stimulation of the renin-angiotensin-aldosterone system in response to low dietary salt intake in vivo[J].Am J Physiol Renal Physiol,2012,303(10):F1435-F1442.
[10]Friis U G,Madsen K,Stubbe J,et al.Regulation of renin secretion by renal juxtaglomerular cells[J].PflugersArch,2013,465(1):25-37.
[11]Kim S M,Briggs J P,Schnermann J.Convergence of major physiological stimuli for renin release on the Gs-alpha/cyclic adenosine monophosphate signaling pathway[J].Clin Exp Nephrol, 2012,16(1):17-24.
[12] Chen L,Kim S M,Eisner C,et al.Stimulation of Renin Secretion by Angiotensin II Blockade is Gsα-Dependent[J].J Am Soc Nephrol,2010,21(6):986-992.
Renoprotective effect of paricalcitol in rats with diabetic nephropathy
Objective To investigate the renoprotective effect of paricalcitol in rats with diabetic nephropathy(DN)and its mechanism.MethodsDiabetic nephropathy was induced by intraperitoneal injection of streptozotocin in rats.The DN rats were randomly divided into DN group(group D)and paricalcitol group(group P),rats in group P were intraperitonealy injected with 0.4μg/kg paricalcitol t.i.w.Healthy non-DN rats served as control group(group N).After 12 weeks,24h urinary protein and serum biochemical indicators were examined.Real-time PCR were used to detect expression of renin mRNA and cyclooxygenase-2 (COX-2)in renal tissue.Immunohistochemistry was used to detect the protein expression of COX-2.ELISA method was used to detect the urine levels of prostaglandin E2(PGE2).ResultsCompared to group N,24-h urinary protein,serum creatinine(SCr), fasting blood glucose(FBG)and parathyroid hormone(PTH)levels and urinary PGE2levels were significantly increased(P<0.05) in groups D and P;the expression of renin mRNA,COX-2 mRNA and protein in renal tissue of groups D and P were also significantly increased(P<0.05).The above indexes of group D were markedly higher than those of group P (P<0.05).The renin level was positively correlated with urinary PGE2(r=0.798,P<0.01)and COX-2 mRNA expression (r=0.722,P<0.01).ConclusionParicalcitol can significantly reduce the proteinuria in rats with diabetic nephropathy,which may be associated with down-regulation of COX-2,PGE2and renin expression.
Diabetic nephropathy Paricalcitol Renin Prostaglandin E2Cyclooxygenase-2


2013-09-23)
(本文编辑:胥昀)
浙江省医药卫生科技立项资助项目(2012KYB175);宁波市自然科学基金资助项目(2011A61003)
315010 宁波市第二医院肾内科
罗群,E-mail:nbluoqun@163.com

